一种含有富里酸及腺苷的葛花解酒产品的研制
(营口理工学院化学与材料工程系,辽宁营口115014)
饮酒已经成了人们生活中的一部分,酒精中毒和饮酒过度所引发的系列问题已经危害到人们的生活,寻找解除或降低乙醇对人体损害的解酒物质是近年来的研究热点[1-10]。葛花(Puerariae flos)又名葛条花,是豆科类植物。葛花中的化学成分主要是黄酮类化合物、皂苷类化合物、挥发油类化合物、氨基酸、甾醇类化合物、生物碱等,其中黄酮类化合物含量居多[11-13]。葛花不仅有解酒保肝的功效,对消化系统也有一定的作用。富里酸是天然的有机化合物,含有氨基、羧基、羟基等多种基团,其可广泛地应用在农业、工业、医疗、环保、食品等领域,同时还具有醒酒防醉、提高机体免疫力、促进纤维细胞的生长、消炎、调节机体代谢功能等作用[14-17]。
腺苷是一种内源性核苷,它遍布人体细胞,可直接进入心肌经磷酸化生成腺苷酸,参与心肌能量代谢,有益肾保肺、降血脂、抗心律失常作用。目前,对拟青霉菌中腺苷的提取与检测报道较少[18-19],课题组采用从富里酸拟青霉菌中得到的腺苷,与葛花提取液、富里酸复配研制解酒产品,不仅可以解决醉酒伤身的问题,而且将有很好的开发应用价值。
1 仪器和材料
1.1 仪器
BLF-YB500高速多动能粉碎机:深圳百利福工贸有限公司;JY系列电子天平、CTH1650台式高速离心机:上海方瑞仪器有限公司;BILON-ZCW-1000W微波·超声·紫外光催化合成仪:上海比朗仪器有限公司;FD-1C冷冻干燥机:巩义市予华仪器有限公司;S6000高效液相色谱仪:华谱科仪(北京)科技有限公司;SPX-250B-D型振荡培养箱:上海博迅实业有限公司。
1.2 材料
葛花:亳州市永刚饮片厂有限公司;琼脂、蛋白胨:北京奥博星生物技术有限责任公司;红糖:广西上上糖业有限公司;腺苷(99%):北京百灵威科技有限公司;42°白酒:北京顺鑫农业股份有限公司;甲醇(色谱纯试剂):国药集团化学试剂有限公司;富里酸:营口理工学院化学与材料工程系应用化学实验室自制。
1.3 实验动物
小鼠(体重20 g~25 g):中国医科大学。
2 试验方法
2.1 葛花有效成分提取
葛花有效成分的提取采用水做溶剂,使用微波、超声协同辅助提取。准确称取粉碎过筛(80目)的葛花粉进行微波和超声辅助提取。
微波和超声辅助提取:将待提物放入提取瓶中安装好仪器,设置试验参数,其中微波功率400 W,超声波功率300 W,温度80℃,时间20 min;收集上清液,将上清液冷冻干燥,计算水溶物提取率,水溶物提取率/%=(水溶物质量/干葛花粉质量)×100;将提取物封口备用。
2.2 富里酸拟青霉菌的培养与干菌的制备
2.2.1 富里酸拟青霉菌的培养
菌种为富里酸拟青霉菌,是从富里酸中筛选出,用沙氏固体培养基接种好的,为保藏菌种,选择红糖液体培养基培养。
2.2.1.1 培养基的制作
红糖液体培养基:称量红糖→加水加热溶解→定容→取液→封口灭菌→取出备用称取40 g红糖,10 g蛋白胨放入1 L烧杯中,加入500 mL纯水,加热煮沸后,再加纯水定容到1 L,完全溶解后,取100mL的液体培养基分别倒入10个250mL的锥形瓶中,用纱布4层~8层封好瓶口,放入灭菌锅里灭菌30 min,灭菌后放入超净台备用。
2.2.1.2 富里酸拟青霉菌培养
待灭菌好的红糖液体培养基冷却至室温后开始接菌,将之前在冰箱保存好的富里酸拟青霉菌种(在沙氏琼脂培养基接种的菌种)取出,在超净台上操作:点燃酒精灯,先用棉花擦手;用火烧一下接种针,待接种针冷却至室温,使用接种针在沙氏培养基菌种上刮一下,将接种针上的菌种放入红糖液体培养基中,接种完成,用纱布封好瓶口,贴上标签“①号菌”;放入37℃恒温箱中培养36 h以形成菌膜,备用。其余9个液体培养基按相同接种方法接种,分别贴上标签②~⑩号菌,恒温培养,备用。
2.2.2 干菌的制备
将①~⑩号菌中的菌膜取出,用纯净水洗去菌膜上残留的培养液后,放置到冷冻干燥仪中冷冻干燥12 h,即得到干菌,收集备用。
2.3 富里酸拟青霉菌中腺苷的提取与检测
2.3.1 拟青霉菌腺苷的提取
1)准确称取富里酸拟青霉菌干菌0.0314g加入30mL纯净水混合。
2)混合液放入反应器-微波·超声·紫外光催化合成仪中,采用微波和超声波协同提取拟青霉菌腺苷,设置提取条件,其中微波功率400 W,超声波功率400 W,温度80℃,时间10 min。
3)高速离心过滤,收集上清液,标记为待测液。
2.3.2 腺苷检测
1)采用高效液相色谱法检测腺苷,色谱条件:色谱柱为 Waters×Bridge C18柱,4.6 mm×250 mm 半微型色谱柱(5 μm);检测器为紫外检测器;检测波长260 nm;流动相为水-甲醇(85∶15,体积比);柱温 30℃;流速0.5 mL/min;
2)腺苷标准溶液配制
用电子天平准确称取腺苷标准品0.020 0 g,加超纯水溶解并定容至50 mL,此溶液每1 mL含0.4 mg腺苷;分别吸取 0.1、0.5、1.0、5.0、10.0、15.0 mL 于 100 mL 容量瓶中,加超纯水定容至刻度,摇匀,可得0.000 4 mg/mL~0.06 mg/mL系列标准溶液。
3)标准样品分析
系列标准样品分别按色谱条件进样,记录色谱图,并根据系列标准品色谱图制作标准曲线。
4)待测样品分析
待测样品(样品液用滤膜过滤后装入测试样瓶中待测,分别是待测液1、待测液2、待测液3)分别按色谱条件进样,记录色谱图,外标法以峰面积检测是否含有腺苷并分析不同提取条件下腺苷的含量,得出最佳提取条件。
2.4 解酒产品复配及其对醉酒小鼠的动物实验
2.4.1 解酒产品复配液的制备
1)解酒产品成分:葛花提取液(2.1中制备)、拟青霉菌腺苷提取液(采用2.3中腺苷提取方法中的最佳提取条件处理菌液,高速离心过滤后收集上清液封口备用)、富里酸。
2)解酒产品复配
A液标号:葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶3∶3(体积比)
B液标号:葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶1∶5(体积比)
C液标号:葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶2∶4(体积比)
D液标号:葛花提取液∶拟青霉菌腺苷提取液∶去离子水=1∶2∶4(体积比)
E液标号:葛花提取液∶去离子水∶富里酸=1∶2∶4(体积比)F液标号:葛花提取液∶去离子水=1∶6(体积比)复配条件:常温,混合各组分后均匀搅拌即可。
2.4.2 解酒实验设计
采用微波和超声波协同提取葛花异黄酮类化合物,高速离心过滤后所得滤液为25 mL,已知冷冻干燥后的水溶物质量为0.146 8 g,由此可得提取液中有效成分浓度为5.872 g/L;富里酸拟青霉菌采用微波和超声波共同处理后,采用高效液相色谱仪检测可知每0.01 mL拟青霉菌腺苷提取液中腺苷含量为0.004 mg,因此提取液中腺苷浓度为0.4 g/L;自制富里酸的浓度3 g/L。
由预实验得到最适致醉量为0.15 mL乙醇/10 g体重。
将实验小鼠禁食12小时后进行解酒实验,观察小鼠从醉酒到醒酒时间内的状态并记录醒酒时间。取小鼠70只,称重标记后随机分为7组(分别为模型对照组、实验组1、实验组2、实验组3、实验组4、实验组5、实验组6),每组10只。设计7种处理方案:
①模型对照组:每只小鼠灌胃0.25 mL/10 g体重生理盐水;10 min后灌胃0.15 mL/10 g体重白酒。
②实验组1:每只小鼠灌胃0.25 mL/10 g体重A液;10 min后灌胃0.15 mL/10 g体重白酒。
③实验组2:每只小鼠灌胃0.25 mL/10 g体重B液;10 min后灌胃0.15 mL/10 g体重白酒。
④实验组3:每只小鼠灌胃0.25 mL/10 g体重C液;10 min后灌胃0.15 mL/10 g体重白酒。
⑤实验组4:每只小鼠灌胃0.25 mL/10 g体重D液;10 min后灌胃0.15 mL/10 g体重白酒。
⑥实验组5:每只小鼠灌胃0.25 mL/10 g体重E液;10 min后灌胃0.15 mL/10 g体重白酒。
⑦实验组6:每只小鼠灌胃0.25 mL/10 g体重F液;10 min后灌胃0.15 mL/10 g体重白酒。
2.4.3 小鼠醉酒、醒酒判断
以“翻正反射”实验判断小鼠醉酒、醒酒状态[20]。给小鼠灌酒后,将其背部向下放在实验台上,如果该姿势保持30 s以上就认为翻正反射消失,此时小鼠为醉酒状态,反之小鼠未醉。给酒后一段时间,当小鼠出现走路不稳,站立也不稳,尾巴拖地现象时,称为拖尾现象。醉酒小鼠出现翻正反射消失的时间为醉酒耐受时间。灌酒后翻正反射消失到恢复的时间为醒酒时间。
3 结果与讨论
3.1 葛花提取液中水溶物含量的分析
葛花粉与去离子水按固液比1∶15(g/mL)混合后,分别采用微波和超声波共同提取、仅超声提取、仅微波提取的方法进行比较研究。3种方法提取结束后,将葛花提取液高速离心,取上清液(滤液)进行冷冻干燥12 h,称量干燥后的粉末质量。
计算提取率。不同提取方法的提取液中水溶物含量如表1所示。
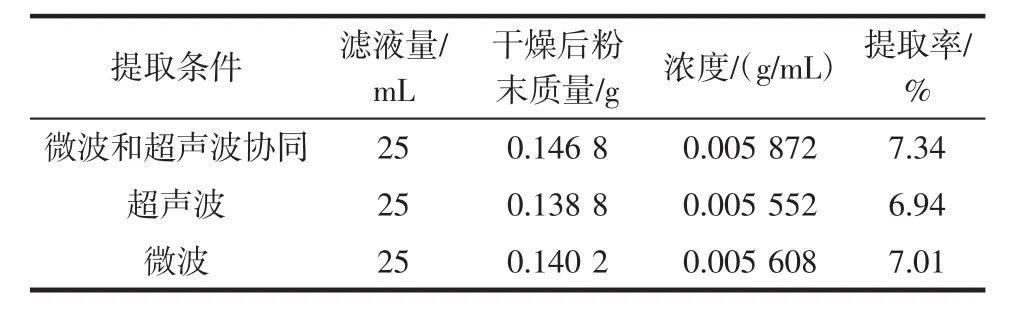
表1 葛花不同提取方法水溶物成分含量Table 1 Pueraria lobata flowers water soluble component content under different extraction methods
结果显示,3种提取条件的提取率由高到低为:微波和超声波>微波>超声波,采用微波和超声波协同提取方法所得水溶物含量最大,提取率可达7.34%,因此复配液中葛花提取液采用微波和超声波协同提取法提取制备。
3.2 富里酸拟青霉菌中腺苷的检测结果分析
将配置的不同浓度的标准溶液,浓度分别为0.0004、0.002、0.004、0.02、0.04、0.06 mg/mL 腺苷标样,按 2.3.2色谱条件进样0.01 mL,以时间为横坐标,吸光率为纵坐标记录色谱图。图1为0.004 mg/mL腺苷标样的色谱图,根据不同浓度的谱图可做出标准曲线。
图1 0.004 mg/mL腺苷标样色谱图Fig.1 0.004 mg/mL adenosine sample chromatogram
采用微波和超声波协同提取腺苷后,使用高效液相色谱仪进行检测,利用ESTD计算法,通过与标准谱图对比分析发现含有腺苷,通过标准曲线计算出当进样0.01 mL时,腺苷含量为0.004 mg,色谱图如图2所示。
3.3 解酒复配液对小鼠解酒效果分析
3.3.1 各组复配液对小鼠醉酒率的结果比较
根据“翻正反射”实验来判断小鼠的醉酒、醒酒状态,记录各组小鼠醉酒只数,得出各组复配液对小鼠醉酒率的影响。实验结果如表2所示。
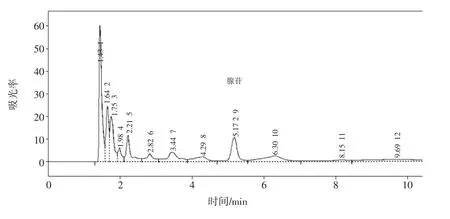
图2 微波和超声波协同提取腺苷色谱图Fig.2 Microwave and ultrasonic synergistic extraction of adenosine chromatogram
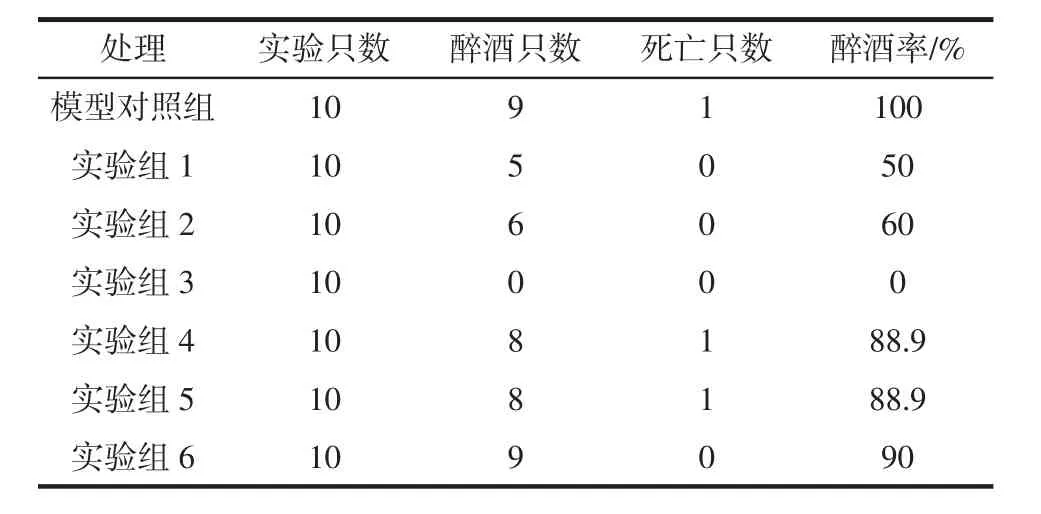
表2 各组复配液对小鼠醉酒率的影响Table 2 The effect of the compound solution on the intoxication rate

表3 各组复配液对小鼠醉酒、醒酒时间的影响Table 3 The effect of the compound solution on intoxication and decanting time of mice

续表3 各组复配液对小鼠醉酒、醒酒时间的影响Continue table 3 The effect of the compound solution on intoxication and decanting time of mice
参照2.4.1解酒产品复配液的制备及模型对照组的配比,由表2得到结果,可以说明模型对照组用生理盐水灌胃小鼠无防醉作用;实验组4~实验组6采用葛花提取液或与拟青霉菌腺苷提取液、富里酸单独复配的防醉作用不明显;实验组1~实验组3同时采用葛花提取液、拟青霉菌腺苷提取液和富里酸防醉作用明显提高,说明拟青霉菌腺苷和富里酸在小鼠防醉作用中起到了主要作用;实验组3与其余实验组相比,醉酒率最低,防醉效果最好;实验组3[葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶2∶4(体积比)]配比中拟青霉菌腺苷与富里酸对小鼠起到了协同增效的防醉作用。
3.3.2 各组复配液对小鼠醒酒结果的比较
记录各组小鼠醉酒时间(拖尾时间)、醒酒时间,记录小鼠整个实验过程的状态,记录如表3所示。
结果显示,与模型对照组相比,实验组1~实验组6的醉酒时间(拖尾时间)均有所延长,并且实验组3呈现显著差异,而其余实验组差异不太显著;醒酒时间,实验组1~实验组6醒酒时间均有所减少,且实验组3差异明显,由此可得出,复配液最佳配比为:葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶2∶4(体积比)时,解酒效果最好。
3.4 最佳条件下复配液各成分含量分析
1)复配液最佳配比为:葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶2∶4(体积比),复配液中富里酸含量达到57.14%,拟青霉菌腺苷提取液占28.57%,葛花提取液占14.29%,该比例所配置的解酒产品解酒效果最佳。
2)采用微波和超声波协同提取葛花有效成分,高速离心过滤后所得滤液为25 mL,冷冻干燥后的水溶物质量为0.146 8 g,由此可得提取液中葛花有效成分含量为:0.005 872 g/mL;富里酸拟青霉菌采用微波和超声波共同处理后,利用高效液相色谱仪检测可知每0.01 mL拟青霉菌腺苷提取液中腺苷含量为0.004 mg,因此提取液中腺苷浓度为:0.000 4 g/mL。得出配置7 mL解酒产品各组分中有效成分的含量如表4。
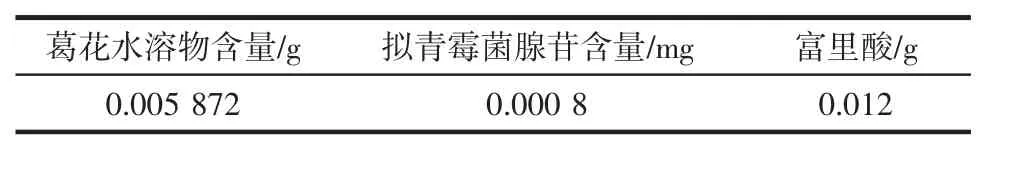
表4 各组分有效成分含量Table 4 Effective component content for compound solution
由表4可知,除富里酸外,葛花水溶物有效成分含量较高,拟青霉菌腺苷含量较低,这些有效成分在解酒产品中起主要解酒功效。
4 结论
1)葛花水溶物采用微波和超声波协同提取,提取率可达7.34%;将红糖液体培养基培养的富里酸拟青霉菌采用微波和超声波协同提取,每0.01 mL试样中含有腺苷量可达0.004 mg。
2)通过醉酒小鼠“翻正反射”实验得出葛花解酒产品复配液最佳配比为,葛花提取液∶拟青霉菌腺苷提取液∶富里酸=1∶2∶4(体积比),其中葛花提取液浓度为5.872 g/L,腺苷的浓度为0.4 g/L;自制富里酸的浓度3 g/L。实验证明该配比对醉酒小鼠有显著的解酒作用,且除了葛花天然的解酒作用外,富里酸及拟青霉菌腺苷在解酒功效上有协同增效的作用;实验采用先给药后给酒的灌胃方法,还在一定程度上体现出该配方产品有防醉功效,因此具有很好的市场价值。

