人工流产次数与高危型人乳头瘤病毒感染和宫颈癌发生的关系研究
段 伟 李红霞 胡海峰 乔 健 刘宁宁
宫颈癌(cervical cancer)是女性主要的恶性肿瘤之一,当前在我国具有普查率低、发病率高、病死率高等特点[1]。流行病学调查显示全球每年约有50万的宫颈癌新发病例,国外宫颈癌发病率有所下降,而国内发病率却呈现上升的趋势[2-3]。宫颈癌具有明确的致病因素和较长的可逆转的癌前病变期,其由宫颈上皮内瘤变逐渐发生到宫颈癌的过程比较长[4]。人乳头瘤病毒(human papillomavirus,HPV)是1种无包膜的小DNA 病毒,可致人类皮肤和黏膜异常增生[5-6]。高危型HPV感染与发生宫颈癌紧密相关,在100%宫颈鳞状细胞癌和70%宫颈腺癌中均可检出HPV[7]。但是绝大多数的HPV感染可在2年内感染消退,不会发展为宫颈癌[8]。同时HPV病毒只侵犯人类,对其它动物无致病性,为此流行性比较弱,在临床上也容易进行诊治,为此研究其他因素对于宫颈癌发生的影响意义重大[9]。人工流产是宫颈癌的主要病因之一,人工流产引起的子宫颈创伤可造成子宫颈移行带区鳞状上皮化生,导致机体对HPV抵抗作用减弱,并随着时间的推移可诱发形成宫颈癌[10-11],但是具体的相关性还无详细的调查报道。本文具体调查了人工流产次数与高危型HPV感染和宫颈癌发生的关系,现报告如下。
1 资料与方法
1.1 研究对象
2011年1月至2015年12月,选择在我院诊治的宫颈癌患者769例作为观察组,同期选择在我院诊治的非宫颈癌及宫颈上皮内瘤变患者769例作为对照组,纳入标准:通过宫颈活组织检查病理结果为宫颈癌患者或行HPV基因检测及宫颈液基细胞学检查的,通过宫颈癌筛查流程除外宫颈癌及宫颈上皮内瘤变者;已婚汉族;年龄20~80岁;同意参加本次研究者;研究得到医院伦理委员会的批准。排除标准:病例资料不全或缺失者;精神疾病患者;既往有其他肿瘤病史及具有肿瘤家族史者。两组年龄、受教育年限、初潮年龄、怀孕次数、分娩次数、体重指数等对比无明显差异(P>0.05),见表1。
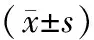
表1 两组一般资料对比
1.2 高危型HPV检测
两组标本采集前3 d停止使用任何妇科外用药物或阴道冲洗,标本采集时患者取截石位,使用窥阴器暴露宫颈,将毛刷在宫颈表面旋转3周后刷取,放入盛有细胞保存液的瓶内,盖好瓶盖,填写患者资料并编号,并将其送往病理科集中检测。
HPV 检测采用PCR扩增技术,HPV分型检测试剂盒由上海基因科技公司生产,检测的13种高危型HPV包括16、18、31、33、35、39、15、51、52、56、58、59、68等,以≥1.0 pg/ml作为HPV感染阳性的诊断标准。
1.3 调查内容
采用制订的统一的调查表由专职医护人员进行调查,内容包括本人及配偶的一般情况(姓名、年龄、文化水平、体重、身高、卫生习惯、被动吸烟)、月经及婚育史(初潮年龄、怀孕次数、分娩次数、人工流产次数),性生活史(开始性生活年龄、配偶是否有包皮过长或包茎)等。
1.4 统计方法
应用SPSS 20.00软件进行分析,计量资料用(均数±标准差)表示,计数数据采用百分比、例数、率表示,检验方法为t检验与χ2检验分析,相关性分析采用直线相关分析与非条件logistic回归分析,P<0.05代表差异显著。
2 结果
2.1 人工流产次数对比
观察组中人工流产0次69例,1~2次200例,≥3次500例;对照组中人工流产0次426例,1~2次300例,≥3次100例,两组对比差异都有统计学意义(P<0.05),见表2。

表2 两组人工流产次数对比/例
2.2 高危型HPV阳性情况对比
观察组与对照组高危型HPV阳性率分别为96.5%(742/769)和21.6%(166/769),观察组高危型HPV阳性率明显高于对照组 (χ2=14.882,P<0.05)。
2.3 相关性分析
以两组患者的一般资料、人工流产次数、高危型HPV阳性率作为自变量,输入logistic回归模型,经多因素非条件logistic回归分析统计得出高危型HPV阳性率、人工流产次数、配偶包皮过长、开始性生活年龄为导致宫颈癌发生的主要独立危险因素(P<0.05),见表3。
直线相关分析得出:观察组高危型HPV阳性率与人工流产次数呈现明显正相关性(γ=0.344,P<0.05)。

表3 影响宫颈癌发生的主要危险因素
3 讨论
女性生殖道感染是全球性的社会及公共卫生问题,宫颈癌是目前妇科恶性肿瘤最为常见的类型之一,也是女性生殖道感染的严重疾病之一,甚至危及女性生命[12]。近年来我国宫颈癌在年轻女性中频频发生,趋向年轻化,在临床上主要表现为接触性阴道出血[13-14]。
HPV感染是生殖道感染的主要类型,也是导致宫颈癌的主要原因。HPV感染可诱导机体细胞免疫及体液免疫,当免疫抑制或免疫缺陷时,生殖器HPV感染和HPV相关疾病的发生率均增加[15]。不过大部分HPV感染是一过性的,多数女性没有明显的临床表现,少数发展为持续感染,进而发展为宫颈癌[16]。本研究显示观察组与对照组的高危型HPV阳性率分别为96.5%和21.6%,观察组的高危型HPV阳性率明显高于对照组(P<0.05),相关研究也表明减少HPV 感染能有效预防宫颈癌的出现。同时也有低危型HPV病毒不会引起宫颈癌,但会引起人体良性肿瘤或疣,也需要进行早期诊断[17]。
宫颈癌具有明确的致病因素和较长的可逆转的癌前病变期,高危型HPV病毒的持续感染将会导致宫颈癌的发生,95%以上的宫颈癌由高危型HPV感染引起[18]。不过很多年轻女性发生的HPV 感染,人体是可以自然清除的,不会导致宫颈癌,为此需要合理综合分析其他相关因素[19]。本研究显示观察组中人工流产0次69例,1~2次200例,≥3次500例;对照组中人工流产0次426例,1~2次300例,≥3次43例,两组对比差异都有统计学意义(P<0.05)。人工流产手术后,宫颈上皮细胞受到机械性损伤,增加了HPV入侵机会,会引起宫颈上皮内瘤变诱发癌变。
本研究多因素非条件logistic回归分析显示高危型HPV阳性率、人工流产次数、配偶包皮过长、开始性生活年龄为导致宫颈癌发生的主要独立危险因素(P<0.05)。女性的第一次性行为年龄偏小时,生殖道的粘膜尚未完全成熟,免疫力相对低下,而对包括HPV在内的多种病毒感染存在易感性[20]。配偶包皮过长存在很大的感染隐患,是感染HPV 的独立因素[21]。相关研究发现,既往有多次人工流产史者宫颈癌的发病危险显著增加,多次人工流产病史者宫颈癌的发病危险将会明显增加,人工流产次数≥2次者宫颈癌的发病危险是人工流产次数<2次者的7倍左右[22-23]。宫颈病变的程度与HPV的DNA含量成正相关性,随宫颈病变程度的加重,HPV 感染率随之升高[24]。同时本研究直线相关分析观察组的高危型HPV阳性率与人工流产次数呈现明显正相关性(γ=0.344,P<0.05)。从机制上分析,人工流产引起的宫颈创伤造成了宫颈移行带区鳞状上皮化生,可刺激导致修复的改变,导致机体对人乳头瘤病毒抵抗作用减弱,使机体容易受到HPV的感染,最后有可能发展为宫颈癌[25]。
总之,宫颈癌的发生是多种因素共同作用的结果,反复人工流产以及高危型HPV感染可诱发宫颈癌的发生,为此需要加强女性对于高危型HPV感染与人工流产危害性的了解,提倡健康的行为习惯,从而减少宫颈癌的发病。

