植物多酚提高柔红霉素耐药白血病干细胞杀伤敏感性的研究
刘小琴 舒华娥 肖 行 陈 西 马 遥
白血病干细胞(leukemic stem cell,LSC)的存在是白血病难治复发的根源,也解释了临床上白血病治疗的难点和疑惑[1]。LSC具有很强的生存优势,对化疗药物耐药[2]。近年来越来越多研究证据表明,白血病复发和耐药的根本原因是LSC的存在,多信号系统紊乱导致其对多种化疗药物如柔红霉素耐药是治疗失败和复发的分子基础[3]。在诱导增敏杀伤概念指导下,采用植物多酚调节凋亡信号通路诱导凋亡和提高其对化疗药物(柔红霉素)敏感性的“自亡和它杀”相结合的新方法,有望达到最大限度清除天然耐药的LSC目的[4]。本研究以人急性髓系白血病KG1a细胞株中获得的CD34+CD38-LSC为靶细胞,通过柔红霉素干预发生耐药后,再采用植物多酚干预耐药的LSC,以增殖抑制率、迁移侵袭能力、凋亡率、内/外源性凋亡通路中关键分子变化为指标,评价植物多酚增强柔红霉素耐药的LSC的敏感性的生物学效应,并探明相关的分子机制,为有效清除LSC提供理论和实验依据。
1 材料与方法
1.1 试剂与仪器
试剂:人急性髓系白血病KG1a细胞株(南京森贝伽生物科技有限公司,中国);PCR试剂盒(上海硕盟生物,中国),MTT试剂盒(北京中杉金桥生物公司,中国),不含血清培养基、含血清的完全培养基(GIBCO公司,USA),异硫氰酸荧光素标记的膜联蛋白(武汉博士德,中国),Transwell 24孔培养板(Corning 公司,USA),凋亡相关基因Bax(Santa Cruz公司)。96孔板、10 cm2培养皿(Corning 公司,USA),含EDTA的胰酶(GIBCO公司,USA)。仪器:80 ℃~4 ℃冰箱(日本松下),高转速冷冻离心机(BiofugeStratos,德国),培养箱(Queue systems,USA),细胞培养超净台(苏州净化,中国),FACSort流式细胞仪(BD公司,USA),倒置相差显微镜(奥林巴斯,日本),PCR仪(Rotor-gene,澳大利亚)-高压消毒箱(美国Tuttnauer,美国)。
1.2 免疫磁珠分选CD34+CD38-白血病干细胞与细胞培养
将计数后的KG1a细胞重悬于PBS中,加入抗人CD38磁珠结合的单克隆抗体,4 ℃孵育30 min,PBS洗涤2次,上机,阴性分选出CD38-的细胞,重新计数重悬于PBS中,加入抗人CD34和CD123磁珠结合的单克隆抗体,4 ℃ 孵育15 min,PBS洗涤2次,阳性分选选出CD34+CD38-的细胞,即为CD34+CD38-白血病干细胞。
将分选的CD34+CD38-LSC置于含双抗及10%胎牛血清的DMEM培养基中培养,37 ℃条件下于5% CO2孵箱中传代。传代条件为当密度达到4×106时,以含0.02%EDTA的胰蛋白酶消化细胞进行再次接种。终止消化的条件为在倒置显微镜下观察到细胞回缩时,此时加入含血清培养基,10 000 r/min离心5 min,弃上清,取细胞悬液,细胞计数接种至新培养基。
1.3 细胞干预
向呈对数生长的细胞加入1 μg/mL柔红霉素干预,细胞增殖从缓慢变迅速,当细胞密度达到4×106,出现耐药的情况下给予植物多酚刺激,对照组不接受相应刺激,并予浓度为12.5 μg/ml的凋亡相关基因Bax刺激14 h收集细胞。
1.4 半定量逆转录聚合酶链反应(RT-PCR)
取实验组及对照组细胞定量100 mg,提总RNA。逆转录cDNA,反应过程按照标准的RT-PCR进行。Caspase-3、Caspase-9的引物:变性-梯度变性进行30次的循环。得到的PCR产物行琼脂糖凝胶电泳,并行凝胶成像。内参选择18 s RNA,对半定量结果进行比对,分析吸光度。
1.5 细胞凋亡与凋亡周期检测
以Annexin V/PI法检测,待细胞冷却至4 ℃,洗涤,并使浓度调整为106/ml,加入PI与Annexin V-FITC,避光15 min后行流式检测。
对收集的细胞加入Annexin V-FITC,采用API的方法检测细胞的凋亡周期,静置1 h之后进行流式检测。
双标流式细胞仪CyclinE/DNA分析周期特异性,处理好的细胞加入PI和RnaseA行DNA染色后行流式检测。
1.6 MTT法检测细胞活力
将细胞接种于96孔板,当细胞汇合度达到50%,予植物多酚10 μl,植物多酚NC。48 h后,加入MTT,继续培养4 h DMSO,震荡使结晶物充分溶解,于酶标仪560 nm处测OD值,细胞相对活力(%)=(实验组OD/对照组OD值)×100%。
1.7 Transwell体外迁移体系
血清饥饿12 h,离心收集细胞,将Transwell培养池放入培养板中,加入细胞悬液(约5×104细胞),含10% FBS的DMEM培养液中培养24 h,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,显微镜下观察。1%十二烷基硫酸钠(SDS)500 μl溶解细胞30 min。100 μl细胞裂解液,放入细胞培养板中,酶标仪测定吸光值。
1.8 统计学方法

2 结果
2.1 鉴定加入植物多酚干预的白血病干细胞的细胞周期
以植物多酚刺激柔红霉素耐药的白血病干细胞,观察细胞增殖的情况:处于静止期的白血病干细胞加入植物多酚后进入G2~M期。
2.2 应用API的方法检测细胞凋亡细胞周期特异性分析
植物多酚诱导柔红霉素耐药的白血病干细胞,在G1期发生细胞凋亡,而对照组几乎未发生细胞凋亡。
2.3 双标流式细胞术CyclinE/DNA对细胞周期分析
植物多酚刺激之后出现在G0、早/晚G1、S2、G2、M期,白血病干细胞处在G0期,加入植物多酚诱导柔红霉素耐药的细胞阻滞在G1期,CyclinE表达下降。
2.4 Caspase-3、Caspase-9 mRNA表达的影响
植物多酚组的Caspase-3、Caspase-9 mRNA表达均较对照组高,差异均具有统计学意义(P<0.05)。随着时间的延长,植物多酚组诱导柔红霉素耐药的细胞凋亡指数呈上升趋势,差异有统计学意义(P<0.05)。见表1,表2。
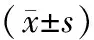
表1 Caspase-3、Caspase-9 mRNA表达比较分析

表2 不同时相血清细胞凋亡指数变化
注:①为与3 h比较,P<0.05。
2.5 植物多酚对白血病干细胞活力的影响
与对照组[(90.48±8.67)%]比较,植物多酚组中柔红霉素耐药的白血病干细胞活力[(52.39±5.96)%]显著降低,差异具有统计学意义(P<0.05)。
2.6 白血病干细胞体外迁移能力
Transwell体外迁移实验结果显示,经植物多酚作用后的耐药白血病干细胞体外迁移的能力明显降低(P<0.05)。第7天,对照组体外迁移细胞数目明显高于植物多酚组(P<0.05),见表3。
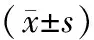
表3 白血病干细胞体外迁移细胞数目
注:①为与0天比较,P<0.05。
3 讨论
白血病是一种常见的造血系统恶性肿瘤,其发病率在我国为4.17/10万[5]。近年来,损伤性污染渐渐严重,由此引起的白血病发病率呈逐渐升高趋势,由于病因尚不明确,治疗难度大[6]。目前白血病的治疗仍以化疗为主。尽管随着临床新药的发展和联合化疗的应用,白血病的缓解率显著上升,但在复发/难治白血病仍未取得突破性进展[4]。近年来越来越多研究证据表明,耐药的根本原因是白血病干细胞的存在[7-8]。白血病干细胞失去正常的增殖分化能力,在多基因和多个信号调节系统上发生异常,具有很强的无控性自主增殖能力。白血病干细胞具有特定的自我更新和增殖能力,通常处于G0期[9],当周围环境改变时,能实现肿瘤的细胞远处转移及浸润,出现大量、快速地增殖,并使肝、脾、淋巴结肿大。
白血病干细胞对放射、药物和自身免疫细胞的杀伤产生强大的抵抗力,内外凋亡途径发生异常改变[10]。这种在基因水平上的突变和调节信号的改变导致了对人体致死剂量水平药物的耐受和抵抗,可从放疗和化疗过程获得的,也可以是固有的。近30年来,白血病的治疗发展进入相对迟滞的平台期,相当数量的病例对当前临床主流的药物缺乏敏感性,使其远期生存率难以得到显著上升,探索有效、新的化疗相关药物就显得尤为重要。当细胞被阻滞在细胞周期中某一个时相时就会出现凋亡,周期性是细胞凋亡的特性,因而多数的肿瘤化疗杀伤肿瘤细胞,是采用该理论诱导细胞在特定的周期内发生凋亡[11]。
近来研究发现,来源于植物的小分子物质,能作用于内、外源性凋亡途径的多个靶点,改变肿瘤细胞周期,还引起多种肿瘤细胞凋亡,抑制其生长[12]。植物多酚组是一大类具有不同结构的化合物,癌症低发与富含植物多酚的食用性植物关系密切[13]。动物实验显示植物多酚组能有效地抑制肿瘤诱发、促进和发展多个阶段,对化学诱发的肿瘤具有抗癌作用[14]。提高化疗药物剂量既不能很好消灭LSC,又带来较大的副作用,且靶向分子药物和传统增敏药物也不能很好增强LSC对化疗药物的反应,因此需要寻找一种新方法,联合应用植物多酚启动内外凋亡途径,作用于LSC凋亡通路多个靶点,增强其对化疗药物敏感性,诱导LSC凋亡,以期最大限度杀灭白血病干细胞[15]。
本研究以API法检测植物多酚对柔红霉素耐药的LSC细胞凋亡诱导情况,以及细胞凋亡的周期特异性。通过细胞核染色,显示了早期细胞凋亡出现伴随着膜外翻的现象。研究结果显示,细胞的周期蛋白是一类在细胞周期中特异性表达的蛋白质,细胞周期的G1期是植物多酚诱导细胞凋亡与周期特异性凋亡的主要时相。刺激细胞周期的依赖性蛋白激酶可以表现细胞的特异性周期,CyclinE/DNA双标流式细胞术通过对细胞所处的位置与细胞CyclinE的表达相结合实现对细胞周期的分析。周期蛋白最大的特点就是时相性,能够获得详细的细胞周期信息。G1期是CyclinE的完全合成期,其中表达最强时是在G1晚期,且CyclinE不会出现在G0期,可见CyclinE能够将G0与G1期进行完全分开。本研究显示细胞在G1期被阻滞,植物多酚诱导后的白血病干细胞CyclinE的表达是下降的,且伴随着凋亡相关蛋白Caspase-3、Caspase-9的高表达;Transwell示,第7天植物多酚组体外迁移能力明显降低;植物多酚组细胞活力下降。
综上所述,白血病干细胞进入细胞周期后细胞凋亡才会变得敏感,在静止期的时候并没有启动周期进程,植物多酚诱导凋亡与柔红霉素耐药的白血病干细胞的细胞周期时相有密切关系,其可抑制细胞活性及迁移侵袭能力。

