黄连在自发性高血压大鼠体内尿液代谢组学的研究
邹林蓁,蒋海强,周洪雷,李运伦
(1.山东中医药大学,山东 济南 250355;2.山东中医药大学附属医院 高血压国家中医临床研究基地,山东 济南 250011)
黄连为毛莨科植物黄连(CoptischinensisFranch.)、三角叶黄连(CoptisdeltoideaC. Y. Cheng et Hsiao)和云连(CoptisteetaWall.) 的干燥根茎,始载于《神农本草经》,列为上品,《药性解》认为黄连味苦性寒,无毒,入心经。主心火炎,目疾暴发,疮疡红肿,惊悸烦躁,天行热疾;《神农本草经》认为黄连“主治热气,目痛,眦伤,泣出,明目,肠澼,腹痛,下痢,妇人阴中肿痛,久服令人不忘”。广泛应用于湿热内蕴、温病热毒、心火亢盛引起的呕吐泻痢、热毒疮疡等症[1]。现代药理学研究表明,其有效成分小檗碱具有抗病原微生物、抗心律失常、降压、抗炎、免疫调节、抗癌和降血糖的作用[2],现有的文献报道多侧重于黄连降血压的直接临床观察或分子生物学研究,鲜有从代谢层面观察其降压本质的大鼠实验研究。本研究以自发性高血压大鼠作为研究对象,采用超高液相色谱-四级杆飞行时间质谱(HPLC-TOF/MS)方法及多种模式识别分析方法,研究SHR大鼠尿液干预前后的变化,挖掘高血压潜在标志物,分析相关的通路,寻找黄连降血压的作用机制,以代谢组学的平台阐述其参与的代谢通路与血压调节的关系。
1 材料与方法
1.1 黄连及其提取液的制备
中药黄连购自山东中医药大学,经山东中医药大学药学院周红雷教授鉴定为道地药材,所购黄连中鉴定的化学成分均依据《中国药典》验证,每克黄连含小檗碱7.63 mg,盐酸药根碱6.01 mg,表小檗碱6.91 mg,黄连碱5.09 mg,盐酸巴马汀7.22 mg,每公斤生药粉末以95%乙醇提取,浸泡1 h,回流提取3次,浓缩减压制成醇提液;滤渣以相同条件溶于水,经水提取,滤后在60℃蒸发浓缩,合并提取液,提取液黄连的浓度为1 g/mL,放置4℃保存。
1.2 分组及给药
本研究草案经山东中医药大学动物实验伦理委员会审批,所有做法均致力于减轻实验动物痛苦。24只SHR雄性大鼠(200~220 g)及7只Wistar雄性大鼠购自北京维通利华(Vital River)公司,证书编号:SCXK(北京)2012-0001。自由取食、饮水,每天给予12 h的光照,饲养环境温度维持在(25±2)℃,相对湿度50%±10%,所有大鼠适应性饲养1周后进行实验操作,每只实验动物被单独放置于代谢笼中,每24 h收集一次尿液样本。24只SHR大鼠被随机分为3组:黄连组(n=8),每天给药1次,给药体积10.001 g/kg;模型组(n=8),每天给药1次,给予等体积的生理盐水;阳性药物对照组(n=8),每天给药缬沙坦1次,给药体积10 mg/kg。7只Wistar大鼠定为正常对照组,给药方式与模型组相同,所有动物连续给药28 d。
1.3 大鼠尿液样本采集及血压测量
1.4 HPLC-TOF/MS分析
1.4.1 色谱条件
Halo-C18色谱柱(2.1 mm×100 mm,2.7 μm,Advanced Materials Technology,Wilmington Delaware,美国),柱温25℃,流动相0.1%甲酸水(A)-乙腈(B),体积流量0.35 mL/min,进样体积5 μL,梯度洗脱条件:0~15 min,10%~60%B,15~20 min,60%~60% B,20~24 min,60%~100% B,24~32 min,100%~100% B。
1.4.2 质谱条件
采用Agilent-6230 time-of-flight (TOF) 质谱仪,电喷雾正离子模式(ESI+),相关参数设置如下:离子源温度 120℃,毛细管电压4 000.0 V,雾化气压35 psi,脱溶剂气温度350℃,脱溶剂气流量9 L/min,采样锥电压40 V,碰撞能量电压175 V,MS扫描范围m/z 100~1 000,碰撞气体为氦气。
1.4.3 数据处理及分析
采用Mass Hunter Qualitative Analysis软件(Agilent Technologies,USA)及R语言(R×64 3.2.2),对原始数据进行去噪峰识别、峰对齐、峰校正和保留时间校正,得到质荷比、保留时间、峰强度组成的三维矩阵,用Metaboanalyst对矩阵进行归一化。统计方法使用ANOVA(P<0.05)及Fold Change (FC=1.2)。主成分分析(Principal component analysis,PCA)及偏最小二乘法(Partial least squares-discriminant analysis,PLS-DA)通过SIMCA-P软件进行,VIP值大于1的变量被认为有意义。
2 结果
2.1 大鼠血压比较
黄连组大鼠平均动脉压在干预前显著高于正常对照组,经过4周干预后,黄连组在第4周降至最低,与模型组相比,平均动脉压显著降低(P<0.05),见图1。

图1 平均动脉血压
2.2 尿液样本HPLC-TOF/MS分析
总离子流图如图2所示,在正离子模式下,正常对照组大鼠的总离子流图在峰数量和峰面积方面与模型组大鼠不同,经黄连干预后,黄连组总离子流图同模型组存在明显差异,在本实验条件下,8~50 min期间峰形态及峰数量存在一定变化,说明3组尿液样本中的内源性代谢物存在显著差异。

图2 总离子流图
2.3 模式识别与判别分析
由于缬沙坦在大鼠体内干预靶点单一,可能会对其他三组数据造成扰动,故本研究纳入黄连组、模型组和正常组,将三组样本的质谱数据进行PCA分析,得到PCA得分图及PLS-DA图,见图3。
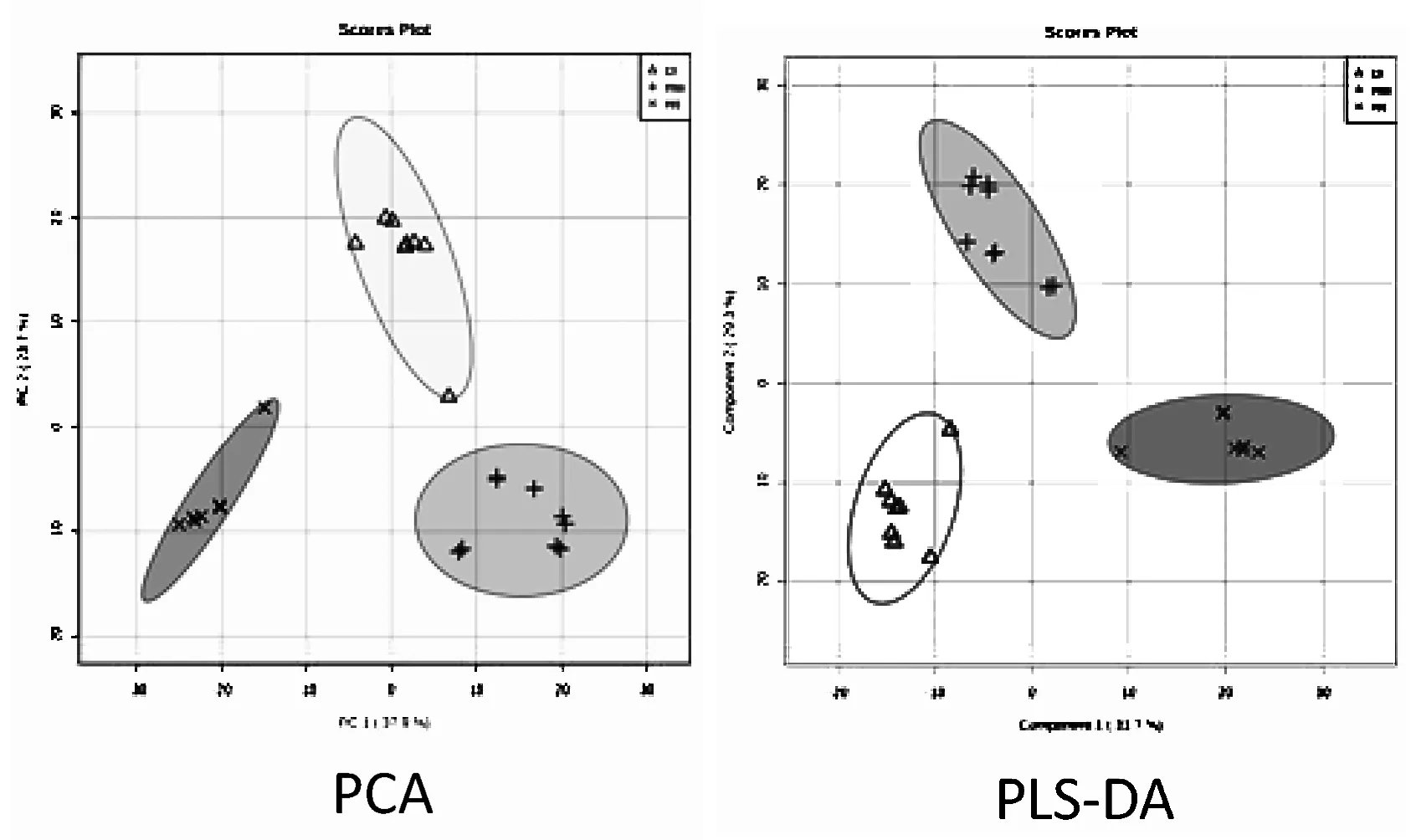
图3 PCA及PLS-DA
2.4 组间差异代谢物的鉴定
通过PLS-DA分析筛选出VIP值大于1的变量,得到其保留时间和质核比,并对这些变量进一步进行单因素方差分析(ANOVA,去除P值大于0.05的变量)和Fold change (FC>2),将差异变量作为潜在生物标志物,根据标志物的精确分子量在HMDB、Metlin、KEGG等网络数据库进行检索,同时参照有关文献,解析化合物质谱并结合二级质谱确证,最终筛选出显著差异代谢物11个,这些标志物可作为体现SHR大鼠干预前后的特征性生物标志物,说明SHR大鼠的色氨酸代谢、嘧啶代谢、花生四烯酸代谢和胆汁酸代谢存在异常,具体信息见表1。
本次实验中,Indoleacetic acid (IAA)、Quinaldic acid(QA)、5-Hydroxyindoleacetic acid(5-HIAA)被认为变化显著,黄连干预后其峰响应度均趋向正常组, 5-HIAA的响应度增加并趋于正常;PGE2和11-Dehydro-thromboxane B2被认为具有显著变化,PGE2响应度下降,Adenine响应度上升。
2.5 代谢通路分析
本实验将鉴定出的11种差异标志物的HMDB号输入Metaboanalyst网页的通路分析模块,绘制出代谢通路分析图,共鉴定出4个代谢通路,包括色氨酸代谢、嘧啶代谢、花生四烯酸代谢和胆汁酸代谢,均为与炎症反应和脂质代谢有关的代谢途径,这说明SHR大鼠存在血管炎症状态,黄连可能通过参与上述代谢调节SHR大鼠血压;同时,本实验发现维生素E的代谢和胆汁酸代谢存在异常,在高血压炎症状态下的SHR大鼠是否同时存在维生素和胆汁酸代谢的异常,这些具体作用机制仍需进一步探讨。见图4。
3 讨论
3.1 脂质代谢与炎症状态的调节
3.1.1 IDO酶与L-kyn通路,SERT与5-HT通路
QA和IAA是色氨酸-犬尿氨酸(L-tryptophan-L-kyn)分解通路的产物,5-HIAA是色氨酸-5-羟色胺(L-trptophan-5-HT)分解通路的产物。色氨酸代谢与其中的酶被认为与健康状况和脂质情况有强烈相关[3]。其中,IDO酶参与众多代谢过程,它可受炎症因子诱导,与年龄、颈动脉内膜厚度、BMI指数、LDL和炎症状态呈正相关,与HDL水平呈负相关。上升的LDL和下降的HDL既不利于血管内皮结构和功能的完整,也可使IDO酶活性增强,进而增加L-kyn代谢通路产物的水平[4]。黄连素具有降脂作用[5],通过改善脂质代谢影响脂蛋白对血管壁的作用,影响IDO酶以及其参与的中枢神经系统[6]。在给予黄连后,L-kyn通路的产物比模型组下降,说明在给予黄连后SHR的L-kyn通路被调控。另外黄连良好的消炎作用也能通过改善炎症状态调节IDO酶的活性。L-kyn通路在心脑血管调节与血压调节中起重要作用[4],因此黄连或许可以通过调节脂蛋白和炎症状态直接改善血管内皮与血流动力学,通过影响IDO酶间接影响SHR的神经系统,达到调控血压的目的。

表1 标志物信息

图4 通路拓扑分析
5-HIAA是5-HT的分解产物,5-HT被认为具有收缩血管与抑制中枢神经系统的作用[7],因此控制5-HT可以控制外周血管的收缩。5-HT的重吸收过程类似于儿茶酚胺类神经递质,重吸收后的5-HT被降解和灭活,不再发挥肠道和神经毒性[8],在这一过程起重要作用的是5-HT转运体(SERT),在给予黄连后,5-HIAA的响应度增加并趋于正常,我们猜测黄连作用于SERT从而加速了5-HT的重吸收。《神农本草经》认为黄连“主治下痢”,提示黄连不仅控制外周血管收缩,还可调节肠道微环境,这一假设值得进一步探索。
3.1.2 PGE2与凝血状态
炎症反应是诸多心血管疾病共有的病理状态。在本次研究中,花生四烯酸的代谢产物PGE2和11-Dehydro-thromboxane B2被认为具有显著变化, PGE2来自还加氧酶COX2催化的花生四烯酸,参与炎症反应,PGE2具有促进血小板聚集的生物学效应[9],黄连具有良好的抗炎作用,可通过降低细胞内Ca+浓度抑制COX2mRNA表达及COX2催化活性、抑制膜磷脂释放花生四烯酸酶[10],使PGE2减少,抑制血栓形成,改善高血压大鼠的血流动力学。
在SHR大鼠的炎症状态下,已检测到花生四烯酸代谢的异常;而维生素的代谢、胆汁酸代谢与花生四烯酸代谢可相互影响[11]。维生素E可参与胆汁酸的合成代谢,维生素代谢、胆汁酸代谢可共同影响花生四烯酸代谢。在胆汁酸合成过程中,起关键作用的7α羟化酶可促进胆固醇向胆汁酸的转化[12]。这一转化过程可以起到保肝、降脂的作用。胆酸螯合剂类药物可以螯合肠道中的游离胆汁酸促进其在粪便的排出[13],使胆汁酸的肠肝循环被切断,激活7α羟化酶,加速更多胆固醇转化为胆汁酸,进而起到降脂保肝的作用。实验表明,黄连中的主要成分小檗碱可通过促进胆固醇7α羟化酶(CYP7A1)上游调控因子CXRα/PPARαmRNA的表达,促进大鼠肝内CYPTA1mRNA的蛋白表达及活性,使高脂血大鼠肝内胆固醇减少、胆汁酸增加,粪便中胆固醇和胆汁酸的增多[14]。黄连在临床上被广泛用于消化疾病,它很可能作用于SHR的肠肝循环,发挥类似于降胆宁在胆固醇转化方面的作用。这值得我们获取更多证据来探索黄连在高血压状态下对肠肝循环的作用机制。
3.2 腺嘌呤(Adenine)与炎症状态、能量代谢
在高血压发病机制中,胰岛素抵抗和胶原生成升高血压的作用不可忽视[15]。Adenine是核酸的组成成分,在心肌缺血时其表达下调。Adenine的代谢产物腺苷酸在临床上被广泛应用以补充心肌能量,黄连具有保护心肌、提高胰岛素敏感性、抑制胶原因子转录的作用[16],可通过增加大鼠左心室肌中cAMP含量增强大鼠的心肌收缩力,提高心室肌内NO含量,抑制心肌纤维化及心室重构,上述皆作用于对腺苷酸活化蛋白激酶(AMPK)的调节[17]。而且AMPK的激活还可抑制COX2和后来产生的前列腺素(PGE2)的释放[18]。炎症与氧化损伤的修复除了上文提到的与花生四烯酸、IDO酶的关系,也与AMPK的激活和NF-KB通道的限制有关。黄连被认为能调节NF-KB来修复内皮功能受损[19],在本实验中,PGE2响应度下降,Adenine响应度上升,可能与黄连激活了AMPK,修复炎症状态有关,而这一可能性同时也能带来心肌能量代谢的改变、胰岛素抵抗的抑制,减弱胶原对血管壁的破坏。
3.3 胞啶(Cytidine)与氧化应激、脂质调节
氧化应激影响动脉弹性和功能,参与多种疾病的病理过程。嘧啶分解产物β-丙氨酸是肌肽的重要组成成分,肌肽具有抗氧化的作用[20],可应对氧化应激对高血压大鼠带来的损伤。在对高脂血症患者的代谢组学研究中,也检测到了IAA和Cytidine的变化,说明高脂血症患者存在色氨酸代谢和DNA代谢的变化[21],血脂异常作为心血管疾病的重要危险因素,可导致内皮细胞功能异常和氧自由基的增加,这个病理变化同样对血压有一定的威胁,提示我们IAA、胞啶同时作为高脂血症、高血压病共有的异常代谢物,应引起我们足够的关注。有研究表明,黄连能显著降低糖尿病大鼠MDA,ET-2和ICAM-1的水平及动脉损伤程度,增加NO和SOD含量[22],降低ox-LDL诱导的内皮损伤程度[23]。黄连还可抑制由过氧化氢和细胞色素c诱导的DNA的割裂[24],同样提示黄连能发挥对SHR的生物大分子的保护作用;伴随上升的β-丙氨酸能减轻氧化应激对SHR血管及脏器的损害,这可能是黄连参与氧化应激的靶点所在。
4 小结
本实验以自发性高血压大鼠为研究对象,运用代谢组学检测到其尿液中的异常代谢物,都不是独立作用的,参与诸多病理环节,应引起我们足够的关注。本实验中,SHR大鼠体内有关炎症反应和脂质调节的代谢存在干预前后的差异,通过观察5-HT分解产物、胆汁酸代谢产物的变化,以及综合黄连在临床中”清中下焦湿热”的功效,提示我们消化系统在血压调节方面或发挥着一定作用,这值得我们获取更多证据来探索黄连在高血压状态下对肠肝循环的作用机制。黄连降脂、降压效用已为现代临床及实验广泛应用及验证,但由于中草药多成分、多靶点的特点,使其作用机制难以直接阐明。本实验发现,黄连能够干预病理状态下色氨酸代谢、嘧啶代谢、花生四烯酸代谢和胆汁酸代谢,可以通过调节脂蛋白和炎症状态直接改善血管内皮与血流动力学,达到调控血压的目的。

