重组幽门螺杆菌多价疫苗CTB-HUUL免疫治疗效果研究*
柯 鸿,潘龙瑞, 牛晓娟△
1. 湖北医药学院附属人民医院 血液内科(十堰 442000 );2. 湖北医药学院 药理学教研室(十堰 442000 )
1983 年 Barry J. Marshall和 J. Robin Warren首次在慢性活动性胃炎患者的胃黏膜中分离出了幽门螺杆菌(H.pylori),并通过大量实验研究[1-3]逐渐证实了,感染H.pylori是引起人类胃炎、消化性溃疡、胃黏膜相关淋巴样组织淋巴瘤(MALT)及胃癌等上消化道疾病的主要病因,进而打破了传统胃溃疡学说所认为的胃溃疡主要是由压力、刺激性食物及胃酸分泌过多所引起的理论。H.pylori感染超过全世界50%的人口,其感染具有持续性和易复发性等特点,感染后很难被机体自然清除[4]。2012年Maastricht-IV 共识会议推荐的标准化治疗H.pylori感染方案为质子泵抑制剂、阿莫西林加上甲硝唑或克拉霉素的“三联疗法”[5]。但由于抗生素治疗H.pylori感染易出现清除后再次感染,菌株耐药现象越来越严重等问题,从而使得H.pylori疫苗的研发显得较为迫切[6]。令人振奋的是,中国率先研制出了“口服重组H.pylori疫苗”,成为世界上首个预防性H.pylori疫苗,其Ⅲ期临床试验[7]结果显示,在未感染H.pylori的6~15岁儿童体内疫苗保护效率为71.8%。但针对H.pylori已感染人群,还缺乏有效的治疗性疫苗。
本研究根据文献[8-9]资料,查找出了H.pylori相关黏附分子,即鞭毛黏附素A亚单位(HpaA)、尿素酶A亚单位(UreA)、尿素酶B亚单位(UreB)抗原的10个显性表位序列HpaA88-100、HpaA132-141、UreA27-53、UreA183-203、UreB229-251、UreB317-329、UreB321-339、UreB373-385、UreB438-452、UreB546-561,将表位序列串联后,在其C端引入H.pylori黏附分子抗原细胞毒素相关蛋白L (CagL),并在其N端引入分子内黏膜佐剂CTB,构建了重组H.pylori多价疫苗靶抗原CTB-HpaA-UreA-UreB-CagL(CTB-HUUL)。初步研究了疫苗靶抗原CTB-HUUL的免疫原性及免疫反应性,并探讨了其对感染H.pyloriSS1的BABL/c小鼠模型的免疫治疗效果。
1 材料与方法
1.1 小鼠及菌株
SPF级BABL/c小鼠,雌性,6周龄,体重14~18 g,购自湖北医药学院实验动物中心。H.pyloriSS1为本实验室传代保种。
1.2 仪器与主要实验试剂
AKTA pure 25蛋白纯化仪、Ni2+ Sepharose 6FF层析填料、HiLoad Superdex75 16/300分子筛层析预装柱购自GE公司;T4 DNA连接酶、胶回收试剂盒、质粒提取试剂盒购自TIANGEN;蛋白胨、酵母抽提物购自OXOID公司;其他试剂为进口或国产分析纯。
1.3 疫苗靶抗原CTB-HUUL的设计与基因合成
通过Linker序列(EFM、GS、KK)将以下肽段序列进行串联,CTB、HpaA88-100、HpaA132-141、UreA27-53、UreA183-203、UreB229-251、UreB317-329、UreB321-339、UreB373-385、UreB438-452、UreB546-561、CagL,即CTB-HpaA-UreA-UreB-CagL(CTB-HUUL)。密码子优化后,由上海生工进行基因合成。CTB-HUUL氨基酸序列如下:
MIKLKFGVFFTVLLSSAYAHGTPQNITDLCAEYHNTQIHTLNDKIFSYTESLAGKREMAIITFKNGA
TFQVEVPGSQHIDSQKKAIERMKDTLRIAYLTEAKVEKLCVWNNKTPHAIAAISMANEFMEQILQ
NQGYKVISKKDPKRTIQKKSGSGVKLNYTEAVALISARVMEKARDGNKSKKSVELIDIGGNRRIF
GFNALVDGSSAINHALDVADKYDVQVAIHTDTKKMLMVCHHLDKSIKKKCHHLDKSIKEDVQFA
DSRIKKITRTWQTADKNKKKKSPAFFGVKPNMIIKGKKFVDGKEVTSKPANKVSGSKNLDEIFST
TSPSANDKMGEEDALNIKKAAMALRGDLALLKANFEANELFFISEDVIFKTYMSSPELLLTYMKIN
PLDQKTAEQQCGISDKILVLYCEGKLKIEQEKQNIRERLETSLKAYQSNIGGTASLITASQTLVES
LKNKNFIKGIRKLMLAHNKFLNYLEELDALERSLEQSKRQYLQERQSS
1.4 重组质粒pET28a(+)/CTB-HUUL构建
将pET28a(+)载体、目的基因CTB-HUUL通过Nco I、Xho I限制性内切酶进行双酶切,琼脂糖凝胶电泳回收后,二者以分子摩尔比1∶3进行酶连(16 ℃、2 h),将连接产物转化至E.coliDH5α感受态中,LB固体平板倒置培养过夜(37 ℃)。第2天挑取单克隆菌落进行扩增培养,提取质粒,酶切鉴定正确后,送上海生工进行质粒测序鉴定。
1.5 重组蛋白CTB-HUUL的表达及纯化
将测序正确的重组质粒pET28a(+)/CTB-HUUL转化至E.coliBL21(DE3)感受态中。挑取单克隆至100 mL LB液体培养基中,37 ℃、220 r/min培养过夜。第2天以1∶100接种至2 000 mL LB液体培养基中,培养至OD600约0.6,加入IPTG至终浓度为0.5 mmol/L,22 ℃、220 r/min继续诱导18 h。5 000 r/min,离心半径10 cm,离心20 min,收集菌体,PBS清洗菌体1次;超声裂解液重悬菌体,超声30 min;22 000 r/min,离心半径10 cm,离心30 min,之后再重复离心1次,收集上清;0.22 μm过滤,备用。采用Ni Sepharose 6 FF层析填料进行镍离子亲和层析纯化,纯化结合缓冲液为20 mM Tris-HCl、150 mM NaCl、10 mM咪唑,pH7.4;洗脱缓冲液为20 mM Tris-HCl、150 mM NaCl、500 mM咪唑,pH7.4。之后,将蛋白浓缩至5~10 mg/mL,采用HiLoad Superdex75 16/300预装柱进行分子筛层析纯化,分子筛层析纯化缓冲液为20 mM Tris-HCl、150 mM NaCl,pH7.4。SDS-PAGE检测其纯度后,调整其浓度为4 mg/mL,液氮速冻后,-80 ℃保存。
1.6 Western Blot
蛋白样品经SDS-PAGE凝胶电泳分离(浓缩胶电压80 V、10 min;分离胶120 V、60 min),采用半干转法进行转膜,调整电压至24 V,恒压转PVDF膜1 h。TBST洗涤1次后进行5%脱脂奶粉室温封闭30 min,TBST洗涤4次,5 min/次。分别添加鼠抗H.pylori抗体(1∶1 000稀释)(Thermofisher scientific,美国)、鼠抗CTB抗体(1∶1 000稀释)(Abcam,美国),室温孵育2 h,TBST洗涤4次,5 min/次。再分别添加HRP标记的羊抗鼠IgG(1∶10 000稀释)(Sigma,美国),室温孵育1 h,TBST洗涤4次,5 min/次。采用Immobilon Western Chemiluminescent HRP Substrate(Millipore,美国)试剂进行Werstern Blot显影。
1.7 ELISA
采用ELISA包被液将重组蛋白rHpaA、rUreA、rUreB、rCagL稀释至1 μg/mL,100 μL/孔,4 ℃过夜。PBST洗涤4次,封闭液37 ℃封闭2 h。抗体稀释液稀释待检血清(PBS组、CTB组、CTB-HUUL组),100 μL/孔加入酶标板,37 ℃孵育1 h。PBST洗涤4次,加入HRP标记的羊抗小鼠IgG(1∶10 000),37 ℃孵育1 h。PBST洗涤4次,加入TMB底物显色液100 μL/孔,37 ℃避光反应15 min。各反应孔中加入2 mol/L硫酸50 μL,终止反应。酶标仪测定450 nm处的吸光度值。
1.8 CTB-HUUL免疫治疗效果评价
SPF级BABL/c小鼠,雌性,6周龄共18只,随机分为3组,每组6只。口服灌胃H.pyloriSS1,菌落总数为108菌落形成单位(colony-forming units,CFU),灌胃1 次/d,连续灌胃4次。末次灌胃后4周,CTB-HUUL组和CTB组口服灌胃重组蛋白200 μg/次,1次/周,连续免疫治疗4次。PBS组按照同样程序灌胃PBS。末次免疫后2周,脱颈处死小鼠,取出小鼠胃组织,沿着胃大弯一分为二。将其中1/2胃组织放入2 mL EP管中,组织匀浆器进行匀浆,梯度稀释,涂布幽门螺杆菌选择性固体平板进行菌落计数;另外1/2胃组织进行冰冻切片,HE染色。
1.9 统计学方法
2 结果
2.1 重组质粒pET28a(+)/CTB-HUUL酶切鉴定
pET28a(+)/CTB-HUUL经Nco I、Xho I双酶切后,琼脂糖凝胶电泳时出现1条约1 500 bp的条带,与CTB-HUUL基因理论大小1 521 bp一致。测序结果与CTB-HUUL基因理论序列100%一致,重组质粒pET28a(+)/CTB-HUUL构建正确(图1)。
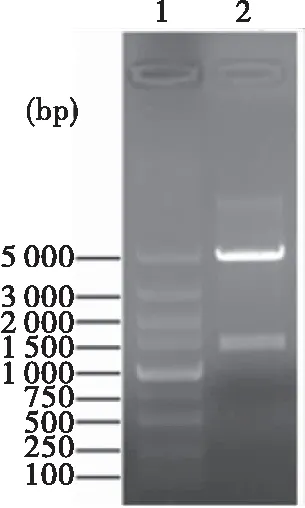
图1 重组质粒pET28a(+)/CTB-HUUL酶切鉴定
2.2 重组蛋白CTB-HUUL表达及纯化
pET28a(+)/CTB-HUUL转化至E.coliBL21(DE3)中,经终浓度为0.5 mmol/L 的IPTG诱导表达后,SDS-PAGE电泳检测结果显示,诱导后的菌体在55 kDa处出现了目的蛋白条带,与CTB-HUUL理论蛋白大小一致,灰度扫描结果显示目的蛋白表达量占菌体总蛋白的18.7%。重组蛋白CTB-HUUL经镍离子亲和层析柱和分子筛预装柱纯化后,SDS-PAGE检测其纯度为93.1%(图2)。

图2 重组蛋白CTB-HUUL的诱导表达及纯化
2.3 Western Blot鉴定重组蛋白CTB-HUUL
重组CTB蛋白、重组CTB-HUUL蛋白经SDS-PAGE电泳分离后,分别进行考马斯亮蓝染色及Western Blot分析。重组CTB-HUUL蛋白均可以与鼠抗CTB抗体及鼠抗H.pyloriSS1血清发生特异性反应;而重组CTB蛋白只能与鼠抗CTB抗体发生特异性反应,却不能与鼠抗H.pyloriSS1血清发生特异性反应(图3)。
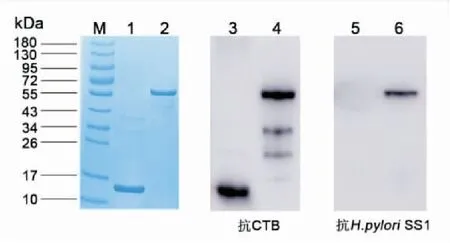
图3 Western Blot鉴定重组蛋白CTB-HUUL
2.4 ELISA鉴定重组蛋白CTB-HUUL的免疫原性及免疫反应性
ELISA结果显示,CTB-HUUL组小鼠血清体外均可以与重组蛋白rHpaA、rUreA、rUreB、rCagL发生特异性反应,与CTB组、PBS组相比差异有统计学意义(P<0.01)。证实了重组H.pylori疫苗CTB-HUUL是多价疫苗,具有良好的免疫原性和免疫反应性(图4)。
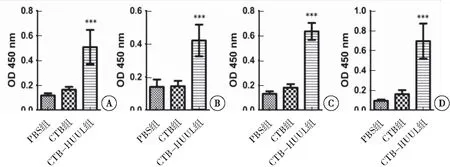
图4 ELISA鉴定重组蛋白CTB-HUUL的免疫原性及免疫反应性
2.5 口服重组H. pylori多价疫苗CTB-HUUL免疫治疗效果
对口服重组H.pylori多价疫苗CTB-HUUL免疫治疗效果,以免疫治疗后小鼠胃组织H.pyloriSS1定植量、胃组织炎症损伤程度2个指标进行评价。免疫治疗后小鼠胃组织H.pyloriSS1定植量,CTB-HUUL组与PBS组、CTB组相比较,定植量明显降低(P<0.01)(图5A)。免疫治疗后小鼠胃组织炎症损伤程度CTB-HUUL组较PBS组、CTB组损伤程度轻微,炎症细胞浸润较少(图5B)。

图5 口服重组H. pylori多价疫苗CTB-HUUL免疫治疗效果
3 讨论
H.pylori是一种单极、末端钝圆、多鞭毛、呈典型螺旋状或螺杆状的革兰氏阴性细菌。人体胃部环境呈强酸性(pH值约为 1~2),在此条件下H.pylori存活的时间极为短暂,因此,经口进入胃组织中的H.pylori必须尽快穿过胃黏液层,通过其黏附因子与胃上皮细胞上相应的黏附因子受体结合,黏附并定植于胃上皮细胞层,进而感染机体,引发一系列上消化道疾病。在此过程中,H.pylori表面的尿素酶、鞭毛及黏附因子扮演着重要角色。
尿素酶是H.pylori疫苗发展中最受关注并且广泛使用的抗原,中国率先研制出的“口服重组H.pylori疫苗”正是以UreB为疫苗靶抗原的亚单位疫苗,Ⅲ期临床试验结果显示其在未感染H.pylori的6~15岁儿童体内的疫苗保护率为71.8%[7]。尿素酶是一种能够水解尿素的金属酶,约占H.pylori菌体蛋白总量的10%~15%,其分子量约为550 kDa,其单体由A、B两个亚单位组成(A、B两个亚单位的相对分子量分别约为30、62 kDa,比例为1∶1,其中A亚单位为尿素酶活性部位,而B亚单位为结合部位,呈六聚体[10]。尿素酶水解尿素产生的氨能够中和胃酸,升高H.pylori菌体周围的pH,使得H.pylori能够顺利穿过胃黏液层到达胃黏膜表面,进而达到定植和损伤胃组织的目的;尿素酶分解尿素产生的氨还可以改变胃黏液中黏蛋白的黏弹性,进而更有利于H.pylori快速通过黏液层抵达胃黏膜[11]。
HpaA是表达在H.pylori表面的一种脂蛋白,为H.pylori定植所必需[12]。由于其在H.pylori不同菌株之间高度保守,因此,HpaA被认为是最有潜力的H.pylori疫苗候选抗原之一。利用重组表达的HpaA蛋白口服免疫小鼠能够激发出有效的抗H.pylori治疗性免疫应答[13]。
细胞毒素相关蛋白 A (CagA)是 CagA+H.pylori编码的一种重要毒力因子,由 Cag 致病岛(Cag PAI)所编码、经H.pyloriⅣ型分泌系统 (T4SS)分泌并注入胃上皮细胞内,具有致癌作用[14]。CagL是H.pyloriⅣ型分泌系统纤毛状结构的一个表面蛋白,CagL可以与胃上皮细胞表面上的整合素α5β1跨膜受体结合,进而介导CagA进入宿主细胞,进而造成细胞病变和疾病的发生[15]。
本研究选择H.pylori黏附因子相关抗原HpaA、UreA、UreB及CagL作为口服重组H.pylori多价疫苗的靶抗原,但考虑到重组蛋白HpaA、尿素酶的脂溶性及分子量太大等问题,因此,本研究根据文献资料的报道,查找出了H.pylori相关黏附分子(HpaA、UreA、UreB)抗原的10个显性表位序列HpaA88-100、HpaA132-141、UreA27-53、UreA183-203、UreB229-251、UreB317-329、UreB321-339、UreB373-385、UreB438-452、UreB546-561,将其串联后,在其C端引入了CagL,并在其N端引入了分子内黏膜佐剂CTB,构建了重组H.pylori多价疫苗靶抗原CTB-HpaA-UreA-UreB-CagL(CTB-HUUL)。SDS-PAGE检测CTB-HUUL蛋白纯度为93.1%,可以很好满足小鼠免疫治疗要求;Western Blot结果显示,CTB-HUUL蛋白均可以与鼠抗CTB抗体及鼠抗H.pyloriSS1血清发生特异性反应;ELISA结果显示,CTB-HUUL组小鼠血清体外均可以与重组蛋白rHpaA、rUreA、rUreB、rCagL发生特异性反应,证实了CTB-HUUL为H.pylori多价疫苗,具有良好的免疫原性和免疫反应性。口服重组H.pylori多价疫苗CTB-HUUL的免疫治疗效果显示,CTB-HUUL组小鼠胃组织H.pylori SS1培养计数结果较CTB组和PBS组明显降低(P<0.01),CTB-HUUL组小鼠胃组织炎症损伤程度及炎症细胞浸润程度较CTB组和PBS组轻微。
综上所述,本研究获得了纯度为93.1%的口服重组H.pylori多价疫苗靶抗原CTB-HUUL,其具有良好的免疫原性和免疫反应性,BABL/c小鼠口服CTB-HUUL后体内的H.pylori定植量和病理损伤程度均得到了明显降低。