MMP-12及其抑制因子TIMP-1在基底细胞癌和鳞状细胞癌患者皮损中的表达
司海鹏 高丽丽 王剑蓉
基底细胞癌(basal cell carcinoma, BCC)和皮肤鳞状细胞癌(squamous cell carcinoma,SCC)统称为非黑色素瘤皮肤癌(non-melanomatous skin cancer, NMSC),两者皆起源于表皮角质形成细胞,具有较高的发生率,给患者带来身体和精神的双重压力[1]。基质金属蛋白酶12(matrix metalloproteinase-12,MMP-12,也称巨噬细胞金属弹力酶)能够广泛降解如IV型胶原、纤连蛋白、层黏连蛋白、玻连蛋白、硫酸软骨素和肝素钠等细胞外基质,据报道,MMP-12具有抗肿瘤发生和促肿瘤发生的双重效应[2,3]。基质金属蛋白酶组织抑制因子(tissue inhibitor of metalloproteinase, TIMP)可以特异性地结合MMPs进而发挥调节作用,是MMP-12主要的抑制剂。多数研究表明除了乳腺癌、结肠癌等常见肿瘤[4,5],在皮肤恶性黑色素瘤及皮肤鳞状细胞癌中[6-8]MMP表达增高并促进肿瘤进展,TIMP对MMP具有较强抑制作用,而在NMSC中二者的表达及意义报道较少,本研究应用免疫组化法检测正常皮肤、BCC患者皮肤及SCC患者皮肤组织中MMP-12及TIMP-1的表达,探讨其与NMSC发生的关系。
1 资料与方法
1.1 一般资料 选取2012年1月至2017年12月间我院门诊及住院患者的基底细胞癌及皮肤鳞状细胞癌手术切除标本共56例,均经组织病理证实。其中BCC患者31例,年龄36~83岁,平均61.25岁,男17例,女14例;头面部24例,躯干部7例。SCC患者25例,年龄29~82岁,平均61.2岁,男15例,女10例;其中头颈部10例,外生殖器8例,四肢5 例,躯干2例;按分化程度分为高分化组10例,中分化组8例,低分化组7例。另取我院皮肤科及外科手术切除正常皮肤20例作为对照。
1.2 试剂 鼠抗人多克隆抗体MMP-12、鼠抗人单克隆抗体TIMP-1购自广州莱德尔公司。枸橼酸抗原修复液、DAB显色液均购自武汉博士德。
1.3 免疫组化 每个组织块进行3 μm连续切片,经脱蜡、H2O2(过氧化氢)封闭、热修复后PBS洗涤3次,血清封闭,滴加一抗,一抗37℃孵育1 h后,PBS清洗3次,滴加二抗试剂,最后经DAB显色、苏木素复染,用已有阳性片子作阳性对照,使用不加一抗片子作为阴性对照。结果判断标准:胞质内出现黄色颗粒状物质判为阳性,并按着色强弱分级:无着色为0分,浅黄色划为1分,深黄色为2分,棕褐色为3分。随机选取5个视野,计算阳性细胞所占的百分比均值:无阳性细胞为0分,阳性细胞1%~10%为1分,11%~50%为2分,51%~75%为3分,75%以上为4分。将上述两项评分标准相加可得表达强度积分:<2分为阴性(-),≥2分且<3分为弱阳性(+),≥3分且<4分为阳性(++),≥4分为强阳性(+++)。
1.4 统计学方法 应用SPSS 19.0软件对结果进行数据分析,计量资料和计数资料分别采用方差分析和卡方检验,P<0.05为有显著性差异。
2 结果
2.1 MMP-12与TIMP-1蛋白表达情况 MMP-12在正常对照表皮中几乎不表达,在真皮区域的成纤维样细胞呈弱阳性表达。31例BCC中MMP-12阳性表达为14例(45.2%),呈弱阳性弥散于癌巢。25例SCC患者中阳性表达20例(80%),阳性细胞在癌巢内表达,阳性较强者主要位于癌巢中心,癌巢增殖区域反而着色略淡,也可观察到癌巢周围间质中部分巨噬细胞、成纤维样细胞有少量阳性表达。TIMP-1在正常对照表皮中呈现大量阳性表达,31例BCC患者中有21例呈阳性表达(67.7%)。25例SCC患者中TIMP-1阳性表达15例(60%),高分化的SCC可见癌巢区域大片的表达,而在低分化者中表达减弱。BCC、SCC与正常组比较,均具有统计学差异。见表1及图1。
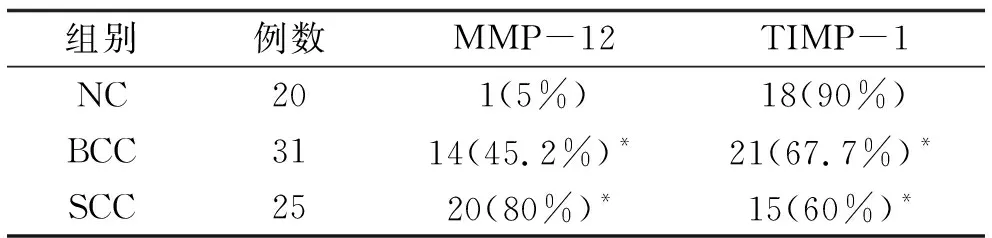
表1 MMP-12与TIMP-1在正常组织、BCC及SCC中的阳性表达
注:*与正常组比较,P<0.05
2.2 不同分化程度SCC中MMP-12与TIMP表达情况 MMP-12蛋白表达水平随着肿瘤分级的增高而增高,即在低分化鳞癌的表达明显高于高分化组,而TIMP-1蛋白表达与之相反,在高分化鳞癌的表达明显高于低分化,比较有统计学差异(P<0.05)。见表2。

表2 SCC不同分化程度中MMP-12与TIMP-1表达情况
注:与对应分类比较,*P<0.05
3 讨论
皮肤癌是迄今造成最普遍危害的癌症之一,根据其发生的细胞和临床表现来命名,最常见的三种类型是基底细胞癌、鳞状细胞癌及恶性黑色素瘤。基底细胞癌、鳞状细胞癌都来自表皮的角质形成细胞,每年全球非黑色素瘤皮肤癌(NMSC)发生两百多万例,据估算,在未来30年发生率可能增加一倍。BCC的发生率占NMSC发生率的80%~85%,生长缓慢,极少转移到其他器官[9]。SCC发生占NMSC的15%~20%,侵袭性强,如未得到及时治疗则会侵犯周围正常的皮肤、皮下组织及肌肉,引起较为严重的损害[10],NMSC即使未发生转移也会造成明显的毁损,造成生理、心理及经济负担,降低人们的生活质量[11]。这二种肿瘤均为老年人多发,BCC女性患者较多,SCC男性患者略多[12],最常见于头面部等曝光部位,目前,NMSC治疗首选手术切除,但是易复发,SCC和BCC发生浸润转移及复发的一个主要原因是基底膜完整性被破坏。
MMPs主要由单核巨噬细胞、中性粒细胞等细胞合成分泌,可降解细胞外基质的多种成分和基底膜。研究表明,在肿瘤细胞的恶性表型和侵袭转移表型中MMPs为高表达状态[13]。在乳腺癌、结肠癌、前列腺癌和口腔癌等也发现MMP-2及MMP-9表达上调[14]。在肿瘤转移过程中,MMPs可以通过破坏局部组织的正常生理结构,促进肿瘤生长和发展,促进肿瘤细胞各类生长因子的分泌,加快肿瘤细胞的增殖。此外MMPs还可协助肿瘤细胞发生免疫逃逸[15]及促进肿瘤的新生血管迅速形成[16]。MMP-12是MMPs家族中的一员,又称巨噬细胞金属弹性酶(HME),一方面它在分解纤溶酶原和V型胶原等细胞外基质的过程中,可促进产生抑制血管生成的血管抑素和内抑素,从而抑制肿瘤的生长和侵袭[2];另一方面,在分解胶原和纤维蛋白等细胞外基质过程中,能诱导MMP-2及MMP-9的表达,促进血管生成及促进肿瘤侵袭和转移[3],所以MMP-12在肿瘤进展上的作用是双向的。在皮肤癌中,相对正常皮肤,MMP-12在恶性黑色素瘤中表达增加,与其侵袭性相关[17]。在SCC和BCC的研究中发现,MMP-12表达在肿瘤细胞和巨噬细胞上,SCC中MMP-12的表达明显高于BCC,提示MMP-12的表达水平在两者中存在差异,与其侵袭性有关。本实验中MMP-12表达的免疫组化结果与前人实验[18]类似,BCC中的MMP-12阳性表达45.2%,SCC患者中阳性表达80%,在SCC及BCC具有明显差异;而且MMP-12蛋白表达水平随着肿瘤分级的增高而增高,即在低分化鳞癌的表达明显高于高分化组,表明了MMP-12与肿瘤的转移能力关联密切。
TIMPs由成纤维细胞、角质形成细胞以及成骨细胞等分泌产生。TIMPs对MMPs活性的抑制作用是控制MMPs活性的重要机理,TIMPs主要通过控制肿瘤的生长与增殖、侵袭与转移、血管生成及细胞凋亡来发挥抑制肿瘤功效。在增殖的抑制及对凋亡的促进方面,报道有所矛盾[14]。多项研究表明在皮肤癌、肺癌、大肠癌等恶性肿瘤中,TIMP-1阳性表达率明显增高,其过度表达则预后不良的报道较多[19]。而在头颈部鳞状细胞癌中经半定量RT-PCR法检测,发现在肿瘤组织中TIMP-1表达下降[6,20]。本实验中TIMP-1阳性表达在BCC患者中有67.7%,在SCC患者中有60%,以上结果表明在SCC中TIMP-1的表达较BCC少,而且在高分化鳞癌的表达明显高于低分化组,比较有统计学差异,表明随着侵袭度的增加,TIMP-1表达逐渐减少。
综上所述,本文就MMP-12、TIMP-1 在NMSC中表达做了初步的研究。其中MMP-12及其抑制剂与SCC的组织分化程度和浸润转移密切相关,可以作为皮肤SCC早期转移和侵袭性的一个指标,而在BCC中其机理还有待探索,可能与其他MMPs的表达具有关联性。

