血清AGR2在垂体腺瘤诊断及鉴别诊断中的意义
麦麦提依明·托合提 文国道 唐超 李俊漾 胡跃兵 马驰原*
(新疆维吾尔自治区人民医院神经外科,新疆 乌鲁木齐 830001; 2南京大学医学院附属金陵医院,中国人民解放军南京总医院神经外科,江苏 南京 210002)
人类前梯度蛋白2(anterior gradient 2, AGR2)是源于非洲爪蟾蛋白XAG2(Xenopus anterior gradient 2)的人型同系物,它在爪蟾胚胎的生理发育生长过程中发挥了重要的作用[1]。本部分实验中,我们用鞍区占位性病变患者、正常人及前列腺癌患者血清检测AGR2蛋白含量,评价AGR2在垂体腺瘤(pituitary adenoma, PA)诊断、鉴别诊断中的价值。
材料与方法
一、病例的收集与分类
按本研究纳入标准选择2013年12月至2014年12月在我院神经外科手术治疗的垂体腺瘤患者以及非垂体腺瘤鞍区病变患者。随机选择前列腺癌患者7例作为阳性对照组。所有病例均经病理确诊。随机选择20例正常人(男女分别为10例,年龄段在20~ 50岁者)作为阴性对照组。
相关病例入选标准:①诊断明确者;②发病后随访时间超过两年者;③垂体腺瘤影像学能明确侵袭性或非侵袭性者;④垂体腺瘤为单一分泌类型者;⑤年龄段在20~50岁者;⑥无其他疾病者。排除标准:①垂体腺瘤卒中或者囊变者;②发病后随访时间低于两年者;③影像学能明确侵袭性或非侵袭性者;④诊断为混合型垂体腺瘤者;⑤年龄在20岁以下或50岁以上者;⑥存在其他疾病者。
按照纳入标准选择的垂体腺瘤患者共163例,非垂体腺瘤鞍区病变患者共43例。其中无功能(non-functioning, NF)腺瘤110例,生长激素(growth hormone, GH)腺瘤29例,泌乳素腺瘤(prolactin, PRL)腺瘤17例,促肾上腺皮质激素(adenocorticotropic hormone, ACTH)腺瘤7例。根据垂体腺瘤Hardy分类法和Knosp分类法将垂体腺瘤分为侵袭性垂体腺瘤和非侵袭性垂体腺瘤[2],其中侵袭性垂体腺瘤75例,非侵袭性垂体腺瘤88例。
二、实验方法
收集相关患者与正常人的血液,在室温下放置2 h,然后1 500 g离心20 min,取上清后转移至武汉Uscn生命科学技术有限公司生产的AGR2检测试剂盒采用酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)测定血清中AGR2含量。
三、统计学分析
本实验所有实验数据均采用均数±标准差表示,组间比较采用Mann-WhitneyU检验。用受试者工作特征曲线(receiver operating characteristic curve, ROC)来确定最佳转折点以及血清AGR2对垂体腺瘤和其他非垂体腺瘤病变鉴别诊断的敏感性和特异性。P<0.05为差异具有统计学意义。
结 果
一、垂体腺瘤患者血清AGR2的水平
在本实验中,根据标准品浓度和OD值所绘制的标准曲线如图1所示。其中相关系数r=0.99999468,S=0.17271624。
根据标准曲线得到的拟合方程式及相关系数,计算出的血清AGR2水平如图2所示。结果提示,垂体腺瘤患者血清AGR2水平明显高于正常人血清AGR2水平,分别为(250.10±79.14) ng/mL和(163.67±50.38) ng/mL,P<0.001以及非垂体腺瘤鞍区病变患者血清AGR2水平,分别为(250.10±79.14) ng/mL和(220.84 ±79.62) ng/mL,P=0.017。此外,非垂体腺瘤鞍区病变患者血清AGR2水平也明显高于正常人血清AGR2水平,分别为(220.84±79.62) ng/mL和(163.67±50.38) ng/mL,P=0.002。这表明,检测血清AGR2水平不仅能把鞍区病变患者中的垂体腺瘤患者区分出来,而且能区分垂体腺瘤、非垂体腺瘤鞍区病变患者与正常人。
随后,我们比较了垂体腺瘤不同分泌类型中血清AGR2水平,血清AGR2水平在GH腺瘤中最高(291.38±97.37)ng/mL,其含量高到低依次为GH腺瘤,NF腺瘤,ACTH腺瘤及PRL腺瘤,分别为(291.38±97.37) ng/mL,(245.63±74.79) ng/mL,(232.58±76.03) ng/mL,(215.81±44.12) ng/mL。不同分泌类型垂体腺瘤患者血清AGR2水平无明显统计学差异(P>0.05)。
二、ROC曲线分析
根据垂体腺瘤患者和正常人血清AGR2水平绘制出的ROC曲线如图3 所示。其曲线下面积(area under curve, AUC)为0.835。血清AGR2水平的截断点(cut-off point)为158.63 ng/mL,其正确系数(Youden Index)为0.564。敏感性为91.4%(149/163),特异性为65%(13/20)。这些数据表明用ELISA法检测血清AGR2水平具有较高的敏感性。
三、垂体腺瘤患者血清AGR2水平与其临床特征的关系
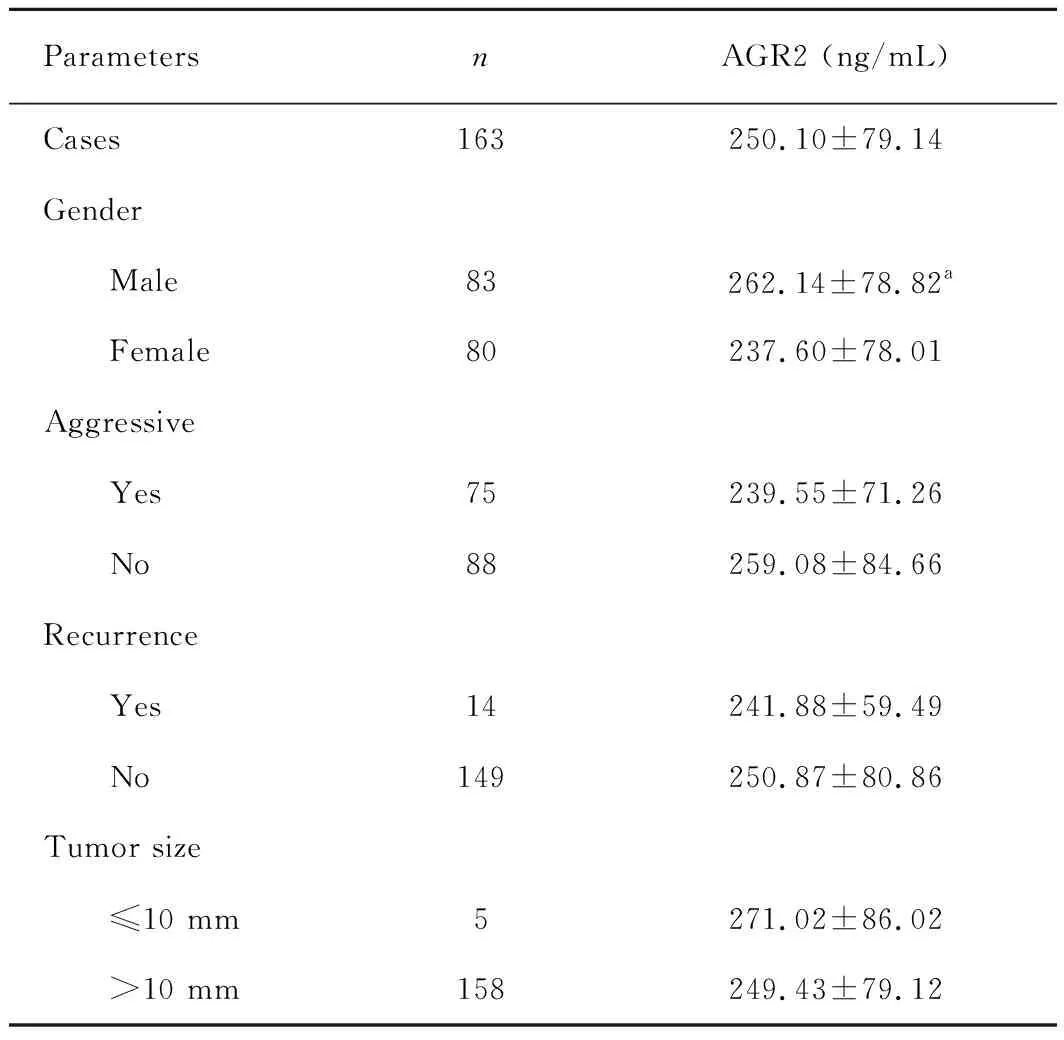
在163例垂体腺瘤患者中,男女患者分别为83例和80例。其中75例为侵袭性,其余88例为非侵袭性垂体腺瘤。163例垂体腺瘤患者中,14例为术后复发垂体腺瘤,其余149例为原发性垂体腺瘤。共5例为垂体微腺瘤(直径10 mm),其余均为垂体大腺瘤(直径>10 mm)。垂体腺瘤患者临床因素与血清AGR2水平的关系如表1 所示。结果提示:在垂体腺瘤患者中,男性患者与女性患者血清中AGR2水平有统计学差异(P<0.05),男性患者血清AGR2水平高于女性患者。然而,在正常人中,男性血清中AGR2的水平与女性无明显差异。血清AGR2水平与其它临床特征如肿瘤侵袭性、肿瘤复发、肿瘤大小等无明显的相关(P值分别为0.112、0.608、0.608)。这表明,不同临床特征的垂体腺瘤患者血清AGR2的水平是比较稳定的。
163例垂体腺瘤中,垂体微腺瘤(直径10 mm)仅5例。为探究肿瘤大小与血清AGR2水平有无相关性,我们将163例垂体大腺瘤按肿瘤最大直径分为5组,分别是肿瘤最大直径为≤10 mm、10~19 mm、20~29 mm、30~39 mm以及≥40 mm。其血清AGR2水平依次为271.02±86.02、255.81±91.79、250.55±82.13、249.80±55.36、219.20±45.55,肿瘤体积越大,其血清中AGR2的水平越低。然而,各组血清AGR2的水平无显著统计学差异(P>0.05)。
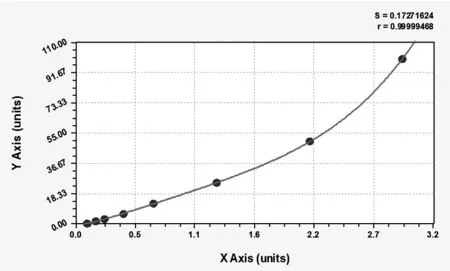
图1 血清AGR2的ELISA检测标准曲线
Fig 1 The standard curve according to the concentration of standard reagent
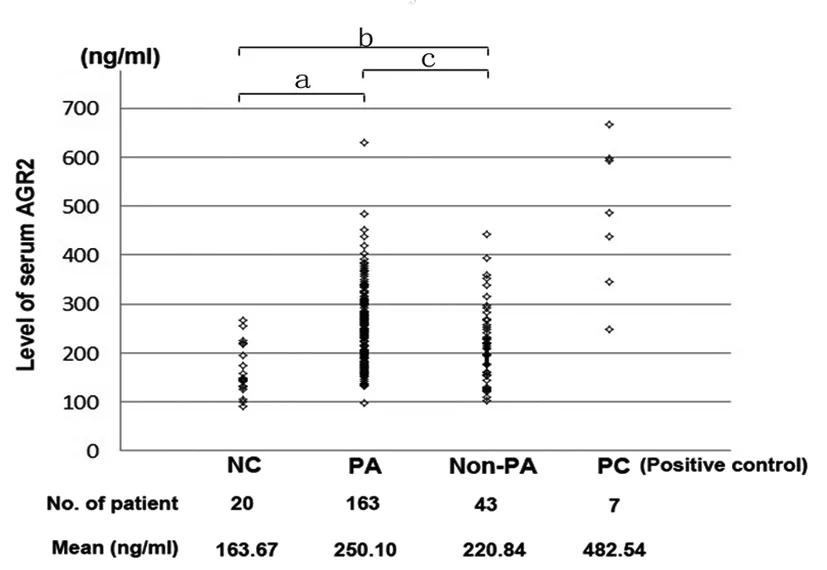
图2 正常人、垂体腺瘤患者、非垂体腺瘤鞍区病变患者及前列腺癌患者血清AGR2水平散布图
Fig 2 Scatter plot of serum AGR2 levels in normal controls, pituitary adenoma patients, non-PA patients with other occupying lesions in saddle area and prostate cancer patients detected by ELISA
NC: Normal control; PA: Pituitary adenomas; Non-PA: Non-PA patients with other occupying lesions in saddle area; PC: Prostate cancer.
aP<0.01,bP<0.01,cP=0.017<0.05.
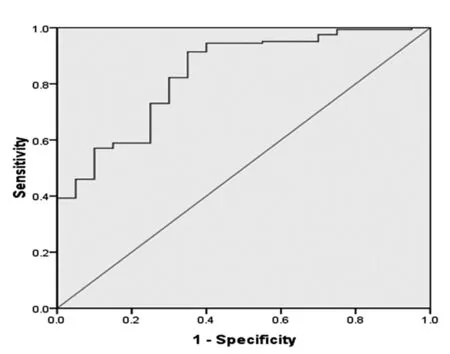
图3 垂体腺瘤患者和正常人血清中AGR2水平的ROC曲线
Fig 3 The ROC curve for serum AGR2 in pituitary adenoma patients and normal controls
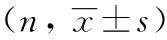
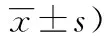
ParametersnAGR2 (ng/mL) Cases163250.10±79.14 Gender Male83262.14±78.82a Female80237.60±78.01 Aggressive Yes75239.55±71.26 No88259.08±84.66 Recurrence Yes14241.88±59.49 No149250.87±80.86 Tumor size ≤10 mm5271.02±86.02 >10 mm158249.43±79.12
aP=0.047<0.05,vsfemale patients.
讨 论
垂体腺瘤是常见的颅脑肿瘤之一,约占全部颅脑肿瘤的10%,在人群尸检中发现率可高达20%~30%[3]。垂体腺瘤过度分泌某些垂体激素,引起一序列的代谢紊乱和脏器损害;肿瘤压迫正常垂体,导致正常垂体激素分泌减少,引起相应靶腺的功能低下;肿瘤压迫视神经等周围结构,导致视力下降、视野缺损等相应功能的严重障碍。因为垂体腺瘤的好发年龄为20~35岁,对肿瘤患者的生活、劳动能力及生育功能均有严重的损害,造成一序列社会心理影响[4]。
垂体腺瘤以其肿瘤生物学特性可分为非侵袭性垂体腺瘤、侵袭性垂体腺瘤以及垂体腺癌。其中,非侵袭性微腺瘤由于肿瘤体积小、缺乏特异性临床表现,早期难以发现。侵袭性垂体腺瘤可以侵犯周围的硬膜、骨质,侵入海绵窦、蝶窦等结构。侵袭性垂体腺瘤具有高增殖活性、高侵袭能力、术后易复发、临床治愈率低等特点[5]。即使侵袭性垂体腺瘤做到镜下全切,其复发率仍高达20%[6]。因此,垂体腺瘤的早发现、早诊断、早治疗至关重要。
AGR2是源于非洲爪蟾蛋白XAG2(Xenopus anterior gradient 2)的人型同系物,它在爪蟾胚胎的生理发育生长过程中发挥了重要的作用[7]。AGR2 主要和激素依赖性肿瘤相关,例如乳腺癌、胰腺癌、肺癌、前列腺癌等。AGR2 在一些肿瘤中表现出了明显的致癌基因的相关特征,例如促进细胞增殖,促进肿瘤耐药等。然而,在纤维肉瘤中肿瘤的致瘤性却因AGR2 的过度表达而被抑制。所以AGR2 在不同的肿瘤中的表达有很大的差异,其在不同肿瘤发生发展的过程中的作用也有很大的差异。因此,进一步深入研究AGR2 在垂体腺瘤中的功能及机制很有必要。
血清AGR2作为恶性肿瘤生物学标志物已有大量研究。Edgell等报道在卵巢癌患者血清中AGR2水平明显提高[8]。Chen等发现在胰腺癌和癌前病变患者胰液中AGR2水平比正常对照组显著提高[9]。血清AGR2还可以作为评价恶性肿瘤转移和复发活性的重要指标[10]。文献报道AGR2 mRNA在前列腺、乳腺及结直肠恶性肿瘤患者外周血循环肿瘤细胞中表达升高[11]。Chung等通过检测血清中AGR2蛋白水平发现,血清中AGR2水平升高与肿瘤术后复发和转移密切相关[12]。本研究首次发现血清AGR2可作为鉴别垂体腺瘤与正常人以及垂体腺瘤与非垂体腺瘤鞍区病变的临床生物学指标。关于AGR2如何分泌及其如何在肿瘤中起作用的机制需要更多的分子生物学实验来探索和验证。
本实验用ELISA法检测了垂体腺瘤患者、非垂体腺瘤鞍区病变患者以及正常对照组血清AGR2水平,发现血清AGR2可以作为垂体腺瘤与非垂体腺瘤鞍区病变患者鉴别诊断的重要生物学标志物。ROC曲线表明用ELISA法检测血清AGR2水平具有较高的敏感性。血清AGR2水平与肿瘤侵袭性、术后复发、肿瘤大小等临床因素无明显的相关。AGR2在垂体腺瘤诊断及鉴别诊断中的价值需要更大规模的临床研究来进一步验证。

