一株耐铅土著微生物的吸附特性及机制研究
张 敏,郜春花,李建华,卢晋晶,靳东升,郜雅静
(1.山西大学生物工程学院,山西 太原 030006;2.山西省农业科学院农业环境与资源研究所,山西 太原 030031)
土壤作为生态系统的重要组成部分,是农业可持续发展的基础,它养育着地球上一代又一代的人类,但目前面临着各种威胁,其中,土壤污染最严重,土壤污染破坏生态系统稳定,影响人类健康,是危害全球环境质量的重要问题之一,是人类目前必须重视并解决的问题。山西省作为我国重要的工业基地,因采矿和工业制造导致的土壤重金属污染问题十分严重,其中铅污染尤为突出[1-3]。铅作为一种有毒重金属,土壤中过量的铅积累会改变土壤性质,导致土壤养分元素供应减少、肥力降低、土壤微生物的多样性减少[4-6],还可进入作物体内,阻碍作物生长发育,降低作物的品质,并通过食物链进入人体,对人体健康产生潜在危害[7-8]。
目前,土壤重金属污染的修复研究是国内外研究的热点[9-13],与以往重金属污染治理的物理、化学修复相比较,生物修复费用低、效果好,不会或很少造成二次污染[14],其中,微生物修复已成为当今环境科学研究领域的热点,而微生物-植物联合修复更是具有挑战性的研究方向之一[15]。微生物修复或微生物-植物联合修复的首要任务就是获得新的具有极高耐受性和吸附效果的微生物菌株。细菌作为微生物中的最大群体,在微生物修复领域占主要地位,目前研究主要集中在细菌对重金属的吸附性、耐受性以及作用机制等方面[16]。但是,由于微生物的地域性与多样性,同一地域、不同种类微生物或不同地域、同一种类微生物的生长条件、内部细胞结构差异较大,与重金属相互作用过程相当复杂,作用机理的研究还不够清晰,未形成统一的理论与标准[17-18]。因此,微生物吸附特性与机制的研究具有极大的科研价值。
本试验以前期筛选出的耐铅菌株GDYX03(Enterobacter ludwigii)为研究对象,寻求其最佳吸附条件,构建吸附动力学与吸附等温模型对其吸附行为进行分析,利用透射电镜与红外光谱仪对菌株吸附的内在机制进行初步研究,探讨菌株对重金属铅的吸附机制,为后期重金属铅污染生物修复的实际应用提供理论依据。
1 材料和方法
1.1 菌种来源
菌株GDYX03筛选于太原市小店区疙瘩营(污水处理厂)土壤,经鉴定为肠杆菌属(Enterobacter ludwigii)。
1.2 吸附特性与机制研究
1.2.1 不同条件对菌株吸附Pb2+能力的影响
1.2.1.1 菌体的制备 将耐铅菌株GDYX03在土豆葡萄糖液体培养基的优化生长条件下培养至最佳吸附状态,4 000 r/min离心20 min,用去离子水清洗菌体,继续离心,反复3次,收集菌体活细胞。
1.2.1.2 吸附试验 将收集到的菌体活细胞制成定量菌悬液,取适量于20 mL含Pb2+水溶液的小三角瓶(50 mL)中,在设置的各参数下吸附后,17 000 r/min离心5 min,取上清液测定Pb2+的浓度,每个试验做3个重复,每组均以不加菌体组为对照。
1.2.1.3 Pb2+浓度的测定 采用原子分光光度计测定Pb2+的浓度,计算公式如下。

1.2.1.4 活细胞吸附方式的选择 按10%的接菌量将培养24 h的种子液接种于含Pb2+质量浓度为100 mg/L的液体培养基中,30℃,180 r/min培养于恒温摇床中,以不接菌、含Pb2+质量浓度为100 mg/L的液体培养基为空白对照,测量生长菌株过程吸附的吸附效果,并与无营养物质提供的菌体活细胞吸附效果进行比较。
1.2.1.5 不同条件下耐铅菌株对Pb2+吸附能力的研究 以菌龄(菌株培养时间)、溶液pH值、接菌量、吸附温度、吸附时间和初始铅质量浓度为单因素,检测菌体在各种条件下对Pb2+的吸附效果。首先菌龄设定为 16,24,48,72,96 h,铅质量浓度为100 mg/L,溶液初始pH值,接菌量5 g/L(干菌量),置于30℃摇床吸附2 h,离心收集上清液,采用火焰原子分光光度计测定,确定最佳菌龄,然后依次确定 pH 值(2,3,4,5,6,7.5)、接菌量(0.5,2.5,5,7.5,10 g/L)、温度(20,25,30,35,40 ℃)和时间(5,10,30,60,90,120 min)的最佳值,最后研究初始铅质量浓度(50,100,200,300,400,500 mg/L)的最佳值,以不接菌为对照。
1.2.2 吸附动力学 将含Pb2+溶液(500 mg/L)与一定量的菌悬液混合(接菌量为5g/L),30℃,180 r/min振荡吸附,以不加菌体为对照,每隔一段时间取部分离心分离,测定上清液中Pb2+含量,直至其达到吸附平衡状态。吸附动力学模型如表1所示,其中,qt表示时间t时菌体的吸附量,qe表示吸附平衡时菌体的吸附量,k1,k2,A,B为动力学模型参数[19]。

表1 吸附动力学方程模型
1.2.3 等温吸附模型 配制不同Pb2+质量浓度的溶液(100,200,300,400,500 mg/L),加入一定量的菌悬液(接菌量为5 g/L),30℃,180 r/min振荡吸附到平衡,以不接菌的含铅溶液为对照,取上清液测定吸附平衡时的Pb2+质量浓度,并将试验数据进行模型拟合。
1.2.4 透射电镜与红外光谱分析 收集吸附Pb2+前后的菌样,样品经固定、脱水、包埋、切片、染色等步骤,制备超薄菌株切片,置透射电镜下观察;将吸附Pb2+前后的菌体真空干燥,采用红外光谱仪测定并记录其光谱。
1.3 数据统计
采用Excel 2007对数据、图表进行处理;采用SPSS 19.0对数据进行方差分析、回归分析等,并采用Origin 8进行红外光谱的绘制。
2 结果与分析
2.1 活细胞吸附方式的选择
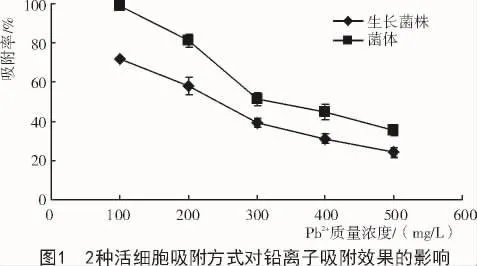
生物吸附包括活细胞和死细胞的吸附。本试验的研究目的是筛选耐铅菌株并用于土壤重金属污染的生物修复,因此,本试验适合以活细胞吸附为研究对象。活细胞吸附又分为有营养物质提供的生长菌株过程吸附和无营养物质提供的活细胞吸附。由图1可知,随着铅离子质量浓度的提高,2种活细胞吸附效果均呈现下降的趋势,生长菌株过程吸附均比无营养物质提供的活细胞吸附效果差,且生长菌株过程吸附作用时间较长。
研究菌株GDYX03的活细胞吸附方式发现,无营养物质提供的活细胞吸附比生长菌株过程吸附效果好,原因是生长菌株过程吸附中因其细胞受重金属离子的毒害作用而影响其生长发育,其次后期营养物质的不足、生长环境的变化等多种不可控因素也会限制细胞的生长,从而影响其胞外吸附。而无营养物质提供的活细胞吸附虽然胞内积累会因没有营养物质提供而受到影响,但大量前期培养好的菌体依旧可以通过表面吸附来去除重金属离子,且其吸附效果较好,表明该菌株吸附作用以胞外吸附,即表面吸附为主,可能发生了表面络合,或离子交换、静电吸附,或表面微沉淀,或者多种机制共同作用[20-21],其还有待进一步证实。
2.2 不同条件下耐铅菌株对Pb2+的吸附能力
2.2.1 菌龄 由图2-a可知,取斜面上一接菌环菌种于100 mL液体培养基中培养72 h离心所得菌体吸附效果最佳,吸附率为95.414%,吸附量为18.783 mg/g,随着菌龄的升高或是降低,其吸附率与吸附量均减小,原因是菌体细胞壁膜的某些成分与含量随菌株的生长而变化。陈志英等[22]研究了菌龄对菌株吸附铜离子能力的影响,结果表明,不同生长期的菌株对Cu2+吸附能力有显著差异,其主要原因是细胞壁膜中磷脂和脂多糖的含量随菌龄而变化,导致菌株吸附Cu2+的能力也随菌龄而变化。因此,在其他相应条件下,菌株GDYX03培养72 h时,其细胞壁膜对Pb2+的吸附作用处于最佳状态。
2.2.2 pH值 由图2-b可知,pH值对菌株吸附Pb2+的影响较大,随着pH值的增加,菌株吸附率由16.595%上升至98.366%;当pH值为6时,吸附率最高;当pH值高于7时,吸附效果开始降低。KIRAN等[23]和KAPOOR等[24]研究表明,溶液pH可通过影响菌株表面吸附位点的活性及重金属离子的形态来影响生物吸附作用。pH较低时,大量的H+和H3O+与金属离子竞争菌体表面的吸附位点,随着pH值的升高,H+与细胞壁上的官能团分离,细胞表面更多带有负电荷的官能团开始暴露,吸附位点增多,吸附效果增强,但当pH大于离子的微沉淀点时,溶液中铅离子会形成Pb(OH)2沉淀,阻碍细胞表面部分载体的协助运输,从而影响吸附效果,其结论正如ADNAN等[25]的研究。菌株吸附作用后,溶液pH值由原来的弱酸性变成弱碱性,说明菌株吸附过程会产生碱性分泌物,与铅离子形成表面沉淀,该作用可能是菌株吸附的一个重要途径。
2.2.3 接菌量 由图2-c可知,随着接菌量的增加,菌株对Pb2+的吸附率也随之增加,但吸附量逐级减小,当接菌量达到5 g/L时,其吸附率达到最高,为98.318%,吸附量为19.73 mg/g,原因是随着接菌量的增加,菌体表面的活性位点增加,从而与Pb2+充分接触,达到较好的吸附效果,但当接菌量过量后,菌体易发生聚集现象,活性位点之间发生静电排斥,不利于菌株对铅离子的吸附,根据ACHARY等[26]和SELATNIA等[27]的研究,生物吸附量在很大程度上确实会受到吸附剂剂量的制约。BHAINSA等[28]的研究结果也表明,接菌量对菌株的吸附效果影响显著,其作用机理与本研究看法相一致。但ZUMRIYE[29]则研究认为,由于菌体表面对Pb2+的结合位点强弱不同,菌体过多导致它们之间发生竞争吸附,使得结合位点不能够充分利用而降低了吸附效果。综合考虑吸附效果与菌株的利用率,最佳接菌量选择5 g/L,这样既可以有效去除重金属离子,还可以降低操作成本。
2.2.4 温度 由图2-d可知,温度对吸附作用有少量的影响,当温度小于30℃时,吸附率与吸附量随着温度的升高而增大,其原因可能是菌株在吸附重金属的过程中,温度的升高为其在主动吸附过程中提供了所需能量,因而,提高了其吸附效果;而当温度超过30℃时,吸附效果开始降低,因为高温会影响菌体的正常代谢,且易破坏活性位点。FAN等[30]研究发现,某菌株吸附Pb2+时,温度的变化会影响菌体对重金属的亲和力和其表面的吸附位点;黄飞等[20]研究也表明,温度不仅可以影响重金属离子与细胞表面官能团络合物的稳定性,而且还可以通过改变细胞表面官能团的电离程度来影响吸附剂与重金属离子之间的亲和力,其作用效果与本研究相一致。因此,最终选择菌株的最佳吸附温度为30℃。
2.2.5 时间 从图2-e可以看出,在初始质量浓度为100mg/L的溶液中,菌株吸附作用5 min时,吸附率达到88.288%,在30 min时,吸附率达到98.752%,因此,菌株吸附作用是一个非常快速的过程。VOLESKY[31]的研究也表明,吸附的初级阶段是非常迅速的且不消耗能量。该菌株在吸附时间超过30 min时,吸附效果有少量的提升,说明该吸附作用还存在一种吸附方式,当吸附作用超过一定时间时,吸附效果开始有所下降,说明该作用过程中存在脱吸附现象。许旭萍等[32]研究发现,由于该吸附过程快速,且存在脱吸附现象,推测该菌株吸附机理可能主要是菌体表面吸附,但随着时间的增加,还有少量铅被菌体吸附,说明该吸附过程还存在少量的胞内积累。综合考虑,最终选择30 min为最佳吸附时间。

2.2.6 初始质量浓度 从图2-f可以看出,在溶液中含Pb2+质量浓度为100 mg/L时,菌株GDYX03吸附效果最佳,吸附率和吸附量分别为98.852%和17.793 mg/g,分析是由于在低质量浓度Pb2+条件下,溶液中Pb2+与菌体表面吸附位点接触率高,吸附效果好,当Pb2+质量浓度大到一定程度时,离子间的斥力增强,吸附位点处于饱和状态,且有部分菌体裂解或自溶,导致吸附效果不佳。徐雪芹等[33]在研究菌株吸附废水中Pb2+和Cu2+的机理中也证实,溶液中Pb2+的初始浓度对菌株吸附效果影响较大,原因是不同的初始浓度影响菌体表面吸附位点的活性,从而影响其吸附效果。综合考虑,最佳初始质量浓度选择100 mg/L。
2.3 吸附动力学分析
动力学用来描述吸附剂与吸附质作用的速率快慢,常常采用Lagergren一级动力学模型和Pseudo二级动力学模型来模拟其试验数据,探讨生物吸附机理和吸附过程[20]。本研究对菌株活细胞进行了几种动力学方程的拟合,拟合结果列于表2。

表2 菌株吸附Pb2+动力学模型拟合
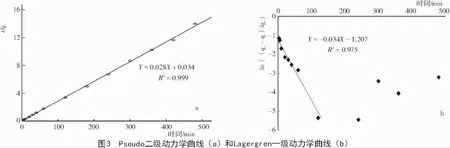
由表2可知,二级动力学方程拟合系数最高,R2为0.999,且通过对t/qt和t作图(图3-a),计算得到的 k2=0.023 1,qe=35.714,与实测平衡吸附量十分接近,说明二级动力学模型能够较好地描述菌株的整个吸附过程[20],与黄志钧等[34]在研究抗铜离子菌株时的结论所一致。二级动力学方程揭示出菌株吸附过程包含多个步骤的反应,其可能是物理吸附,也可能是化学吸附,还可能是生物代谢型吸附[19],因此,该菌株的吸附作用可能是多重重金属吸附机理的复合效应,具体作用机理还有待进一步分析。
通过对ln((qe-qt)/qe)和时间t作图(图3-b)发现,120 min内,该菌株吸附过程较符合Lagergren一级动力学方程,R2为0.975,当吸附时间超过120 min后,方程的回归系数逐渐降低。一级动力学方程是基于反应物浓度与反应速度之间调控关系的方程,即溶液中重金属的浓度对吸附速度会有一定的影响[19],一级动力学方程只能较好地模拟该菌株吸附反应的初始阶段,说明溶液中重金属的浓度对菌株吸附初期的反应速度起决定性影响,但吸附后期反应物浓度不是控制吸附作用的决定性因素,因此,该菌株对铅的吸附过程不是单一的作用机理,与二级动力学模型分析得出的结论一致。
其次,菌株吸附数据与颗粒内扩散方程和Elovich方程拟合系数R2分别为0.611和0.859,其拟合相关性不如二级动力学方程,说明Pb2+在颗粒内部的扩散对反应速度的影响不大,但吸附过程部分受扩散因子的调控,结果表明,菌株活细胞吸附机理存在多重复合作用。动力学研究表明[35],当吸附反应速率很快时,总吸附速率由膜扩散、内扩散或二者共同控制,菌株GDYX03活细胞颗粒内扩散不明显,因此,吸附速率以膜扩散作用为主,推测在整个吸附过程中,表面吸附起到了主导作用,但还有少量的胞内积累。综合分析,二级动力学方程能较好地描述菌株活细胞吸附Pb2+的整个过程,可为生物吸附反应器的设计提供理论依据。
2.4 等温吸附方程
等温吸附模型用来描述吸附剂与吸附液中重金属离子之间的平衡关系,Langmuir等温吸附模型较常用,Freundlich等温吸附模型为经验公式,二者均需在相应的理想条件下进行模型拟合[36-37]。

式中,qm为最大吸附量,qe为单分子层吸附达到平衡时的吸附量,Ce为平衡吸附的重金属浓度,k1为与吸附自由能相关的Langmuir吸附平衡常数。
RL为平衡参数,可用于反映吸附剂和吸附物之间的关系,RL在0~1间表示吸附剂吸附,RL=0吸附反应不可逆,RL=1为线性,RL>1不利于吸附反应进行[38]。其方程如下。

其中,C0为溶液的不同初始浓度。

其中,k2为与吸附能力有关的Freundlich吸附平衡常数,1/n为与吸附强度相关的经验常数,受材料不均匀度影响。n值的大小可说明吸附作用的线性程度,当n=1时,吸附为线性,当n<1时,为化学吸附,当n>1时,为物理吸附[39]。
将菌体对Pb2+吸附的数据按吸附等温方程进行拟合、回归分析,相关参数如表3,4所示,其拟合效果较好,运用SPSS软件得到Langmuir拟合方程和Freundlich拟合方程。

表3 等温吸附方程回归Langmuir拟合计算得到的相关参数

表4 等温吸附方程回归Freundlich拟合计算得到的相关参数
结果显示,菌株对Pb2+吸附的Langmuir等温吸附模型R2为0.996,Freundlich等温吸附模型R2为0.831,表明该菌株的吸附过程更适合用Langmuir等温吸附模型来描述。在最佳吸附条件下,随着Pb2+初始质量浓度的增加,平衡参数RL减少,且RL在0~1之间,表明菌株活细胞对Pb2+的吸附是有利的,该吸附剂可以较好地用于Pb2+的吸附。
2.5 透射电镜分析
通过透射电镜对菌体活细胞内部形态进行观察,由图4-a可知,菌株GDYX03呈短杆状,俩端钝圆,在没有和铅离子接触时,菌体周围呈电子透明层;在铅离子初始质量浓度为100 mg/L条件下(图4-b),细胞表面和内部都不规则地堆积着大量具有衍射现象的电子不透明小颗粒,表明菌株GDYX03吸附铅离子过程不但有快速的表面吸附,还发生了缓慢的胞内积累,但胞内积累作用不大,分析其原因:一是在吸附过程中,由于没有营养物质的提供,菌体无法进行正常的生理代谢,从而影响细胞的主动运输,铅离子无法进入细胞内部;二是在铅离子质量浓度为100 mg/L条件下,菌体通过减少胞内积累量来保护自身,避免毒害作用;而当菌体在Pb2+质量浓度1 000 mg/L条件下(图4-c),细胞表面的颗粒量比铅离子质量浓度为100 mg/L时的数量少,但细胞内部颗粒数量增多,说明当Pb2+质量浓度大到一定程度时,离子间的斥力增强,吸附位点处于饱和状态,细胞表面还可能发生脱吸附现象,因此,表面吸附作用降低,而细胞内外浓度差增大,促进胞内积累,但整体吸附作用效果下降。因此,可初步认为,在无营养物质提供的条件下,菌株GDYX03适用于低浓度Pb2+污染的修复,其吸附作用以菌体细胞表面吸附为主要作用机制,或将Pb2+还原为Pb原子,又或与胞外某些阴离子发生络合反应形成沉淀聚集在细胞表面,而胞内积累作用不大,金羽等[40]在研究耐铅细菌的吸附特性中也证实了该结果。

2.6 红外光谱分析
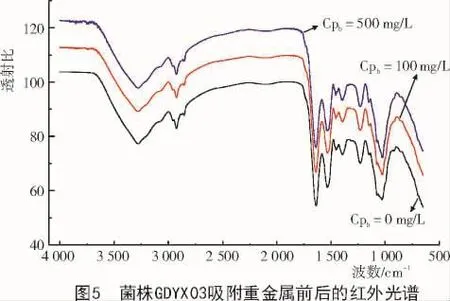
按照文献[40]对比分析吸附重金属前后菌体的红外光谱(图5),结果表明,IR谱图出现明显差异,集中表现在微生物分析灵敏区500~1 800,2 800~3 500 cm-1[41],吸附重金属后部分基团的吸收峰都发生变化,菌株在低质量浓度Pb2+100 mg/L的溶液中作用时,与不含Pb2+相比,其IR谱图基本类似,部分峰位发生微移,胺基-NH2的最大吸收位置从3 276.52 cm-1迁移到 3 283.26 cm-1,烷基 CH2反对称伸缩吸收峰从2994.48cm-1迁移到3000.26cm-1,糖类CH3,CH2,CH伸缩对称最大吸收位置从2916.37cm-1迁移到2923.60cm-1;菌株在高质量浓度Pb2+500mg/L条件时,更多基团的峰位发生偏移,烷基CH2反对称伸缩吸收峰从2994.48cm-1迁移到3006cm-1,糖类CH3,CH2,CH伸缩对称最大吸收位置从2916.37cm-1迁移到2 930.35 cm-1,羰基C=O伸缩振动吸收峰从1 635.37 cm-1迁移到1 641.63 cm-1,带N-H弯曲振动与C-N伸缩振动的叠加位置从1 578.96 cm-1迁移到1 586.67 cm-1,醇类C-OH伸缩振动的最大吸收峰从1 027.41 cm-1迁移到1 025.48 cm-1,膦酸OP-O对称伸缩位置从887.59cm-1迁移到894.34cm-1。结果表明,官能团 -NH2,CH2,C=O,C-OH,O-P-O是主要的吸附位点,-NH2在低浓度时,可提供孤对电子与Pb2+配位结合,正如PETHKAR等[42-44]的研究;酰胺I,II带谱峰也发生了偏移,说明蛋白质中的酰胺基也可能起作用,或是糖类、脂类物质,黄飞等[20]也证实了该结论。但是通过图5发现,吸附后IR谱图的吸收峰强度或峰形基本没有变化,而且没有新的谱带出现,表明菌株吸附过程中,细胞成分的活性基团与Pb2+发生络合作用,但不是主要的作用机制。
3 结论
本研究结果表明,高耐铅土著菌GDYX03的活细胞对铅离子的吸附过程中,无营养物质提供的菌体活细胞吸附比生长过程菌株的吸附效果好,且无营养物质提供的活细胞吸附以胞外吸附为主。
取5 g/L(干菌量)培养72 h的活细胞于pH值5~6、初始Pb2+质量浓度100 mg/L的溶液中,30℃振荡作用30 min,此时吸附效果最好,吸附率为98.852%,吸附量为19.73 mg/g。分析其原因可知,该菌株吸附效果主要受菌体表面活性位点的影响,吸附过程中发生了离子交换、表面微沉淀、静电吸附、表面络合等。
菌株GDYX03的整个吸附过程能很好地符合Pseudo二级动力学模型,表明其吸附作用是多种重金属吸附机理的复合效应,可能是物理吸附,也可能是化学吸附,还可能是生物代谢型吸附,结合其他动力学模型分析,该吸附过程以膜扩散为主,即主要是胞外吸附,还有少量的胞内积累。Langmuir等温吸附模型也能很好地描述菌株GDYX03对铅离子的吸附过程,平衡参数RL在0~1之间,表明菌株活细胞对Pb2+的吸附是有利的,可较好地用于对Pb2+的吸附。
通过透射电镜分析菌株GDYX03吸附重金属前后细胞内部的变化情况,结果表明,菌株对Pb2+的吸附主要是细胞表面的吸附,具有衍射现象的电子不透明小颗粒或是Pb2+还原为Pb原子,或是与胞外某阴离子络合反应形成沉淀。而红外光谱分析可得出,细胞成分中 -NH2,CH2,C=O,C-OH,O-P-O及酰胺基等是吸附作用中发生络合反应的主要活性基团,但该作用不是主要机制。
综上可知,菌株GDYX03活细胞吸附过程主要是靠细胞的胞外作用,以化学、物理吸附为主要作用机理,如静电吸附、离子交换、表面络合、表面微沉淀等多重复合吸附机理共同影响菌株的吸附效果,还有部分胞内积累作用,且证明菌株GDYX03可用于低质量浓度Pb2+污染土壤的生物修复。

