番茄果实成熟过程中SlSWEET7a的功能分析
程杰,张新圣,李安琪,姜晶
番茄果实成熟过程中的功能分析
程杰,张新圣,李安琪,姜晶
(沈阳农业大学园艺学院/设施园艺省部共建教育部重点实验室/辽宁省设施园艺重点实验室,沈阳 110866)
【目的】SWEETs(sugars will eventually be exported transporters)是一种糖转运蛋白,参与植物生物进程,对植物生长发育、响应各种胁迫、宿主-病原体的互作发挥作用。克隆番茄,通过构建沉默和过表达载体,研究其在糖的转运过程中的作用,为探索SWEETs在植物果实发育过程中的功能提供理论依据。【方法】以Micro-Tom()番茄为试材,利用RT-PCR技术从果实中克隆的cDNA全长842bp,进行生物信息学分析,并利用MEGA6.0构建拟南芥进化树,与SlSWEET7a进行蛋白序列同源性分析;利用实时荧光定量PCR技术探明其在果实发育时期的时空表达特征分析,并构建基因的沉默和过表达载体,通过农杆菌介导的果实注射法进行瞬时表达检测构建载体的表达效率;然后进行番茄的遗传转化,获得T1代转基因株系,利用实时荧光定量PCR技术检测绿熟期果实的表达,通过高效液相色谱法检测转基因果实和叶片中糖组成与含量的变化。【结果】SlSWEET7a蛋白结构是由7个跨膜结构域构成的。同源性比对分析结果显示,SlSWEET7a与拟南芥AtSWEET6和AtSWEET8序列同源性较高,都属于SWEETs家族的CladeⅡ。番茄果实各部位的表达分析显示,在绿熟期果柄、果实维管束相对表达量最高,转色期和红熟期相对表达量较低。构建沉默(S7a)及过表达载体(OE7a)在番茄果实的瞬时表达,发现OE7a样品果实中的表达量是未注射果实的6倍,其表达量明显上调,与对照相比,S7a样品果实中明显下调了5倍。在番茄中的遗传转化中卡那霉素抗性筛选获得10株可能的超表达T0代植株,PCR鉴定得到了超表达8株;沉默株系经除草剂筛选,获得14株,PCR检测得到10株沉默株系。T1代植株的实时定量分析显示,过表达植株发生转基因沉默现象,表达量显著低于正常植株,而沉默植株表达量也降低,说明获得的过表达植株也发生了基因沉默。果糖、葡萄糖和蔗糖含量测定结果表明,降低番茄中的表达,植株成熟叶片和绿熟期果实中果糖、葡萄糖和蔗糖含量均高于对照,尤其是叶片中蔗糖含量显著高于对照,这说明对细胞中蔗糖的易化扩散起着重要作用。【结论】SlSWEET7a对叶片中蔗糖向源组织韧皮部的装载及果实果柄、维管束的运输、卸载起重要调控作用。
番茄;SWEET7a;糖转运;载体构建;表达分析
0 引言
【研究意义】植物的碳水化合物在源器官(成熟叶片)中合成,主要以蔗糖的形式通过韧皮部进行长距离运输,然后将这些不同的化合物运输到库器官(幼嫩叶片、根尖、果实)来维持异养代谢和生长[1-2]。糖的代谢和分配在调节植物生长发育和植物响应生物和非生物因子中发挥着重要的作用[3]。番茄作为世界性范围种植的茄果类蔬菜,具有非常高的经济价值,其果实含糖量对风味和品质有着重要影响,并且直接影响了商品番茄及其番茄加工产物的经济价值和营养价值。在植物的生长发育过程中,来自SWEET家族的糖转运蛋白能调节糖的运输,影响果实糖的积累。因此,研究番茄对蔗糖的转运及其调控机理对于人们利用调控手段促进果实糖分积累、改善果实品质具有重要的理论意义。【前人研究进展】SWEETs是一类新发现的糖转运蛋白,具有7个跨膜结构域,广泛存在于原核生物、人类、植物以及动物中,拟南芥有17个SWEET家族成员,水稻有21个家族成员,番茄有29个家族成员[4-6]。系统进化树分析植物SWEET基因家族有4个分支,分别为CladeⅠ、CladeⅡ、CladeⅢ和CladeⅣ。其中CladeⅠ(SWEET1—SWEET3)作为己糖转运蛋白,主要转运葡萄糖;CladeⅡ(SWEET4—SWEET8)主要作用是转运葡萄糖;CladeⅢ(SWET9—SWEET15)主要转运蔗糖;CladeⅣ(SWEET16—SWEET17)是一种液泡膜转运蛋白,主要转运果糖[7]。SWEETs作为糖转运蛋白参与不同组织和器官中糖类的交换和运输,对植物花器官、花蜜分泌和花粉的发育起着重要的作用[4]。如、、和参与生殖器官的发育,与花粉发育和花蜜分泌进程有关[8-11]。在花器官的表达部位不同,拟南芥和主要在雄蕊中表达,主要在花瓣中表达;水稻在圆锥花序和花药中表达[12-14]。、和,在拟南芥的种子发育中表现出特异性时空表达模式,它们的三突变体显示出严重的种子缺陷,包括胚乳发育延迟、种子重量减少和淀粉含量降低,在种子成熟期表现出明显的表型[8,15]。水稻中的RNA干扰会导致花粉发育不良,进而引起雄性不育,降低颖果中的淀粉含量[16],导致种子表面褶皱,重量减少。的突变体植株后代呈现种子变小,部分表型生长推迟[17]。在玉米和水稻种子灌浆期和负责己糖跨基部的胚乳转换层进行转运[18];而拟南芥调节糖从源到库的运输,受到抑制会降低源器官的糖含量[19]。水稻参与半乳糖的转运,其过表达会导致半乳糖代谢机制发生改变,从而引起植株生长延迟、根长变短[20]。水稻和拟南芥等在花器官和特定发育阶段表达,参与单糖和二糖的转运,这表明各自在调控植物生殖生长过程发挥不同的作用。【本研究切入点】目前,虽已在拟南芥和水稻花器官和种子方面鉴定了SWEETs部分成员的生理功能,对调控作物产量形成中碳素分配具有重要意义,但在以果实作为糖积累器官的重要蔬菜作物-如番茄上有关SWEETs的相关报道较少。前期研究发现在果实发育时期尤其是绿果期大量表达,在其他部位表达量极低[6]。相比较植物源端韧皮部装载和运输途径的研究,尚无SWEETs蛋白在番茄果实库器官中介导蔗糖供给与代谢积累的生理功能和调控机理报道。【拟解决的关键问题】本研究通过转基因技术获得沉默和过表达植株,在对的表达量与果实中糖的分析基础上,探究转运糖的作用机制,进一步了解的功能,有助于为番茄果实品质的改良提供参考。
1 材料与方法
试验于2015年9月至2017年12月在沈阳农业大学设施园艺省部共建教育部重点实验室进行。
1.1 试验材料
供试番茄品种为Micro-Tom(),试材取自沈阳农业大学蔬菜分子生物学番茄课题组。所用菌株和质粒:大肠杆菌菌株DH5α(TARATA,Japan)、农杆菌菌株LBA4404(TARATA,Japan)、具有氨苄霉素(Amp)抗性的pENTR/D-TOPO(Invitrogen,USA)质粒、具有壮观霉素(Spe)抗性的pB7GWIWG2(I)(Invitrogen),含有筛选标记基因Ⅱ新霉素磷酸转移酶基因卡那霉素(Kan)抗性的pBI121质粒。
1.2 番茄SlSWEET7a全长的获得
根据NCBI(http://www.ncbi.nlm.nih.gov/)中的cDNA序列用Primer Primer 5软件设计扩增特异引物。以Micro-Tom番茄果实为试验材料,利用RNAprep pure Plant Kit试剂盒(TIANGEN)提取总RNA,利用FastKing RT Kit(With gDNase)反转录试剂盒(TIANGEN)将RNA反转录为cDNA。PCR反应程序为98℃30 s;98℃10 s,50℃30 s,72℃30 s,35个循环;72℃5 min。
1.3 SlSWEET7a表达载体的构建及农杆菌转化
1.3.1 超表达载体构建 利用正向F引物(5′-CCCCCGGGACATAGCTATGACTTTTAATAG-3′)和反向R引物(5′-TGAAAAACAGAAGGCCCAA T-3′)进行PCR。反应程序为98℃30 s;98℃10 s,50℃30 s,72℃30 s,35个循环;72℃5 min,4℃10 min。产物经1%琼脂糖凝胶电泳检测,将目的条带进行胶回收纯化产物和pBI121质粒用限制性内切酶Ⅰ和HⅠ进行双酶切,即30℃30 min;85℃15 min。将两者用T4连接酶进行连接,通过热激法转化大肠杆菌DH5α,在含有卡那霉素的LB平板上进行培养,挑取单一、大小合适的菌落于含有卡那霉素的LB液体培养基中,测序成功后用TIANprep Rapid Mini Plasmid Kit试剂盒(TIANGEN)提取重组质粒。
1.3.2 沉默载体构建 根据的特异性序列,设计S7a-F引物(5′-CACCTGATGCCTACATTCT CGCACC-3′)和S7a-R引物(5′-TCCTTTAGCCTCTC TTGCTGCC-3′)进行特异片段扩增,反应程序为98℃30 s;98℃10 s,60℃15 s,72℃30 s,35个循环;72℃5 min,4℃10min。获得的PCR产物利用Gateway技术与中间载体pENTR/D-TOPO连接,形成pENTR/D-TOPO–SWEET7a载体,测序鉴定正确后与终载体pB7GWIWG2(Ⅰ)进行LR反应。转化获得重组质粒。
1.3.3 农杆菌的转化 采用液氮冻融法转化农杆菌。将构建好的pBI121-35S-和pB7GWIWG2(Ⅰ)-35S-质粒转入到农杆菌感受态LBA4404中,分别涂在含有50 mg∙L-1Kan和25 mg∙L-1利福平(Rif)与75 mg∙L-1壮观霉素(Spe)和25 mg∙L-1Rif的YEB固体培养基中28℃培养20 h,然后在摇箱中以220 r/min摇到OD600=0.6。菌液测序成功后用于番茄的遗传转化。菌液储存在50%的甘油中,-80℃保存备用。
1.4 过表达载体和沉默载体的瞬时表达
采用农杆菌介导的果实注射法进行瞬时表达分析,取Micro-Tom绿熟期果实,用一次性注射器吸取1 mL分别含有过表达载体和沉默载体的菌液缓慢注入果实中,黑暗条件下培养24 h后,在光照下培养3 d后进行取样和果实总RNA提取,最后进行qRT-PCR分析的表达量。
1.5 番茄的遗传转化
参照Guo等[21]建立的番茄遗传再生体系,采用叶盘法将沉默和过表达载体利用农杆菌介导分别转化Micro-Tom番茄。将无菌番茄子叶切成0.5 cm2的小块,正面朝下置于预培养基上(MS+15 g∙L-1蔗糖+7 g∙L-1琼脂),25℃暗培养2 d后,将预培养的外植体浸入用MS液体培养基稀释的农杆菌悬浮液中5 min(浸染浓度OD600=0.6),用无菌滤纸吸去外植体表面多余菌液,放置共培养基(MS+30 g∙L-1蔗糖+7 g∙L-1琼脂+20 mg∙L-1乙酰丁香酮)中,暗培养2 d;然后转入生芽培养基(MS+30 g∙L-1蔗糖+7 g∙L-1琼脂+ 1 mg∙L-16-苄基腺嘌呤+0.2 mg∙L-13-吲哚乙酸)中25℃,1 800 lx光强的条件下培养两周后,再转入新的生芽培养基继代培养;待培养45天左右,转化的抗性芽长至2—3 cm时,将芽切下转入生根培养基(MS+30 g∙L-1蔗糖+7 g∙L-1琼脂+0.05 mg∙L-1α-萘乙酸)中诱导生根,将生根良好的T0代植株移到营养液中(山崎配方)遮荫保湿,炼苗3 d,然后将植株种植到基质中,放置25℃,1800 lx光强,16 h光照/8 h黑暗的光照培养室中生长。
1.6 转基因植株的分子检测
采用DNAsecure Plant Kit试剂盒(TIANGEN)提取转基因植株成熟叶片总DNA。沉默阳性植株鉴定以表达载体pB7GWIWG2(I)的除草剂抗性基因为筛选标记基因,通过设计Bar-F(5′-GAAGTCCAGCT GCCAGAAA-3′)和Bar-R(5′-CACCATCGTCAACCA CTACAT-3′),进行PCR检测,PCR反应程序为94℃5 min;94℃30 s,60℃30 s,72℃1 min,35个循环;72℃5 min。过表达阳性植株的鉴定利用pBI121载体上的标记基因设计引物,用Kan-F(5′-GT CATACCACTTGTCCGCCCT-3′)和Kan-R(5′-GACC ACCTATGATGTGGAACGGGAAAA-3′)引物对过表达植株进行PCR鉴定,PCR反应程序为94℃5 min;94℃30 s,59℃32 s,72℃1 min,35个循环;72℃5 min。野生型植株作阴性对照。取PCR反应产物进行1%琼脂糖凝胶电泳,紫外检测仪检测。
1.7 糖含量的测定
取0.5 g鲜样采用液相色谱测定法对T1代转基因植株的绿熟期果实及叶片进行果糖、葡萄糖和蔗糖3种糖的测定[22]。液相色谱仪(Waters e 2695,USA)测定条件为进样温度35℃;流速1.0 mL∙min-1;柱子(Previl Carbohydrate ES 5u);蒸发光散射检测器(Alltech ELSD2000ES)。
1.8 RNA提取、反转录及实时荧光定量PCR分析
利用天根生化科技有限公司的RNAprep pure Plant Kit试剂盒(TIANGEN)试剂盒提取总RNA,采用PrimeScriptTMRT反转录试剂盒(TaKaRa,大连,中国)合成cDNA。根据的全长序列,利用Primer Primer 5软件设计引物(-F:5′-TG ATGCCTACATTCTCGCACC-3′和-R:5′-TCCTTTAGCCTCTCTTGCTGCC-3′;内参引物Actin-F:5′-TGTCCCTATTTACGAGGGTTATGC-3′和Actin-R:5′-AGTTAAATCACGACCAGCAAGA T-3′)。实时荧光定量PCR利用TransStart Tip Green qPCR SuperMix(TransGen Biotech,北京,中国)试剂盒,仪器为BIO-RAD IQ5,使用TIANGEN生物公司的Super Real MasterMix(SYBR Green)试剂盒,反应体系为2×SYBG Green Mix 9 µL、cDNA 2 µL、正向引物F1 µL和ddH2O 8 µL。qRT-PCR反应程序为95℃3 min;95℃30 s,55℃30 s,68℃15 s,40个循环。用2-ΔΔCt方法进行数据分析。
2 结果
2.1 SlSWEET7a的生物信息学分析
SlSWEET7a在NCBI中的蛋白编码是LOC101246848,由254个氨基酸构成,如图1所示的SlSWEET7a蛋白跨膜结构域图,图中蓝色线代表细胞质定位,粉色线代表质外体定位,红色线段代表跨膜结构域,从图1可看出SlSWEET7a蛋白结构是由7个跨膜结构域构成的,跨膜结构域以外的区域较短。
将番茄与拟南芥SWEETs家族成员进行同源性分析(图2),可看出与—同源性较高,研究表明、和具有双向葡萄糖运输能力,属于CladeⅡ。的功能与—功能相似,可预测主要作为单糖转运体行使功能,可能在番茄的果实发育及成熟过程中发挥作用。
2.2 SlSWEET7a的组织特异性表达
提取番茄绿熟期、转色期、红熟期果实的果柄、萼片、果皮、中果肉、胶质胎座、维管束、心室隔壁部位的RNA,反转录cDNA后,以管家基因为内参基因,对其组织特异性表达进行qRT-PCR检测(图3)。在绿熟期的果实维管束中的表达量最高,较对照明显上调了3倍;果柄中的表达量也上调,其中在萼片中的表达量最低,其他部位的表达量显著下调。转色期果实在心室隔壁的表达量最低。红熟期果实与转色期的表达模式相似,其他组织的表达量都显著低于根部,在果皮的表达量最低。
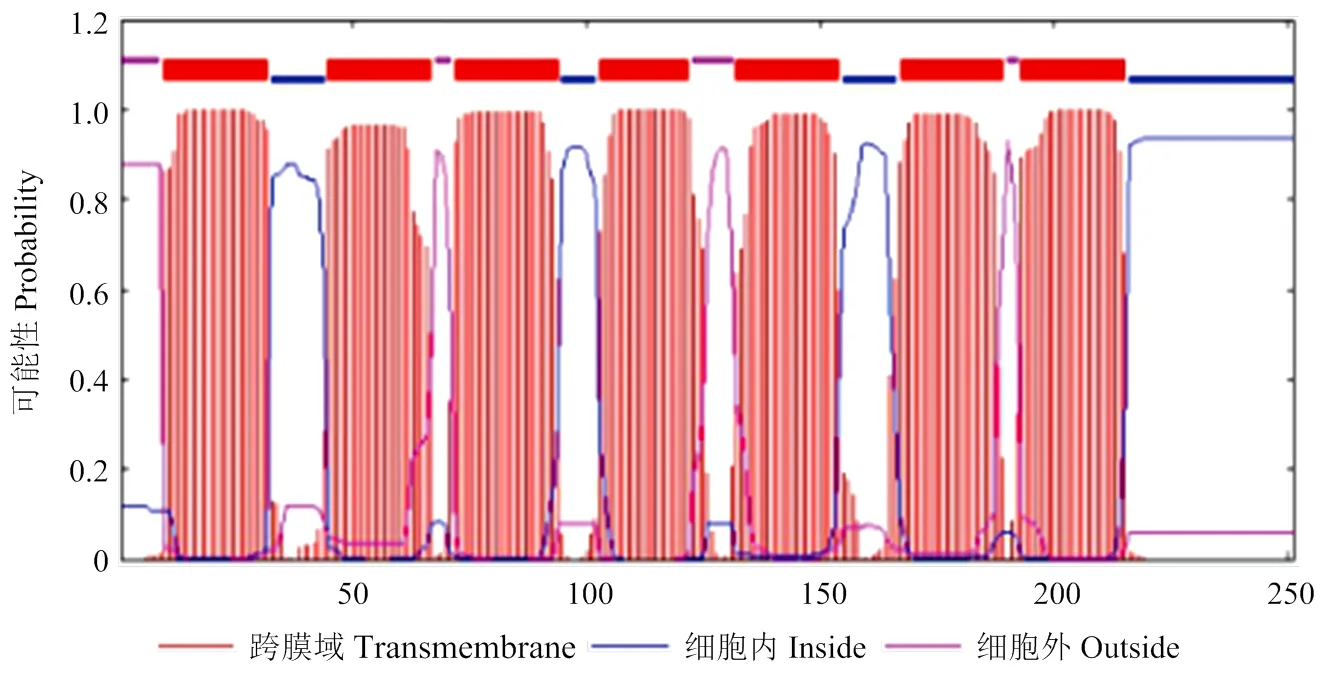
蓝色线代表细胞质定位,粉色线代表质外体定位,红色线段代表跨膜结构域
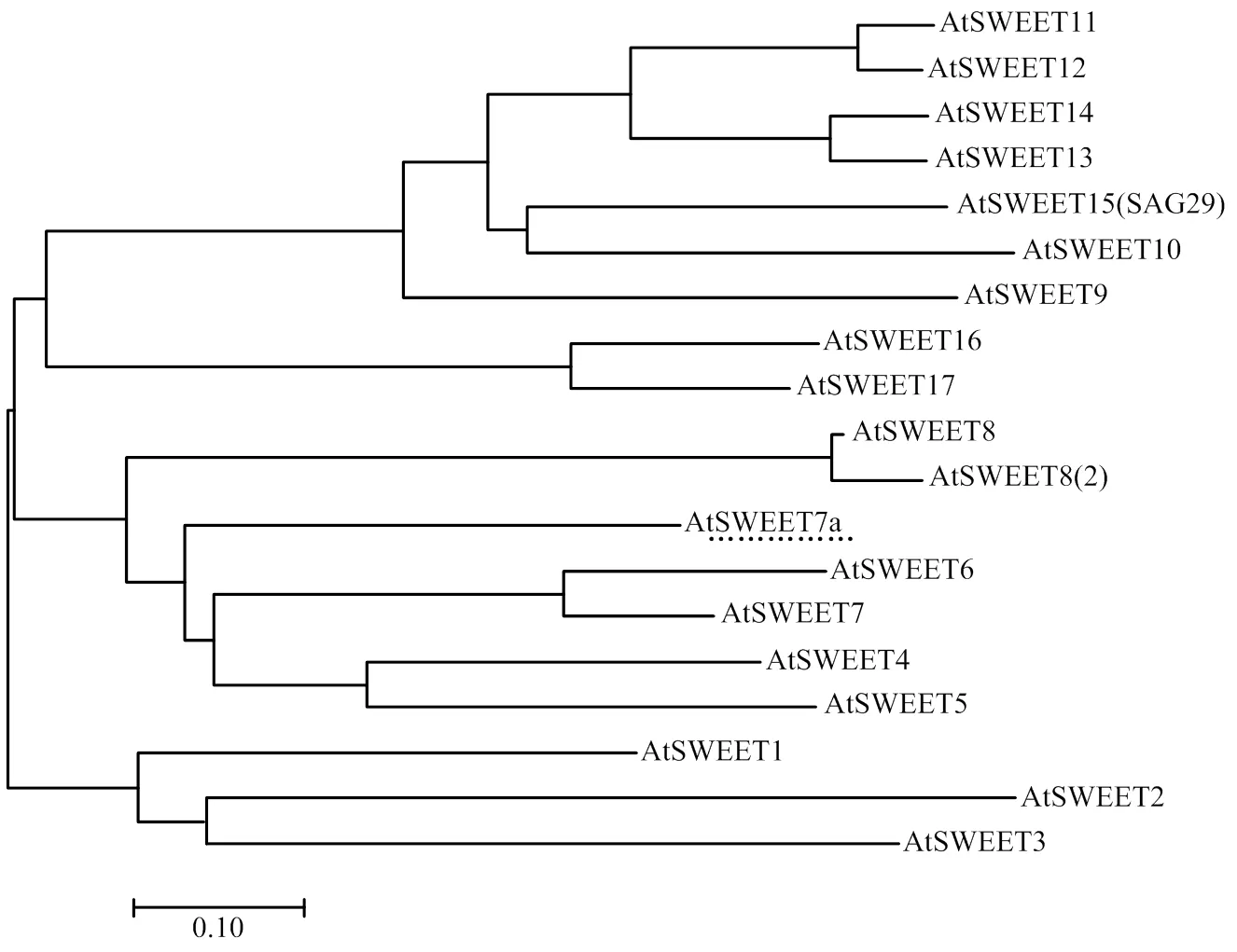
……:SlSWEET7a所处进化树中位置,AtSWEET:拟南芥SWEET;SlSWEET:番茄SWEET
2.3 SlSWEET7a表达载体的获得
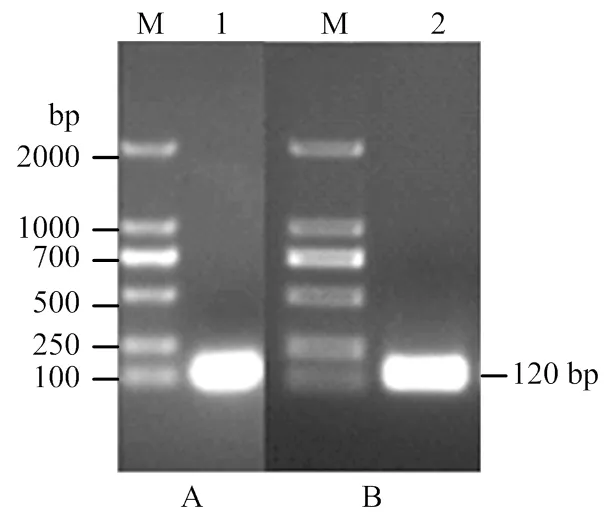
2.3.1过表达全长的PCR扩增及过表达载体检测 根据已获得的cDNA全长,设计过表达引物扩增(图4),获得842 bp的目的片段,通过胶回收纯化目的片段,纯化产物经测序得到的序列用NCBI软件进行Blast分析,与cDNA全长完全吻合。然后将测序匹配成功的产物和pBI121质粒分别用限制性内切酶Ⅰ和HⅠ进行双酶切,进行连接反应,转化大肠杆菌DH5α感受态细胞,取菌液进行PCR扩增鉴定(图4),含有目的片段的菌液进行测序,鉴定成功的菌液提质粒,重组质粒命名为pBI121-35S-。构建好的过表达载体转入农杆菌LBA4404中,用于转化番茄。
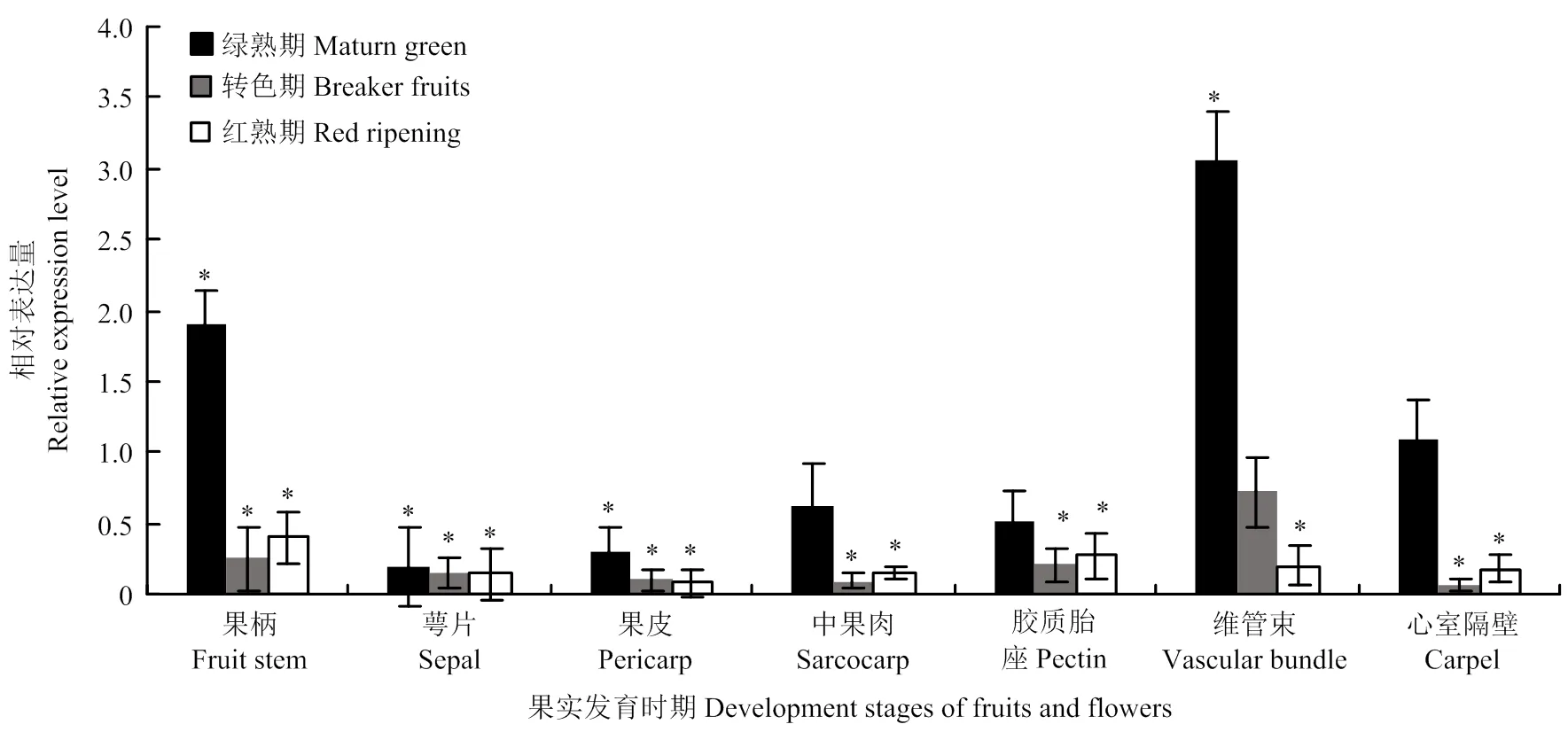
每组数据进行3次试验重复,采用Statistics 17.0软件分析。*代表差异显著性(p<0.05)。下同
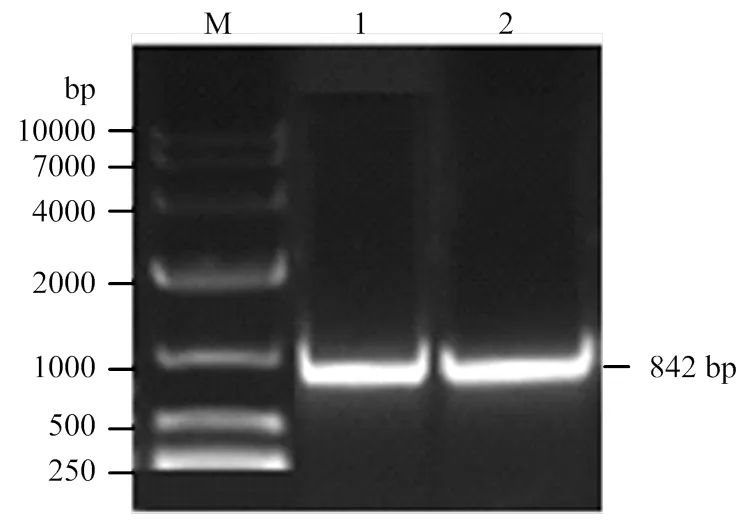
M:DNA Marker 10000;1:SlSWEET7a的PCR产物;2:过表达载体菌液PCR扩增产物
2.3.2 沉默全长的获得及沉默载体检测 根据已知序列全长,按照RNA干扰原理设计沉默引物,进行沉默目的片段PCR扩增(图5-A)。采用Gateway技术构建沉默载体,LR反应后转化大肠杆菌DH5α感受态,菌液PCR验证正确(图5-B)进行测序,测序片段比对成功的菌液提取质粒为pB7GWIWG2(Ⅰ)-35S-,进行农杆菌的转化。
M:DNA Marker 2000;1:PCR扩增产物;2:沉默载体菌液PCR产物
2.4 番茄SlSWEET7a超表达载体及沉默载体的瞬时表达分析
采用瞬时表达的方法对构建的沉默及过表达载体的效率进行初步探究,以未注射果实为CK、OE7a和S7a果实分别是注射了含有超表达载体pBI121-35S-和沉默载体pB7GWIWG2(I)- 35S-的农杆菌菌液。注射3 d后提取注射果实总RNA反转成cDNA进行qRT-PCR(图6)。以未注射果实的相对表达水平为对照,发现OE7a样品果实中的表达量是未注射果实的6倍,其表达量明显上调,S7a样品果实中与CK相比明显下调了5倍。综上所述,构建的沉默和过表达载体能够引起在番茄果实中的表达变化,可用于进一步的遗传转化。
2.5 番茄转基因材料的获得和鉴定
过表达和沉默转基因番茄植株的获得(图7),分别经含有载体抗性基因和的培养基筛选,获得10株可能的超表达植株,14株沉默植株。
对筛选出的转基因植株进行PCR鉴定。结果表明,转基因植株均扩增出与阳性对照大小一致的目的片段(图8-A和图8-B),经测序鉴定正确,而阴性对照(未转化植株)未扩增出任何条带。初步确定目的基因已整合到番茄基因组中,获得过表达植株8株,沉默植株10株。
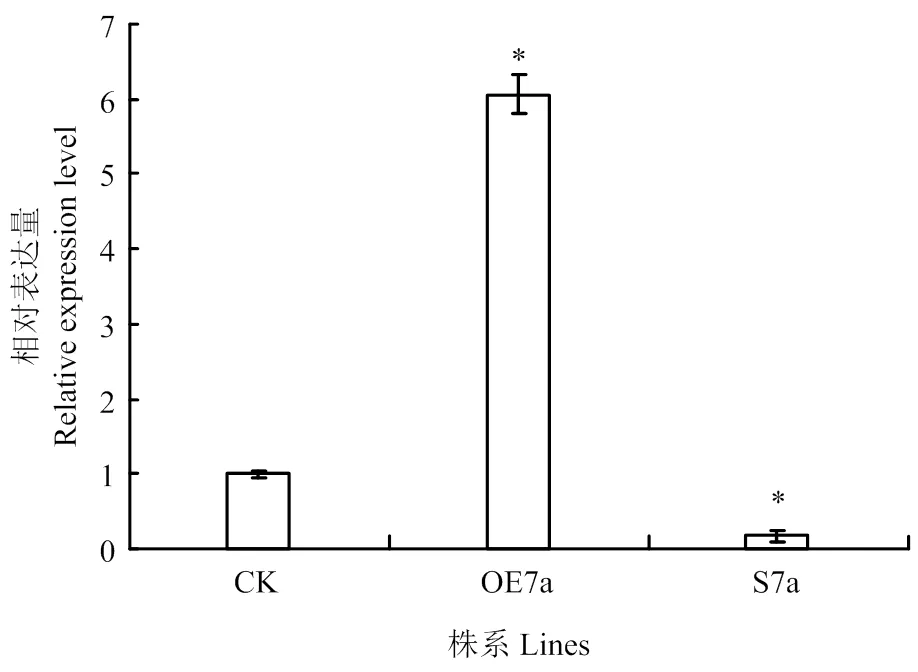
CK:对照;OE7a:过表达植株;S7a:沉默植株。每组数据为3次重复平均值

a:种子发芽;b:共培养;c:选择培养/生芽培养;d:生根培养;e:炼苗;f:移栽
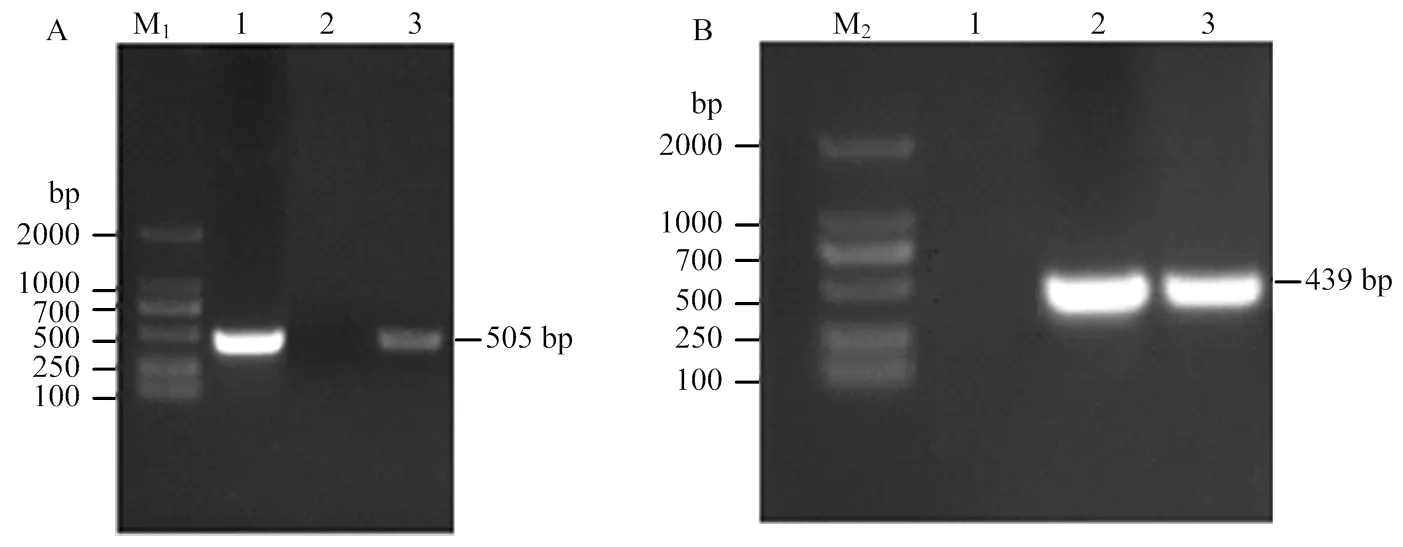
A:1:阳性对照,2:阴性对照,3:过表达植株;B:1:阴性对照,2:阳性对照,3:沉默植株。M:Marker
2.6 转基因番茄T1代绿果期的实时荧光定量PCR分析
前期试验结果表明番茄在果实绿熟期表达量最高。因此,对于获得的T1转基因植株分别提取绿熟期果实的总RNA,进行实时荧光定量PCR分析(图9)。以正常植株CK的表达量为对照,过表达植株7a-1、7a-2的表达水平均显著低于对照,分别比对照下降13.78倍和4.05倍;沉默植株7a-3、7a-4、7a-5与对照相比表达量降低,分别降低4.64、1.20和2.21倍。进一步验证了前面筛选获得的转基因植株是阳性植株,依据实时定量分析结果,本研究获得的过表达株系均发生了转基因沉默现象。
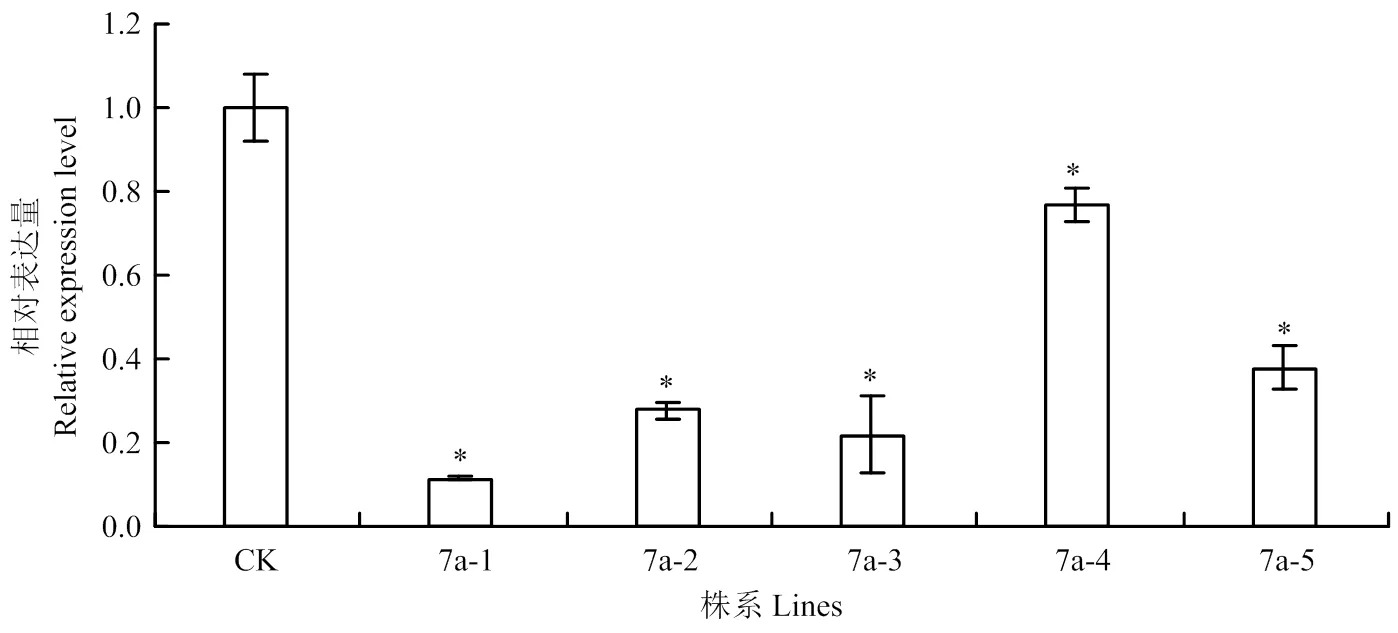
CK:对照,7a-1和7a-2为过表达植株;7a-3、7a-4和7a-5为沉默植株。每组数据为3次重复平均值
2.7 T1代转基因植株中糖的测定
植物成熟叶片作为“源”,其同化的光合产物除一部分用于自身代谢外,主要以蔗糖的形式通过韧皮部输送到果实等库组织中贮藏和利用。作为SWEETs家族CladeⅡ成员,主要参与单糖的运输。如表1所示,过表达植株7a-1和7a-2成熟叶片中果糖、葡萄糖和蔗糖含量较对照均升高;沉默植株7a-3、7a-4、7a-5叶片果糖含量提高1.1—9.2倍;7a-3和7a-5葡萄糖水平分别高于对照的9.2和1.1倍,而7a-5则无明显变化;蔗糖含量均较WT提高2.5—11.7倍。而番茄作为肉质果实,在果实发育过程中发挥着重要的作用,因此,果实中的糖浓度可以表现出SlSWEET7a参与糖转运的水平,由于在果实绿果期大量表达(图3),测定绿熟期果实糖含量。在对照植株中(表1),绿果的果糖的含量为3.84 mg·g-1FW,过表达株系7a-1和7a-2的果糖含量较野生型高1.4和3.7倍,沉默植株7a-3和7a-5的果糖提高1.3和2.2倍,而7a-4没有显著改变;和果糖一样,与WT相比,除了7a-4沉默株系无明显变化,其他过表达和沉默植株的葡萄糖和蔗糖水平均显著增加,分别升高了2.0—4.8倍和2.1—2.8倍。结果表明,过表达植株和沉默植株中果实和成熟叶片糖的变化趋势一致,过表达植株发生了沉默现象,沉默能够引起果实和成熟叶片果糖、葡萄糖和蔗糖的升高,特别是叶片中这三种糖的含量。
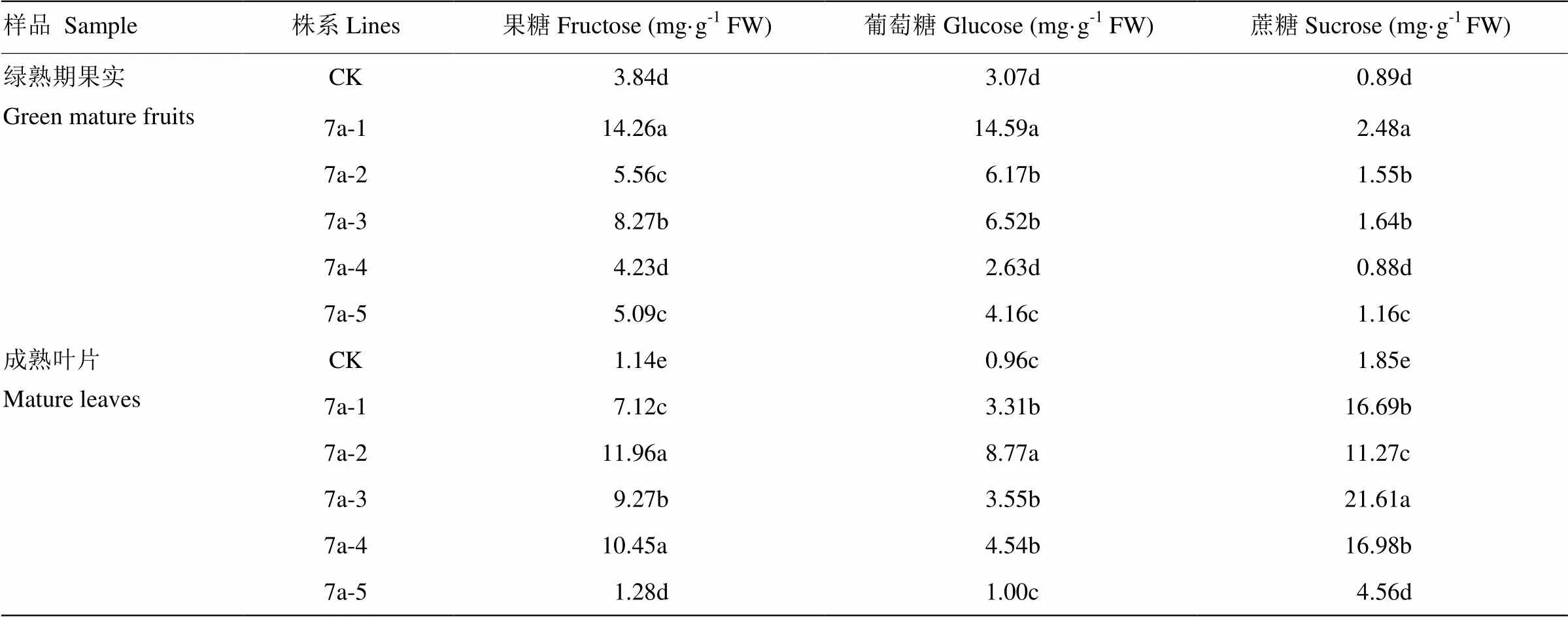
表1 T1代沉默和过表达转基因植株绿熟期果实和叶片的糖含量
CK:对照;7a-1和7a-2为过表达植株;7a-3、7a-4和7a-5为沉默植株;FW:鲜重;每组数据进行3次试验重复,采用Statistics 17.0软件分析,不同字母代表差异显著性
CK: Control; 7a-1 and 7a-2: overexpressing plants; 7a-3, 7a-4 and 7a-5: silencing plants; FW: Fresh weight; WT: Wild type. Data represent the mean±SE(n=3). Data are analyzed by SPSS Statistics 17.0. Means with different letters within a column indicate significant differences (least significant difference (<0.05)
3 讨论
研究表明拟南芥中SWEETs家族CladeⅡ的成员AtSWEET4、AtSWEET5、AtSWEET7具有双向葡萄糖运输能力,主要影响细胞中葡萄糖的转运[15]。本研究中番茄SlSWEET7a与拟南芥中SWEETs的生物信息学分析表明SlSWEET7a与AtSWEET4—AtSWEET8具有较高的同源性。拟南芥中相关CladeⅡ的大多都在花器官中表达,参与了花粉的发育。在花粉的营养细胞中特异性表达,尤其是在花粉成熟期高效表达,而在花粉发育时期能优先表达[9,23]。,也被称为,在植物花药及花粉壁的发育时期发挥作用[24]。水稻中相关的在叶片和根茎部的生长区及萼片部位表达,对其顶端发育有着调控作用[25]。葡萄中的在其花中表达量最高,它的表达量随着葡萄浆果的成熟也随之升高[26]。本研究中番茄果实的时空表达分析中发现在番茄果实绿熟期高水平表达,说明其对果实发育起着调控作用,与其生物信息学分析结果一致。从不同部位表达来看,在果实维管束和果柄表达量最高。果柄和果实维管束都属于韧皮部疏导组织,在这两个部位大量表达说明该基因有可能影响糖从源器官运输到库器官的易化扩散。果实的转色期和红熟期,表达量都很低,可能是家族其他成员或其他糖转运蛋白发挥主要作用。
研究基因在植物中行使功能时常用到瞬时表达技术,将外源基因随载体进入目标植物细胞中表达,2—3 d内即可检测出外源基因的高水平表达量,而且农杆菌介导的瞬时表达是一种快速有效的分析基因表达的方法[27]。本研究通过对番茄果实进行瞬时表达处理,发现注射基因超表达及沉默载体的果实,其的表达量与未注射果实具有显著性差异。含有过表达载体的农杆菌注射后导致绿熟期果实表达量显著上调;而含有沉默载体的农杆菌注射果实后,表达量显著下调,初步验证了所构建载体能够调控在番茄果实中的表达。在对番茄的遗传转化及阳性植株的PCR检测T1代转基因番茄材料(图9)发现,过表达植株中表达量反而下降,显著低于对照,这一结果是由于发生了转基因的沉默现象。构建的过表达载体进行瞬时表达与稳定表达后对细胞内表达量的影响不同,这是由于瞬时表达过程中T-DNA并没有转化到基因组里,仅仅是短时期的在本代的一个阶段表达,而稳定表达通过载体的左右边界,插入整合到植物基因组里,可以随基因组分裂进行遗传。在这一过程中有可能受插入染色体位点、DNA甲基化及植物本身的调节机制影响[28]。由于在瞬时表达中检测到高于对照果实的表达因此从沉默机制上,本研究中出现的过表达引起的转基因沉默可能属于转录水平的基因沉默。
目前,关于SWEET蛋白开展的研究结果显示,它们在细胞与环境或细胞与细胞之间的糖类运输过程中有重要作用[4,7-8,29]。如AtSWEET1是浓度依赖型的具有双向低亲和运输葡萄糖的能力。AtSWEET11和AtSWEET12 则是蔗糖低亲和的运输载体,在拟南芥叶片维管束细脉韧皮部薄壁细胞中表达,参与韧皮部薄壁细胞中蔗糖向质外体的运输[7]。水稻OsSWEET11和OsSWEET14也是蔗糖低亲和的运输载体, 它们也参与韧皮部蔗糖的装载过程[4]。本研究对获得的沉默T1代株系果实和叶片中糖含量的测定结果表明(表1),沉默后植株叶片和果实中果糖、葡萄糖和蔗糖含量高于对照,尤其是叶片中蔗糖含量显著高于对照,说明SlSWEET7a可以转运果糖、葡萄糖和蔗糖。这一结果与水稻中OsSWEET11和OsSWEET14、拟南芥AtSWEET11和AtSWEET12也可以转运单糖和二糖的结论是一致的[7]。另外一些SWEET蛋白接收不同分子大小的底物,在糖易化功能方面SWEET基因家族成员之间存在冗余现象,而且对于一些依赖特定底物定位在质膜上的糖转运蛋白单糖转运蛋白(monosaccharides transporter,MST)和蔗糖转运蛋白(Sucrose transporter,SUT/SUC)家族来说,它们的作用是未知的[30-31],可能在SWEET7a的过表达和沉默之后,激活了这些转运蛋白和其他SWEET的活性,对糖的转运也发挥了作用,这需要进一步进行qRT-PCR验证。另外,SWEET7a在爪蟾卵母细胞中的功能是转运单糖葡萄糖,这可能在动物和植物中其转运糖的表达方式不同[4,7]。
4 结论
SlSWEET7a与AtSWEET4—AtSWEET8具有较高的同源性,均属于SWEETs蛋白家族CladeⅡ的成员,预测具有单糖的转运功能。SlSWEET7a对糖从源器官运输到库器官的易化扩散起作用。对叶片中蔗糖向源组织韧皮部的装载及果实果柄、维管束的运输、卸载起重要调控作用。同时SWEET基因家族成员之间的糖易化功能存在冗余。
[1] Roitsch T, Gonzalez M C. Function and regulation of plant invertases: sweet sensations., 2004, 9: 606-613.
[2] Guo W J, Nagy R, Chen H Y, Pfrunder S, Yu Y C, Santelia D, Martinoia E. SWEET17, a facilitative transporter, mediates fructose transport across the tonoplast ofroots and leaves., 2014, 164(2): 777-789.
[3] Lemoine R, La Camera S, Atanassova R, Dédaldéchamp F, Allario T, Pourtau N, Faucher M. Source-to-sink transport of sugar and regulation by environmental factors., 2013, 4: 272.
[4] Chen L Q, Hou B H, Lalonde S, Takanaga H, Hartung M L, Qu X Q, Chermak D. Sugar transporters for intercellular exchange and nutrition of pathogens., 2010, 468: 527-532.
[5] Braun D M. SWEET! The pathway is complete.,2012, 335(6065): 173-174.
[6] Feng C Y, Han J X, Han X X, Jiang J. Genome-wide identification, phylogeny, and expression analysis of the SWEET gene family in tomato.,2015, 573(2): 261-272.
[7] Chen L Q, Qu X Q, Hou B H, Sosso D, Osorio S, Fernie A R, Frommer W B. Sucrose efflux mediated by SWEET proteins as a key step for phloem transport.,2012, 335: 207–211.
[8] Eom J S, Chen L Q, Sosso D, Julius B T, Lin I W, Qu X Q,Frommer W B. SWEETs, transporters for intracellular and intercellular sugar translocation.,2015, 25: 53-62.
[9] Engel M L, Davis R H, McCormick S, McCormick S. Green sperm. Identification of male gamete promoters in.,2005, 138: 2124-2133.
[10] Guan Y F, Huang X Y, Zhu J, Gao J F, Zhang H X, Yang Z N, Yang Z N.Ruptured pollen GRAIN1, a member of the MtN3/saliva gene family, is crucial for exine pattern formation and cell integrity of microspores in., 2008, 147: 852-863.
[11] Sun M X, Huang X Y, Yang J, Guan Y F, Yang Z N.RPG1 is important for primexine deposition and functions redundantly with RPG2 for plant fertility at the late reproductive stage., 2013, 26, 83-91.
[12] Moriyama E N, Strope P K, Opiyo S O, Chen Z, Jones A M. Mining thegenome for highly-divergent seven transmembrane receptors.,2006, 7(10): R96.
[13] Kann Y, Oikawa T, Chiba Y, Ishimaru Y, Shimizu T, Sano N, Seo M. AtSWEET13 and AtSWEET14 regulate gibberellin-mediated physiological processes.,2016, 7: 13245.
[14] Yuan M, Wang S. Rice MtN3/saliva/SWEET family genes and their homologs in cellular organisms.,2013, 6(3): 665-674.
[15] Chen L Q, Lin I W, Qu X Q, Sosso D, McFarlane H E, Londono A, Samuels A L, Frommer W B, Frommer W B. A cascade of sequentially expressed sucrose transporters in the seed coat and endosperm provides nutrition for theembryo., 2015, 27: 607-619.
[16] Ma L, Zhang D, Miao Q, Yang J, Xuan Y,Hu Y.Essential role of sugar transporter OsSWEET11 during the early stage of rice grain filling., 2017, 58(5): 863-873.
[17] Chu Z, Fu B, Yang H, Xu C, Li Z, Sanchez A, Wang S. Targeting xa13, a recessive gene for bacterial blight resistance in rice.,2006, 112(3): 455-461.
[18] Sosso D, Luo D, Li Q B, Sasse J, Yang J, Gendrot G, Rogowsky P M. Seed filling in domesticated maize and rice depends on SWEET-mediated hexose transport.,2015, 47(12): 1489-1493.
[19] Liu X, Zhang Y, Yang C, Tian Z,Li J. AtSWEET4, a hexose facilitator, mediates sugar transport to axial sinks and affects plant development., 2016, 6: 24563.
[20] Zhou Y, Liu L, Huang W, Yuan M, Zhou F, Li X,Lin Y. Overexpression of OsSWEET5 in rice causes growth retardation and precocious senescence., 2014, 9(4): e94210.
[21] Guo M, Zhang Y L, Meng Z J, Jiang J. Optimization of factors affecting-mediated transformation of Micro-Tom tomatoes., 2012, 11(1): 661-671.
[22] 郝敬虹, 李天来, 孟思达, 赵博, 孙利萍. 夜间低温对薄皮甜瓜果实糖积累及代谢相关酶活性的影响. 中国农业科学, 2009, 42(10): 3592-3599.
HAO J H, LI T L, MENG S D, ZHAO B, SUN L P. Effects of night low temperature on sugar accumulation and sugar-metabolizing enzyme activities in melon fruit., 2009, 42(10): 3592-3599. (in Chinese)
[23] Wellmer F, Alves-Ferreira M, Dubois A, Riechmann J L, Meyerowitz E M. Genome-wide analysis of gene expression during earlyflower development.,2006,(7): e117.
[24] Bock K W, Honys D, Ward J M, Padmanaban S, Nawrocki E P, Hirschi K D, Sze H. Integrating membrane transport with male gametophyte development and function through transcriptomics., 2006, 140(4): 1151-1168.
[25] 刘畅, 姜晶, 韩晓雪, 韩佳轩. 植物中SWEET基因家族研究进展. 植物生理学报, 2014, 509: 1367-1373.
LIU C, JIANG J, HAN X X, HAN J X. Research advances in SWEET gene family in plants., 2014, 509: 1367-1373. (in Chinese)
[26] Chong J, Piron M C, Meyer S, Meyer S, Merdinoglu D, Bertsch C, Mestre P. The SWEET family of sugar transporters in grapevine: VvSWEET4 is involved in the interaction with., 2014, 65(22): 6589-6601.
[27] 赵文婷, 魏建和, 刘晓东, 高志晖. 植物瞬时表达技术的主要方法与应用进展. 生物技术通讯, 2013, 2: 294-300.
ZHAO W T, WEI J H, LIU X D, GAO Z H. Advance of the main methods and applications of plant transient expression system., 2013, 2: 294-300. (in Chinese)
[28] 常丽娟, 刘勇, 宋君, 刘文娟, 张富丽, 王东, 尹全, 雷绍荣. 转基因植物中外源基因的沉默及应对策略. 生物技术通讯, 2013, 24(6): 881-885.
CHANG L J, LIU Y, SONG J, LIU W J, ZHANG F L, WANG D, YIN Q, LEI S R. Silence of exogenous genes in transgenic plants and the coping strategies., 2013, 24(6): 881-885. (in Chinese)
[29] Yuan M, Zhao J, Huang R, Li X, Xiao J, Wang S.Rice MtN3/saliva/SWEET gene family: evolution, expression profiling, and sugar transport.,2014, 56(6): 559-570.
[30] Büttner M, Sauer N. Monosaccharide transporters in plants: structure, function and physiology., 2000, 1465(1): 263-274.
[31] Lalonde S, Wipf D, Frommer W B. Transport mechanisms for organic forms of carbon and nitrogen between source and sink., 2004, 55: 341-372.
(责任编辑 李莉)
Functional Analysis ofGene during Maturation of Tomato Fruits
CHENG Jie, ZHANG XinSheng, LI AnQi, JIANG Jing
(CollegeofHorticulture,ShenyangAgriculturalUniversity/Key Laboratory of Protected Horticulture, Ministry of Education/Key Laboratory of Protected Horticulture of Liaoning Province, Shenyang 110866)
【Objective】The SWEETs (Sugars Will Eventually Be Exported Transporters) is a kind of sugar transporters which are involved in plant biological processes and play key roles in plant growth and development in response to various stresses and host-pathogen interaction.was cloned and its function was analyzed to provide the theoretical foundation for exploring the function of SWEETs during fruit development in plant by constructing the silence and overexpression of.【Method】Using Micro-Tom () as a test material, the 842 bp full-lengthcDNA was cloned in fruits. The phylogenetic tree of SWEET proteins fromwas constructed by using MEGA6.0, and homology ofprotein sequences was analysed compared withRT-PCR was performed to analyse the spatiotemporal expression ofduring the fruits development periods. Thesilence vector and overexpression vector were constructed and transformed into tomato by-mediated genetic transformation. The efficiency of two vectors was examined by the transient expression ofs injection method. The expressions ofin T1generation transgenic green fruits were studied by quantitative PCR. The changes of sugar composition and content in transgenic fruits and leaves were detected by high performance liquid chromatography.【Result】The bioinformatics analysis of protein sequence showed that the SlSWEET7a is consisted of seven transmembrane domains. SlSWEET7a belongs to the CladeⅡof theSWEETs gene family, which was highly homologous to AtSWEET6 and AtSWEET8 ina. The analysis of spatiotemporal expression indicated thatexpression level was the highest at stalks and vascular bundles of mature green stage in tomato fruits, while the relative expression level was lower in breaker fruits and red ripping stage. The transient expression ofsilencing (S7a) and overexpression (OE7a) vector in tomato fruits was observed. The expression level ofin fruit of OE7a was 6 times higher than that of non-injected fruit, which was significantly up-regulated compared with control. However, the expression level ofin S7a was significantly decreased 5 times. Ten overexpression lines were obtained by kanamycin resistance screening, and eight overexpression lines were obtained by PCR. Fourteen silencing lines were screened by phosphinothricin and 10 transgenic silence lines were obtained by PCR. Real-time quantitative PCR analysis of theexpression in T1generation lines revealed that gene silencing occurred in overexpressed plants. The expression level of-overexpressing transgenic plants was significantly lower than that in wild plants, so did the silencing plants. Those results explained that the overexpressing plants also had the phenomenon of gene silencing. The determination of contents of fructose, glucose, sucrose showed that the silencing and overexpressing plants were higher than that of the wild type in the leaves and fruits after reducing expression ofin tomato. Especially, the sucrose content of leaves was significantly increased. This showed thatplays an important role in the facilitated diffusion of sucrose in cells.【Conclusion】plays an important role in regulating the loading of sucrose into the phloem of fruit tissue, the transportation and unloading of fruit stalks and vascular bundles.
tomato; SWEET7a; sugar transporter; vector construction; expression analysis
2018-01-23;
2018-03-06
国家自然科学基金(31372054)、沈阳市重点研发专项(17-147-3-00)
程杰,Tel:15909820516;E-mail:904135901@qq.com。通信作者姜晶,Tel:13998229283;E-mail:jiangjingcau@163.com
10.3864/j.issn.0578-1752.2018.15.0011

