NaN3诱变对赤小豆种子萌发与幼苗抗氧化系统的影响
, , , ,
(山西大同大学生命科学学院, 山西 大同 037009)
赤小豆(Vignaangrlaris)又名赤豆、蛋白豆、赤山豆,豆科(Leguminosae)豇豆属(Vigna),一年生双子叶草本植物,外形呈椭圆或长椭圆状,多为赤褐色。赤小豆对土壤要求低,在微酸、微碱、微贫瘠中均能生长,在我国各地均普遍栽培。赤小豆具有广泛的药用价值和食用价值。目前,赤小豆在中药材领域应用广泛,它含有其他豆科植物缺乏或含量低的三萜皂甙等成分,具有抗癌,调节免疫系统,护肝及减肥等多重生理功能[1-2]。
化学诱变可快速改良物种,提高作物产量、质量等性状。叠氮化钠(NaN3)作为化学诱变常用的诱变剂之一,早期研究者采用的处理溶液pH值为7,而无法显示出叠氮化钠的诱变效果。后来,选用不同pH值进行实验发现,叠氮化钠溶液在pH值为3时,可诱发高频率的突变[3]。其诱变机理为:叠氮化钠等电点在pH=4.18,当用磷酸缓冲液(pH=3,现用现配)溶解叠氮化钠时,在溶液中会产生一种呈中性的HN3分子,它能够以自由扩散的方式透过细胞膜进入到细胞中,以碱基替换的方式影响DNA的正常合成,导致处理种子发生点突变[4-5]。叠氮化钠是一种强烈的呼吸抑制剂,抑制了电子传递链中的细胞色素氧化酶和过氧化物酶。相比于其他诱变剂,叠氮化钠具有高效、无毒、价格便宜等优点。
目前,关于叠氮化钠在其他物种方面的诱变实例较多[6-7],但是针对赤小豆叠氮化钠诱变却鲜有报道。赤小豆与其它豆科植物类似,农杆菌转化较为困难,不易构建插入突变体库[10]。本实验通过叠氮化钠处理赤小豆,研究种子萌发及抗氧化系统的变化,为赤小豆化学诱变育种及反向遗传学等研究提供参考依据。
1 材料与方法
1.1 材 料
赤小豆(由山西省农业科学院玉米研究所提供)。
1.2 方 法
选取颗粒饱满、无褶皱、大小均匀的赤小豆种子。先用沸水烫种30 s后,加入清水冷却,浸种6 h,沥干表面水分。将浸好的种子以每90粒置于三角瓶中,共18组(以每粒种子1 mL处理液,按设定的叠氮化钠浓度和时间梯度处理)。置于摇床培养箱(温度37 ℃,120 r/min),按设计的时间梯度培养。培养完成后,用硫代硫酸钠溶液处理15 min,终止反应,最后用清水冲洗5 min,洗去残留液。将处理好的种子放置在铺有2层滤纸的培养皿中,每个培养皿均匀地放置30粒种子,并使滤纸保持湿润状态,置于恒温培养箱(25 ℃)中,光照培养,统计7 d中赤小豆种子每天的发芽情况。将采用不同浓度,不同时间叠氮化钠诱变剂处理的赤小豆发芽种子分别移栽花盆中,每盆均匀放置5粒,培养成植株。
由于赤小豆发芽时间较长,所以在记录赤小豆发芽过程中,每天对赤小豆种子进行清洗,以防染菌对统计结果造成干扰。
1.3 指标测定
发芽率(%)=7 d所有发芽数/供试种子总数×100%。
SOD、POD和CAT活性测定参考高俊凤版《植物生理学实验指导》[9]。
1.4 数据处理
采用Excel和SPSS 23软件对数据进行分析。
2 结果与分析
2.1 叠氮化钠诱变对赤小豆种子发芽的影响
由表1可知:同一时间处理,磷酸缓冲液(pH=3)处理的赤小豆发芽率大于蒸馏水处理的发芽率,且差异水平极显著;采用较低浓度的叠氮化钠溶液(≤0.2 mmol/L)处理赤小豆种子后,赤小豆的发芽率及相对发芽率有平缓的增大趋势,而后随着叠氮化钠处理浓度的增大,赤小豆种子的发芽率和相对发芽率表现为下降。说明磷酸缓冲溶液(pH=3)和低浓度的叠氮化钠(≤0.2 mmol/L)对赤小豆种子萌发都有促进作用,而高浓度的叠氮化钠溶液会抑制种子萌发。相同浓度下(≤1.4 mmol/L)赤小豆种子发芽率随处理时间的延长而增大。表明适当的延长处理时间,会促进赤小豆种子萌发。由数据可知:诱变时间为20 h时,叠氮化钠对赤小豆的半致死浓度1.0 mmol/L。
表1 不同浓度和时间的叠氮化钠对红小豆发芽的影响

时间(h)浓度(mmol/L)发芽率(%)相对发芽率(%)16ck184.44cC92.68bBck291.11bB100.00cC0.297.78aA107.32aA0.675.56dD82.93dD1.036.67eE40.25eE1.424.44fF26.82fF1.813.33gG14.63gG20ck391.11bB93.96bBck496.97aA100.00aA0.297.78aA100.84aA0.677.78cC80.21cC1.048.89dD50.41dD1.47.78eE38.96eE1.827.78fF28.65fF24ck594.44aA97.70aAck696.67aA100.00aA0.296.97aA100.00aA0.680.00bB81.91bB1.051.11cC52.87cC1.450.00cC51.72dD1.827.78dD28.73eE
注:ck1,ck3,ck5处理液为蒸馏水;ck2,ck4,ck6处理液为pH=3的磷酸缓冲液。表中同系列不同字母代表存在差异,小写字母代表平均值差异的显著性水平为0.05,大写字母代表平均值差异的显著性水平为0.01。
2.2 叠氮化钠对赤小豆M1代叶片SOD活性的影响
如图1所示,相同处理时间下,磷酸缓冲溶液(pH=3)对赤小豆M1代叶片中的SOD活性影响较大,显著高于蒸馏水对照组;较低浓度叠氮化钠溶液(≤1.0 mmol/L)处理后,赤小豆M1代叶片中的SOD活性增大,但叠氮化钠浓度小于0.2 mmol/L时,赤小豆SOD活性增大不明显;随着叠氮化钠浓度继续增大,赤小豆叶片中SOD活性下降。说明磷酸缓冲溶液(pH=3)和较低浓度的叠氮化钠溶液(≤1.0 mmol/L)对赤小豆M1代叶片中的SOD活性有促进作用,较高浓度的叠氮化钠溶液(≥1.4 mmol/L)对赤小豆SOD活性有抑制作用。处理液浓度较低时(≤1.0 mmol/L),随着处理时间的延长,赤小豆M1代叶片SOD活性有平缓的增大趋势;随着处理液浓度增大,活性先平缓增大,后平缓减小。说明适宜的处理时间也能提高赤小豆SOD活性,但影响程度没有浓度梯度显著。
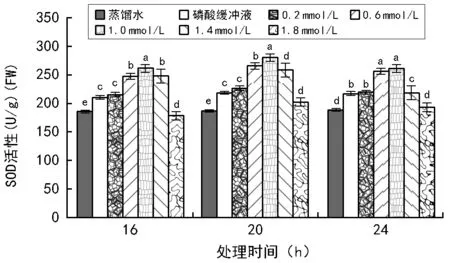
图1 NaN3处理对赤小豆M1代叶片SOD活性的影响(p<0.05)。
2.3 叠氮化钠对赤小豆M1代幼苗POD活性的影响
如图2所示,磷酸缓冲溶液(pH=3)和较低浓度的叠氮化钠溶液(≤0.6 mmol/L)均能使赤小豆M1代组织中的POD活性增大,但低浓度的叠氮化钠(≤0.2 mmol/L)使赤小豆POD活性增大不明显;而后随着处理液浓度增大,POD活性降低。说明磷酸缓冲溶液(pH=3)和较低浓度的叠氮化钠(≤0.6 mmol/L)对赤小豆M1代组织中的POD活性有促进作用,高浓度的叠氮化钠溶液(≥1.0 mmol/L)对赤小豆M1代组织的POD活性有抑制作用。相同处理液浓度下(≤0.2 mmol/L),赤小豆M1代POD活性随处理时间延长平缓增大,当处理液浓度大于0.6 mmol/L,赤小豆POD活性随处理时间延长而降低。说明适宜的处理时间对赤小豆M1代组织中的POD活性也有一定的促进作用,但时间过长则会抑制赤小豆的POD活性。
2.4 叠氮化钠对赤小豆M1代叶片CAT活性的影响
如图3所示,相同处理时间,磷酸缓冲溶液(pH=3)和叠氮化钠溶液都能使赤小豆M1代叶片中CAT活性增大,但在较低叠氮化钠浓度(≤0.6 mmol/L)诱变下,CAT活性增大不明显;叠氮化钠浓度继续升高,其活性显著增强。说明磷酸缓冲液(pH=3)和高浓度的叠氮化钠处理对赤小豆M1代CAT活性影响较大。相同处理浓度下,随着处理时间的延长,赤小豆M1代叶片中的CAT活性平缓升高。说明处理时间对赤小豆M1代叶片CAT活性也有一定的影响。

图2 NaN3处理对赤小豆M1代幼苗POD活性的影响(p<0.05)

图3 NaN3处理对赤小豆M1代叶片CAT活性的影响(p<0.05)
3 讨论与结论
叠氮化钠诱变是获得基因水平变异体的重要途径,了解叠氮化钠处理时间和处理浓度等基本条件是进行诱变育种的前提。联合国粮农组织与国际原子能委员会提出的谷类作物叠氮化钠处理一般程序应用于豆类作物应适当的修改。由于豆类种子种皮较厚,不易打破,体积大,发芽所需的水分多[8]。所以在其预浸、叠氮化钠诱变处理时间等方面都应适当的延长,诱变剂与种子比例应做适当的调整[9]。本研究采用0.0,0.2,0.6,1.0,1.4,1.8 mmol/L的叠氮化钠溶液对赤小豆种子进行诱变处理,处理时间为16,20,24 h。同一处理时间,NaN3浓度高于0.6 mmol/L时,赤小豆种子萌发受抑制,且叠氮化钠浓度越大,抑制作用越明显。诱变浓度较低时,处理时间延长可对种子萌发有促进作用。当处理时间为16,20 h时,磷酸缓冲溶液(pH=3)和低浓度(≤0.2 mmol/L)的叠氮化钠溶液对赤小豆萌发有极显著的影响。浸种16 h对所有种子是否都能打破萌发,还有待进一步探究。姚红等在不同培养条件对红小豆萌发特性影响研究中指出,35~45 ℃浸种24 h,红小豆的发芽率最高[11]。而在较低浓度(≤1.4 mmol/L)叠氮化钠处理下,随着时间延长,则有可能使赤小豆萌发,发芽率增大。而事实上,24 h的蒸馏水处理发芽率确实大于20 h的发芽率。

注:A为对照,B~F为不同浓度NaN3突变叶形。图4 观察到的M1代植株代表性突变表型
抗氧化系统作为植物适应和抵抗逆境能力的一个重要机制,SOD、POD、CAT活性是反映植物抗氧化系统能力的重要指标。正常代谢下,植物组织中自由基的产生与清除处于低水平平衡状态。在低胁迫环境下,植物体内的自由基清除系统激活,产生的作用超过了自由基对植物的损伤[12]。本研究显示,较低浓度诱变剂、适宜诱变时间可使赤小豆M1代幼苗中SOD、POD、CAT活性升高,有助于清除体内因胁迫导致产生的过多自由基,利于防御因逆境胁迫对赤小豆幼苗的伤害;在高胁迫环境下,保护酶系统严重被抑制,抗氧化酶系统内多种酶之间活性不平衡[13-14]。研究中,随着处理浓度增大和诱变时间延长,赤小豆M1代组织中的SOD、POD活性降低,但CAT活性却升高。表明赤小豆对高浓度的叠氮化钠伤害也能做出保护性应激反应,其中CAT起关键作用。植物中SOD、POD活性随胁迫的增强表现为先增大后降低,这符合植物应对胁迫反应的特征。即当植物面对胁迫时,会通过各种机制提高抗性以适应生长环境,但当胁迫超过植物可以耐受极限时,植物的防御机制就会损伤、甚至死亡。
佟星等研究发现,EMS浓度为0.9%,处理时间为24 h时,京农6号小豆M1代叶形变异突出,有鸡爪叶、剑叶、肾形叶等[15]。本研究发现,叠氮化钠处理也会使赤小豆叶形发生改变。叠氮化钠处理后赤小豆M1代叶片发生皱缩,甚至残缺,且叠氮化钠浓度越高,赤小豆残缺越明显。

