混合现实技术联合达芬奇机器人在完全内生型肾肿瘤行肾部分切除术中的临床应用
武鹏 杨晓剑 王延柱 孟平 张龙龙 杨波 田春娟 袁建林
1空军军医大学西京医院泌尿外科 710032 西安
近年来,随着“精准医疗”概念的提出,对患者实施精准外科手术越来越受到重视。机器人辅助腹腔镜肾部分切除术(robot-assisted laparoscopic partial nephrectomy, RALPN)在肿瘤的精准切除、肾功能保护及围手术期并发症的防控等方面取得了良好的效果[1]。完全内生型肾肿瘤(totally intrarenal tumors, TIT)由于无法在肾脏表面观察到,且常与肾门血管、集合系统邻近,临床上对这类患者的治疗是一个巨大的挑战[2, 3]。能否顺利完成这类复杂的保留肾单位手术(nephron sparing surgery, NSS),同时最大限度减少术后并发症,都是急需解决的难题[4]。借助于混合现实技术(mixed reality, MR),将患者的影像资料转化为全息数字的虚拟脏器,清晰显示肾脏的内部结构,提供分拆、交互、测量分析功能的辅助,模拟优化手术方案,帮助医生更加精确地规划手术切除范围,最大程度保留正常肾组织。我院通过采用MR联合实施RALPN,使完全内生型肾肿瘤手术难度明显降低,应用此方法治疗15例患者取得满意效果,现报告如下。
1 资料与方法
1.1 临床资料
2017年4月~2018年3月我院采用混合现实技术+RALPN为15例完全内生型肾肿瘤患者实施了NSS。对完全内生型肾肿瘤的定义为:肿瘤没有突出肾脏表面,位置较深,并被正常肾脏实质包绕。本组患者中13例为查体或常规体检行影像学检查发现肾脏肿瘤,无相关临床症状,2例因一过性肉眼血尿就诊检查发现肿瘤。其中男10例,女5例,中位年龄57(42~76)岁,中位BMI 27.6 kg/m2,术前行CT证实瘤体完全位于肾实质内(图1)。应用R.E.N.A.L.评分系统对肾脏肿瘤的复杂程度进行评分,本组低度复杂(4~6分)2例,中度复杂(7~9分)7例,高度复杂(10~12分)6例。左肾肿瘤9例,右肾肿瘤6例。肿瘤位置:7例瘤体位于肾门偏腹侧,8例瘤体位于肾门偏背侧,根据肿瘤的位置选择手术入路。肿瘤平均直径3.2(2.3~4.8)cm。术前患者肌酐水平均正常。
术前患者需要做1~2 mm层厚的全肾CTA,集合系统分析需行CTU。将采集的患者CT影像资料使用星图三维影像工作站数字建模,形成全息虚拟3D影像(图2)。数字模型能清晰显示肿瘤与肾门血管、集合系统的毗邻关系,通过虚拟现实模型对肿瘤血供、毗邻关系、切除路径及范围进行规划。肿瘤位于肾血管后方可选择腹膜后入路,肿瘤位于血管前方可选择经腹入路。
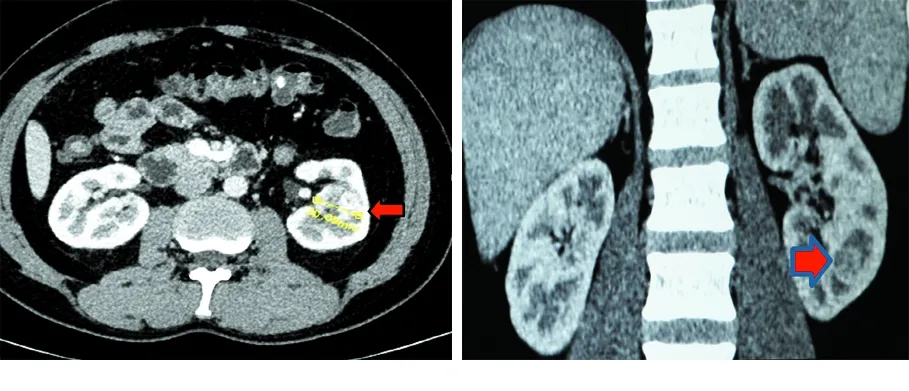
图1 完全内生型肾肿瘤CT图像
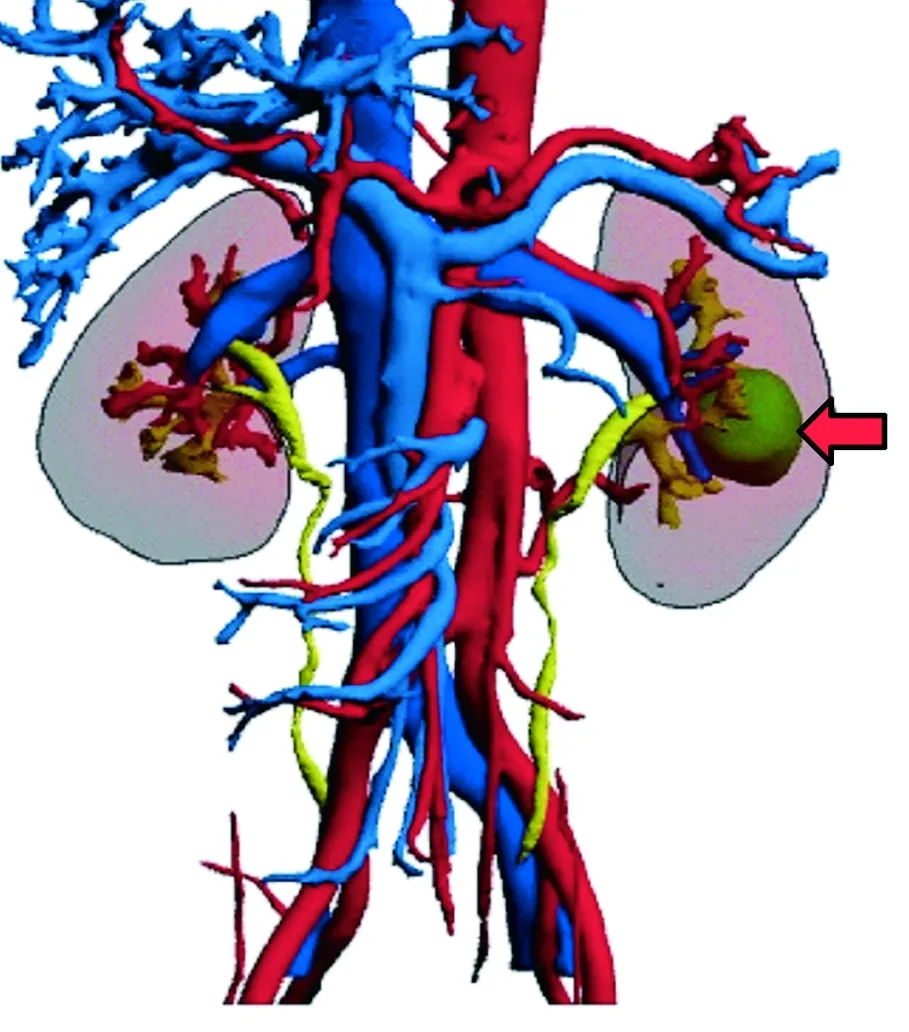
图2 数字化虚拟3D肾脏
初步制定手术方案后利用VR眼镜,观看数据重建模型,医生对患者及家属讲解手术方案,使家属直观了解手术过程及难点,促进患者与家属对手术必要性、过程及风险的理解,使医患沟通交流更加顺利流畅。
1.2 手术方法
气管插管全身麻醉,经后腹腔入路体位取健侧卧位,腰部抬高。建立通道及连接机械臂(图3):于患侧腋中线髂嵴上方2横指处切开皮肤1.5 cm,置入12 mm Trocar,作为镜头孔,置入气囊扩张腹膜后间隙。直视下于腋后线及腋前线12肋下分别置入8 mm Trocar,作为1和2臂通道,连接机械臂。腹侧Trocar置入在直视下进行,避免损伤腹膜,引起腹膜破裂。辅助孔位置在腹侧操作臂斜下方4 cm。经腹入路体位采用健侧70°斜卧位,腰部抬高。
手术过程:①标记血管:充分游离肾动脉、肾静脉及输尿管,使用血管吊带分别提起标记;②术中实时导航:将数字重建3D影像导入机器人手术系统,与手术图像实时显示,使术中真实场景与全息虚拟肾脏解剖模型相融合(图4),指导肿瘤的定位及切除;③血管阻断:根据肿瘤定位,超选择阻断肿瘤血管;④肿瘤精准切除:选择距离肿瘤最近的肾实质切开,沿肿瘤包膜建立操作平面剜除肿瘤;⑤术中超声辅助定位:使用腹腔镜超声准确定位肿瘤边界,探查血管走形及卫星灶,减少术中血管损伤及出血;⑥创面缝合:一般创面采用双层缝合。第一层缝合血管残端+破损肾盂+底部创面,可用4-0可吸收线连续缝合,严密缝合后松开血管夹,开放循环;第二层缝合使用2-0倒刺线行创面对合缝合,针对肾蒂血管裸露或靠近肾门无法闭合,采取裙边缝合方法或“V”形缝合技术;⑦解剖复位:肾脏缝合完毕后,将肾周脂肪囊缝合关闭,防止肾下垂。
1.3 随访
患者在术后4~6周进行第一次复查,主要评估肾脏形态及功能、术后恢复情况以及有无手术并发症。半年内每3个月复查1次血常规,肝、肾功能和腹部B超;术后每半年复查腹部CT、胸片等。
2 结果
15例患者均顺利完成手术,无中转开放及因出血改行肾切除术病例。平均手术时间为122 min(67~211 min),术中平均出血量为78 ml(48~480 ml)。其中经后腹腔途径10例,经腹腔途径5例,未出现一例大血管损伤,术中行肾盂修补6例。肾动脉平均阻断时间21 min(15~42 min)。本组患者肿瘤分期:T1a期11例,T1b期4例。病理诊断:透明细胞癌13例,乳头状肾癌1例,囊性肾细胞肿瘤1例,均无切缘阳性。术后无漏尿、需行栓塞治疗的延迟出血。平均随访9个月(3~14个月),未出现局部复发及转移病例。术后复查肾功能正常。

图4 数字模型与术中机器人图像融合
3 讨论
由于大多数完全内生型肾肿瘤的体积较小,选择行NSS可以在彻底切除肿瘤的同时,达到最大限度保留肾脏功能、降低慢性肾病(chronic kidney disease, CKD)发生的目的。随着机器人技术的发展,肾部分切除术(partial nephrectomy, PN)取得了巨大的进步,且手术适应证也在不断拓展[5, 6]。技术娴熟的术者对特定的多发肾肿瘤、T1b期肿瘤、内生型、肾门部肿瘤以及肾功能不全或孤立肾患者手术可取得良好的效果[7],更证实了达芬奇机器人手术系统在完成高难度复杂肾部分切除术的优势。
一直以来,完全内生型肾肿瘤因其位置过深,在肾实质表面观察不到肿瘤的位置与边界,采用开放手术或传统腹腔镜行NSS是巨大的挑战[8]。手术难点在于:①肿瘤定位困难:完全内生型肾肿瘤位置深,周围包绕正常肾组织,术中难以直接观察,寻找困难。术中准确的定位不仅节省手术时间,而且减少出血量及热缺血时间,是手术成功的关键因素之一。②肿瘤邻近肾血管,出血风险高:一般认为完全内生型肾肿瘤是肾门部肿瘤的亚型,在解剖上紧邻肾动脉、静脉,发生术中大血管损伤甚至被迫切除肾脏及术后延迟出血的风险较高。③肿瘤邻近集合系统,操作困难,漏尿风险高:肿瘤切除后形成的创面较深,形状不规则,对缝合技术要求高,肾盂修补及闭合创面困难,即使开放手术也有较高难度。本组患者中有6例肾肿瘤距离肾蒂或集合系统小于5 mm,其R. E. N. A. L.评分为高度复杂(10~12分),手术风险也相应增加。
对于完全内生型肾肿瘤的精确定位,国内外学者应用不同方式进行了诸多探索。Furukawa等[9]应用实时三维导航系统TileproTM,利于导航系统与手术操作台相整合,将2D图像转换成3D模型,有助于肿瘤的定位和切除。Chen等[10]通过术前CT影像,运用Mimics 12.1系统进行3D重建,得到的3D模型可以显示肿瘤的位置、与周围血管、集合系统的关系及肿瘤浸润深度。多项研究采用3D打印技术重建患肾模型,直观呈现肿瘤局部解剖结构,精细实施NSS[11, 12]。目前混合现实技术是影像学技术新的突破,既包括增强现实,也包括虚拟现实。该技术通过在现实场景中引入虚拟信息,从而产生新的可视化环境,达到实物和数字对象共存,并实时互动。混合现实技术使手术治疗的各个环节实现精准外科的理念,体现在:①清晰、直观的数字化显示,全面量化脏器解剖结构,使影像资料从2维平面升级到3维立体,精准定位出病灶的位置及病灶与周围血管、集合系统的空间毗邻关系,深度挖掘数据信息;②通过交互式的虚拟模型规划手术,术中真实场景与虚拟解剖模型融合,使有效的影像数据在手术过程中全面呈现并被利用。临床医生可根据手术需要,任意调整手术切割面,进而有效地进行手术方案优化,提升手术安全性,降低手术过程中可能存在的潜在风险,使患者获得最佳的治疗效果;③增进术前与患者及家属的有效沟通,提供“看得见、说得清、道得明”的帮助,改进医患关系。
腹腔镜超声对于完全内生型肾肿瘤的术中定位具有重要价值,不仅可以实时辨别肿瘤边界,而且能够帮助判断肿瘤卫星灶及血管瘤栓[13, 14],降低复杂肾脏肿瘤行NSS的手术难度。国外学者Gill等[15, 16]回顾分析了76例肾部分切除术中使用腹腔镜超声的结果,认为术中超声定位对帮助决定手术切除范围发挥重要作用,达到手术“三连胜”:切缘阴性,无围手术期并发症,保护肾功能[17]。Rogers等[18]报道术中超声联合达芬奇机器人可以减少血管损伤,保护肾功能。术中超声还可以通过辨认血流信号,判断是否存在分支血管,以降低术中动脉出血的风险。Chung等[19]提倡边切除肿瘤边对肿瘤边界进行超声定位,可以最大限度减少血管及集合系统损伤。肿瘤的切除范围,至少要求保证假包膜完整。对肉眼观察切缘有完整正常肾组织包裹的病例,术中无需常规行冷冻病理检查。对于呈浸润性生长或多足状肾肿瘤,可以使用术中超声帮助判断肿瘤界限,切缘适当远离假包膜。Di Pierro等[20]报道了一组内生型肾肿瘤患者切缘阳性率为9.1%。Nadu等[8]比较了腹腔镜肾部分切除术治疗内生型肾肿瘤和外周型肾肿瘤的术后切缘阳性率差异无统计学意义。本组患者使用混合现实影像技术与术中超声相结合,精确定位及判断肿瘤边界,降低了出血的风险,且无一例切缘阳性。
肿瘤切除路径的选择是完全内生型肾肿瘤的手术难点。肾蒂腹侧肿瘤采取经腹入路,阻断血管时可同时阻断肾动脉及肾静脉,减少创面渗血。由于肾静脉壁较薄,游离时需仔细分离,避免损伤。肾蒂背侧肿瘤采取经后腹腔入路,注意保护肾盂后动脉,可先将其游离标记,必要时可切断[21, 22]。对于小体积完全内生型肿瘤,可选择距离肿瘤最近的肾实质切开,并沿肿瘤包膜建立操作空间剜除肿瘤。对于跨越背腹两侧的大体积肿瘤,可以直接通过Brodel线纵行切开肾实质,减少叶间血管直接损伤,完整剥除肿瘤,并且易于重建肾脏。我们在切除肿瘤的过程中,采取“边切边止血”的策略,缝扎较大破损血管,使手术视野更加清晰,出血量明显减少。
肾脏创面的有效缝合是防止围手术期大出血的关键步骤。根据创面大小和形状选择一层或多层缝合,在血管断端及创面底部严密缝合后,松开阻断夹,开放循环,减少热缺血时间。对于肾脏创面大、闭合困难或肾门血管裸露,可以采取“裙边缝合”技术,将止血纱布填塞固定于创面空腔内,有效压迫肾静脉属支出血。缝合时进针方向由内向外,避免刺破血管。运用上述技术,本组无一例患者需输血或行血管栓塞治疗。机器人手术较开放和腹腔镜方式相比,具有缝合操作上的优势,可以缩短热缺血时间。本组患者通过采取分层缝合、早期松开阻断夹技术,平均热缺血时间仅为21 min,与国内外文献报道相比,热缺血时间均明显缩短。
综上所述,充分的术前评估、精确的术中定位、术者经验及深部缝合技术是完全内生型肾肿瘤手术成功的关键因素。应用混合现实技术联合机器人手术系统治疗完全内生型肾肿瘤,在肿瘤定位及手术安全性方面优势明显,可以明显降低手术难度。

