响应面法优化超高压辅助提取紫薯花色苷的工艺研究
陈亚利,严成,张唯,陈烨,杨雁
(西南科技大学 生命科学与工程学院,四川 绵阳 621010)
紫薯(IpomoeabatatasPoir.),又称黑薯、乌心苕等,培育最早起源于日本。因其产量高、适应性强,我国于20世纪90年代从日本引种栽植[1]。紫薯富含花色苷,其具有药用价值及保健功能,如提高人体免疫力、抗肿瘤、抗衰老及预防和治疗高血压等功效[2-6],故一直被人们所重视。同时,花色苷又是天然的水溶性色素,因其无毒无害,且相比其他色素更稳定,故一直被作为食用类色素添加到食品中。从现有的报道中可知,对紫薯花色苷的研究多集中在提取及结构鉴定方面[7-11],常见的提取方法主要有溶剂法[12,13]、超声波辅助提取法[14-16]、微波辅助提取法[17]、酶法等,其普遍具有耗时耗能的特点。超高压技术作为食品行业中非热加工技术,近些年,在物质有效成分提取方面有所应用,因其与传统提取方法相比,具有能耗低、提取时间短、作用温度低等特点而深受重视,但在紫薯花色苷的提取方面鲜有报道,故本文选用此法。以紫薯粉为原料提取花色苷,采用响应面分析法优化提取工艺,分析提取剂浓度、料液比、压力值、保压时间等因素对花色苷得率的影响,以期为超高压技术在紫薯花色苷提取方面的深入研究提供理论依据。
1 材料与方法
1.1 材料与仪器
紫薯:2017年10月由四川省剑阁县成一食品有限公司种植基地提供。
柠檬酸等试剂:均为分析纯。
BSA224S 电子天平 赛多利斯科学仪器有限公司;D2-280/2SE 小型真空封装机 东莞市益健包装机械有限公司;多功能粉碎机 浙江瑞安市永历制药机械有限公司;电热恒温干燥箱 上海三发科学仪器有限公司;HPP.L2-800/1 超高压设备 天津华泰森淼生物工程技术股份有限公司;UV-3150紫外-可见光分光光度计 日本岛津公司;台式离心机 天津广丰科技有限公司。
1.2 试验方法
1.2.1 原材料预处理
挑选新鲜、无病虫害的紫薯清洗,去皮,切片,在50 ℃电热恒温干燥箱烘干,粉碎,过80目筛,置于棕色试剂瓶中,于4 ℃冰箱保存,备用。
1.2.2 超高压提取条件
超高压设备的有效体积为1 L,最高压力值为700 MPa,癸二酸二辛酯为传压介质,升压速率为100 MPa/15 s,油温22 ℃,保压过程中压力差不超过10 MPa,解压时间10 s。
1.2.3 花色苷最大吸收波长的确定
准确称取紫薯粉1.00 g,置于聚乙烯袋中,按照料液比1∶30(g/mL)加入30 mL提取溶剂(1%柠檬酸溶液),真空包装,于300 MPa条件下提取5 min,得到紫薯花色苷粗提液,吸取少量上清液离心,取上清液稀释适当倍数,在300~600 nm下进行光谱扫描,以获得最大吸收波长。
1.2.4 总花色苷含量的计算
采用消光系数法,按照下式计算花色苷的含量(本文又称得率):
总花色苷含量(mg/100 g)=(A×V×n)/(m×98.2)×100。
式中:A为吸光度;V为提取液体积;n为稀释倍数;m为样品质量;98.2为紫薯色素的摩尔消光系数,在进行对比实验时实验中产生的误差可以忽略掉。
1.2.5 超高压辅助提取方法
准确称取处理后的紫薯粉1.00 g,置于聚乙烯袋中,在室温下按照设定的料液比、压力值、保压时间等,使用不同浓度的柠檬酸水溶液作为提取剂提取花色苷,离心,取上清液稀释一定的倍数,在526 nm波长下测定其吸光值,重复3次求平均值,依据1.2.4中公式计算紫薯中花色苷的得率。
1.2.6 溶剂提取方法
根据预实验正交结果,按料液比1∶30(g/mL)取一定量的紫薯粉,加入2.0%的柠檬酸溶液,在60 ℃下提取2 h,离心,测定吸光值,按1.2.4中公式计算紫薯中花色苷的得率。
1.2.7 单因素试验
分别以不同浓度柠檬酸水溶液(0.20%,0.40%,0.60%,0.80%,1.00%,1.20%,1.60%,1.80%,2.00%)、料液比(1∶10,1∶20,1∶30,1∶40,1∶50)、提取压力(100,150,200,250,300,400,500 MPa)、保压时间(1,3,5,7,10 min)为自变量,以花色苷提取得率为考量值,通过控制变量法,进行单因素试验,确定响应面分析法各个因素的取值范围。
1.2.8 响应面法优化超高压提取法
根据单因素试验结果确定的各个因素的零水平和波动区,以花色苷的得率为响应值,运用Design-Expert 8.0.6.1软件建立4因素3水平Box-Behnken中心组合试验,试验因素与水平取值见表1。

表1 响应面实验因素与水平编码表Table 1 The factors and levels of response surface experiment
1.2.9 数据统计与分析
应用统计软件Design-Expert 8.0.6.1和Origin 8.5进行数据处理和分析。
2 结果与分析
2.1 最大吸收波长的选择
按照1.2.3的提取方法,在300~600 nm波长范围内扫描紫薯花色苷色素粗提液,测定粗提液的光谱吸收特性,结果见图1。紫薯色素粗提液在526 nm处有最大吸收,查阅文献[19]可知,在520~540 nm有1个吸收峰,为典型的花色苷色谱特性,因此选526 nm为测定紫薯花色苷含量的检测波长。
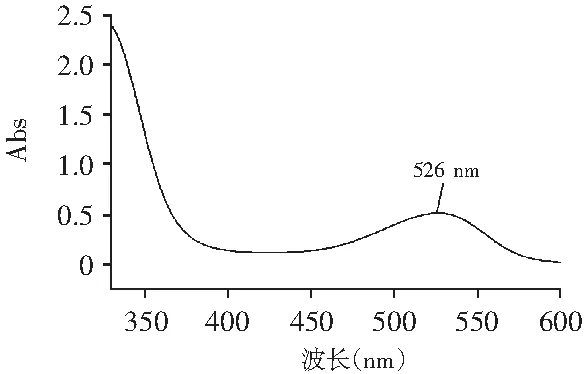
图1 紫薯花色苷紫外-可见光扫描图谱Fig.1 UV-visible light scanning spectrum ofpurple potato anthocyanins
2.2 单因素试验结果
2.2.1 提取剂浓度对紫薯花色苷得率的影响
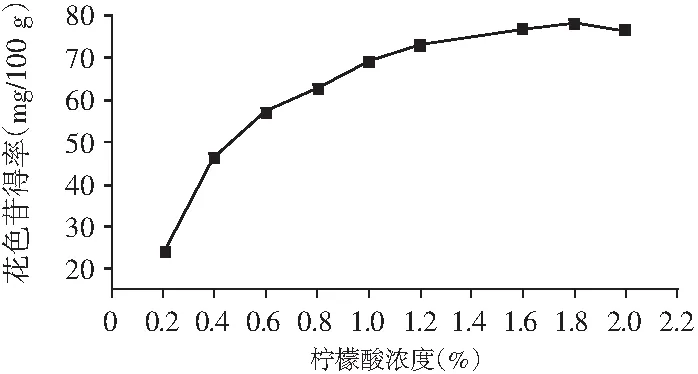
图2 柠檬酸水溶液浓度对花色苷得率的影响Fig.2 Effect of different concentration of citric acid solution on the yield of anthocyanins
由图2可知,柠檬酸浓度为1.8%时提取效果最好,浓度小于1.8%时,随着柠檬酸浓度的增大,提取效率增加;浓度大于1.8%时,提取效率呈下降趋势,这一变化与花色苷糖基在酸性条件下的稳定性有关。当浓度过大时,花色苷酰基化结构会遭到破坏,导致提取率降低。此外提取剂浓度过大,增加了后续脱味处理的难度,所以选择柠檬酸溶液浓度1.8%为花色苷的最佳提取浓度。
2.2.2 压力值对紫薯花色苷含量的影响

图3 压力值对花色苷得率的影响Fig.3 Effect of different pressure values on the yield of anthocyanins
由图3可知,花色苷的得率在压力值为100~250 MPa间,随着压力的增加而增加,在250 MPa时达到峰值,随后呈现下降的趋势。这可能是由于在加压提取过程中,升压增加了提取剂固体组织的渗透速率,细胞膜和细胞壁被破坏的数量增加,提取剂和组织接触的面积增大,使得有效成分的溶解更加完全[20]。下降的原因可能是压力过大使花色苷有效成分受到破坏,故选择250 MPa进行下一步试验。
2.2.3 保压时间对紫薯花色苷含量的影响

图4 保压时间对花色苷得率的影响Fig.4 Effect of different dwell time on the yield of anthocyanins
由图4可知,0~5 min花色苷的得率随着保压时间的延长而增加,在5 min时达到最大值,之后开始下降,原因可能是在高压状态下,有效成分快速扩散到溶剂中达到了一个平衡,过了这个临界点有效成分受到破环,从而降低了提取效果,故选择5 min为最佳保压时间进行后续试验。
2.2.4 料液比对紫薯花色苷含量的影响

图5 料液比对花色苷得率的影响Fig.5 Effect of different solid-liquid ratios on the yield of anthocyanins
由图5可知,随着料液比的增加,花色苷的得率呈现出先增加后降低的趋势。料液比在1∶10~1∶30(g/mL)之间,花色苷的得率都呈现上升趋势,原因是适当增加提取剂的用量,能够更好地促使花色苷的溶出,从而提高得率[21]。当料液比为1∶30(g/mL)时,花色苷的得率最大,之后随着料液比继续增加,提取率略有下降。因此,选取1∶30为最佳的料液比。
2.3 响应面试验结果与分析
2.3.1 响应面试验设计
根据上述单因素试验结果,建立4因素3水平Box-Behnken中心组合试验,试验设计与结果见表2。

表2 响应面试验设计与结果Table 2 Exprimental design and results of response surface analysis
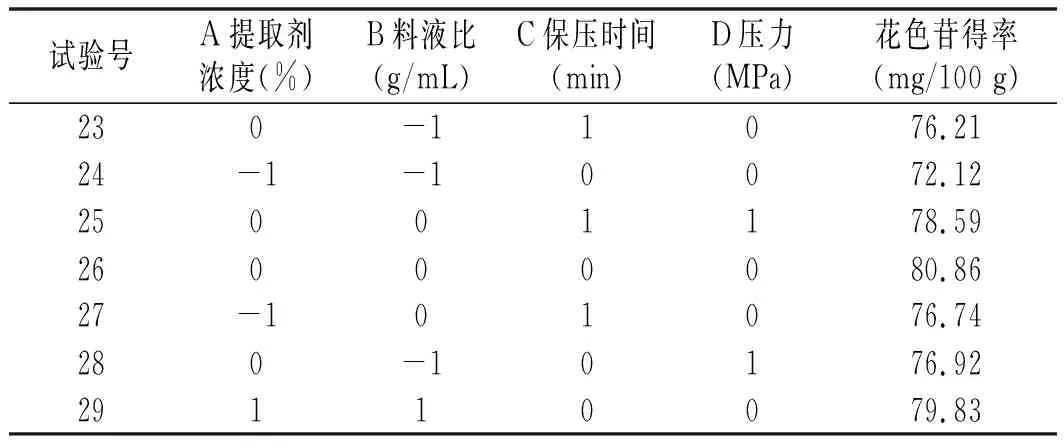
续 表
采用Design-Expert 8.0.6 统计软件对表2中试验数据进行回归拟合分析,得到提取剂浓度、料液比、保压时间和压力4个因素的二次多项回归方程为:Y=80.33+1.23A+2.81B-0.44C+0.30D-0.99AB-0.28AC-0.80AD-1.76BC-1.62BD-0.14CD-1.74A2-1.71B2-0.6C2-0.91D2。
式中:Y为花色苷得率的预测值;A,B,C,D分别代表提取剂浓度、料液比、保压时间、压力的编码值,为了说明模型的可行性,对回归方程进行方差分析,结果见表3。
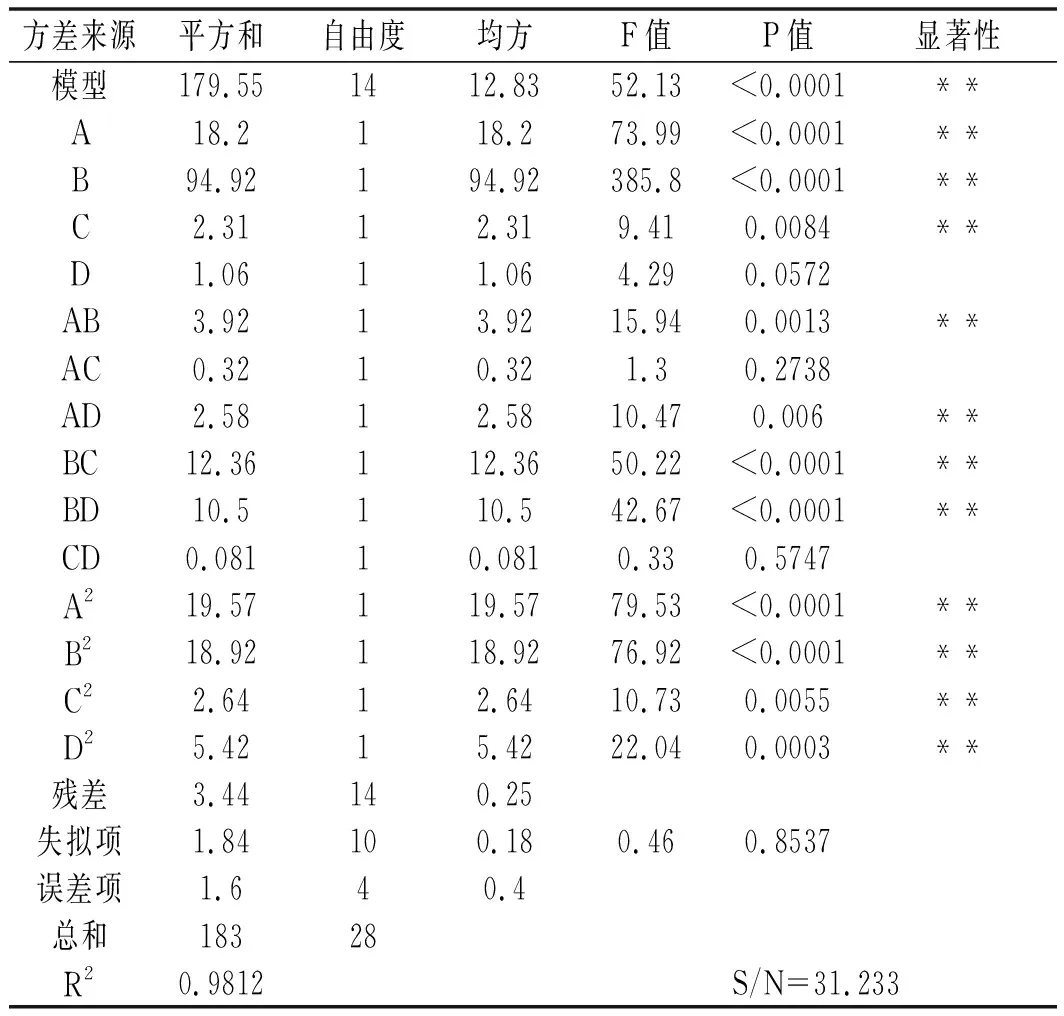
表3 回归方程方差分析Table 3 Analysis of variances for the developed regression equation
由表3可知,模型的P<0.0001,说明回归模型差异极显著。模型的失拟项检验差异不显著(P>0.05),信噪比(S/N=31.233)大于4,可知回归方程有极好的拟合度和可信度,能反映出提取剂浓度、料液比、保压时间和压力值与花色苷得率之间的关系。
模型的决定系数 R2= 0.9812(R2>0.8000),表明该模型可以解释98.12%响应值的变化,即样本数据对模型回归方程的拟合性较高,该模型的选择是合理的,故此模型可用作对紫薯花色苷提取结果进行分析预测。
此模型中 A,B,C,AB,AD,BC,BD,A2,B2,C2,D2为差异极显著项(P<0.01),其他项差异均不显著。B的F值最大,其次是A和C,D相对较小,表明4个因素对花色苷得率的影响大小顺序为B>A>C>D,即料液比>提取剂浓度>保压时间>压力。
通过交互作用分析,AB,AD,BC,BD项有显著交互作用,即提取剂浓度和料液比、提取剂浓度和压力、料液比和保压时间、料液比和压力存在显著交互作用,对两组因素进行响应面分析,考察因素间的交互规律。
通过响应面软件最优组合分析得到花色苷提取的最佳工艺条件为:提取剂浓度2.0%、料液比1∶40、保压时间3 min、压力值200 MPa。
2.3.2 各因素之间交互作用

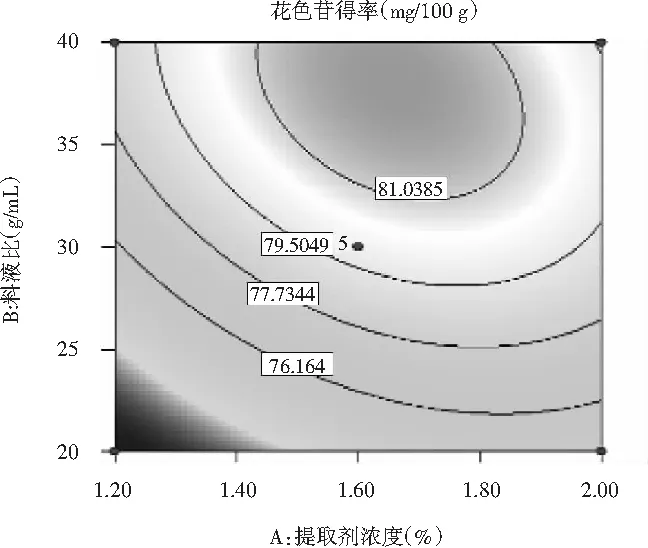
图6 提取剂浓度和料液比对花色苷得率影响的响应面Fig.6 Response surface of extractant concentration and solid-liquid ratio on the yield of anthocyanins
由图6可知,提取剂浓度与料液比之间的交互作用,等高线呈椭圆形,提取剂浓度与料液比对花色苷得率影响的交互作用极显著(P<0.0001),提取剂浓度一定时,随着料液比的增加,花色苷的得率呈先上升后下降的趋势;料液比一定时,随着提取剂浓度的增加,花色苷的得率先上升后下降。
提取剂浓度与压力之间的交互作用见图7。

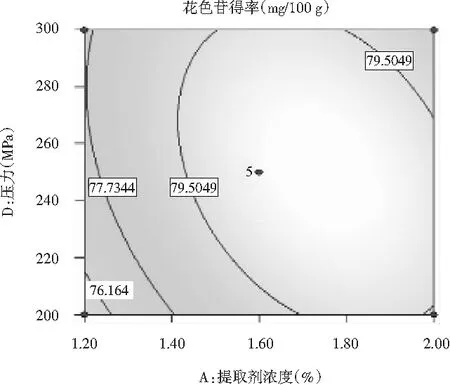
图7提取剂浓度与压力对花色苷得率影响的响应面Fig.7 Response surface of extractant concentration and pressure on the yield of anthocyanins
等高线呈椭圆形,提取剂浓度与压力对花色苷得率影响的交互作用极显著(P<0.0060),提取剂浓度一定时,随着压力的增加,花色苷的得率呈先上升后下降的趋势;压力一定时,随着提取剂浓度的增加,花色苷的得率先上升后下降,但总的变化较小。
料液比与保压时间之间的交互作用见图8。
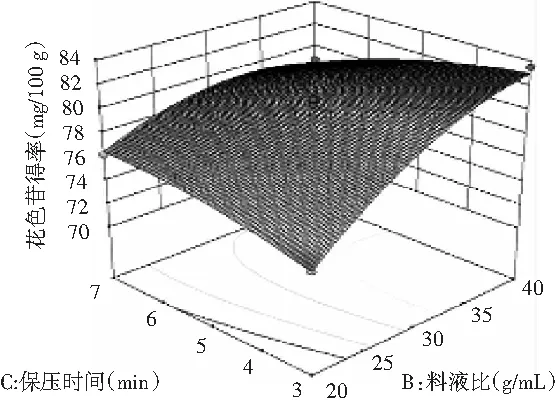
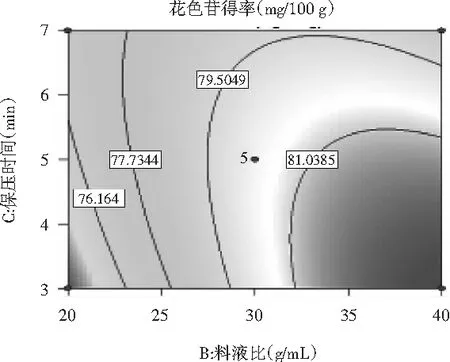
图8 料液比与保压时间对花色苷得率影响的响应面Fig.8 Response surface of solid-liquid ratio and dwell time on the yield of anthocyanins
等高线呈椭圆形,料液比与保压时间对花色苷得率影响的交互作用极显著(P<0.0001),保压时间一定时,随着料液比的增加,花色苷的得率呈一直增加的趋势;料液比一定时,随着保压时间的增加,花色苷的得率先上升后下降,说明料液比对花色苷得率的影响比保压时间的影响更大。
料液比与压力值之间的交互作用见图9。

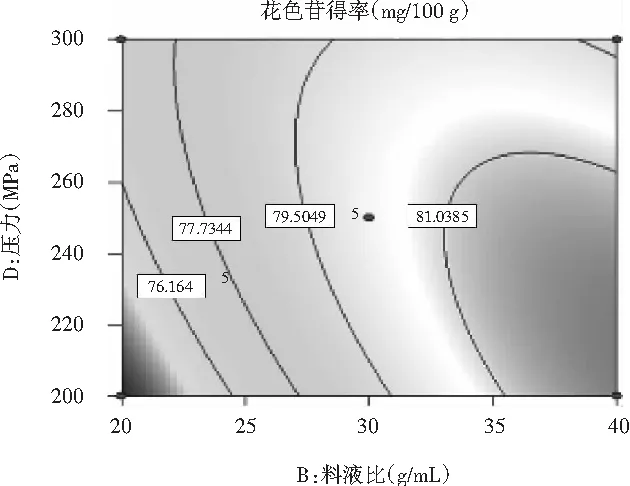
图9 料液比与压力值对花色苷得率影响的响应面Fig.9 Response surface of solid-liquid ratio and pressure on the yield of anthocyanins
等高线呈椭圆形,料液比与压力值之间的交互作用对花色苷得率影响的交互作用极显著(P<0.0001),压力一定时,随着料液比的增加,花色苷的得率呈增加的趋势;料液比一定时,随着压力的增加,花色苷的得率先上升后下降,料液比对花色苷得率的影响比压力值的影响更显著。
2.4 验证性试验
为验证响应面所得结果的可靠性,根据 Design Expert 软件,预测出花色苷提取的最佳工艺条件:提取剂浓度为2.0%,料液比为1∶40,保压时间为3 min,压力值为200 MPa,并对其进行验证,经过3次平行试验后,得到花色苷的含量为82.67 mg/100 g,与理论值接近(82.85 mg/100 g),误差较小。故用响应面法分析优化得到的花色苷提取条件与实际拟合较好,具有可靠性和实用价值。
2.5 超高压辅助法提取与溶剂提取法的对比
超高压辅助法提取与溶剂提取法的对比结果见表4。

表4 两种方法比较Table 4 Comparison of two methods
由表4可知,超高压辅助提取法不仅提取温度要求低且耗时短,提取效果也高于溶剂提取法。
3 结论
超高压辅助提取紫薯花色苷,具有作用温度低、耗时短、得率高的特点,对于花色苷的提取是一种不错的选择。采用响应面法对紫薯花色苷超高压辅助提取工艺进行优化,根据响应面模型得出的最佳工艺条件为提取剂浓度2.0%,料液比1∶40,保压时间3 min,压力值200 MPa,花色苷含量82.85 mg/100 g,验证得到花色苷的含量为82.67 mg/100 g,与预测值十分接近;从三维图及等高线图可以看出,各因素间的交互作用对花色苷提取得率的影响较大。综上,响应面法能对花色苷提取工艺进行较好的优化。此外,为更好地将超高压技术应用到活性物质的提取中,还应进行超高压对各因素影响的研究,这也是本实验的不足之处,故后续还需开展此方面的研究。

