与子代先心病相关的孕前女性同型半胱氨酸风险值研究
石慧,杨世伟,孙晓如,姜志欣,王丽娟,程学英,黄丽丽,陈伟, 王参军,吴玉璘,许豪勤,林宁
(1.江苏省生殖健康检验中心/江苏省计划生育科学技术研究所 实验筛检中心, 江苏 南京 210036; 2.南京市儿童医院 心内科,江苏 南京 210008; 3.东南大学附属中大医院检验科,江苏 南京 210009)
1 对象与方法
1.1 研究对象
选取2015年11月至2016年9月南京市儿童医院确诊的180例先心病患儿的母亲为病例组,平均年龄(29.39±4.59)岁,先心病患儿平均年龄(4.36±2.95)岁;选取180例子代为正常儿童的母亲为对照组,平均年龄(27.86±2.86)岁,对照组儿童平均年龄(5.14±3.39)岁。两组研究对象排除先心病、高血压、糖尿病、肿瘤等疾病,对360例研究对象血清中HCY、叶酸和VB12浓度进行检测。所有研究对象均签署知情同意书。
1.2 方法
1.2.1 HCY检测 采集研究对象静脉血,EDTA抗凝,及时分离血浆,使用贝克曼全自动生化分析仪、采用循环酶法进行检测。
1.2.2 叶酸、VB12检测 静脉采集全血,分离血清。使用UnicelTM DxI 800全自动化学发光免疫分析仪进行检测。
1.3 统计学处理
采用SPSS 20.0统计软件进行统计分析。两组间HCY、叶酸、VB12浓度比较采用t检验,组间差异有统计学意义者再进一步两两比较。以不同HCY检测值为临界值,计算其敏感度、特异性、阳性似然比和受试者工作特征曲线(ROC曲线)下的面积(area under the curve,AUC),并进行比较分析。双侧检验P<0.05为差异具有统计学意义。
2 结 果
2.1 HCY检测结果
病例组平均HCY浓度为(10.48±3.34)μmol·L-1,对照组为(8.48±2.53)μmol·L-1,两组差异有统计学意义(t=6.39,P<0.05)。
2.2 绘制ROC曲线制定与子代先心病相关的母亲HCY风险值
非孕期妇女不同HCY临界值时诊断子代先心病的效率见表1。当HCY诊断临界值为8.9 μmol·L-1时,AUC最大,为0.714(图1),此时敏感度为70.00%, 特异性为65.00%,阳性似然比为2.00。
表1非孕期妇女不同HCY临界值时诊断子代先心病的效率
Tab1DiagnosisefficiencyofoffspringCHDwithdifferentHCYcriticalvaluesinnonpregnantwomen
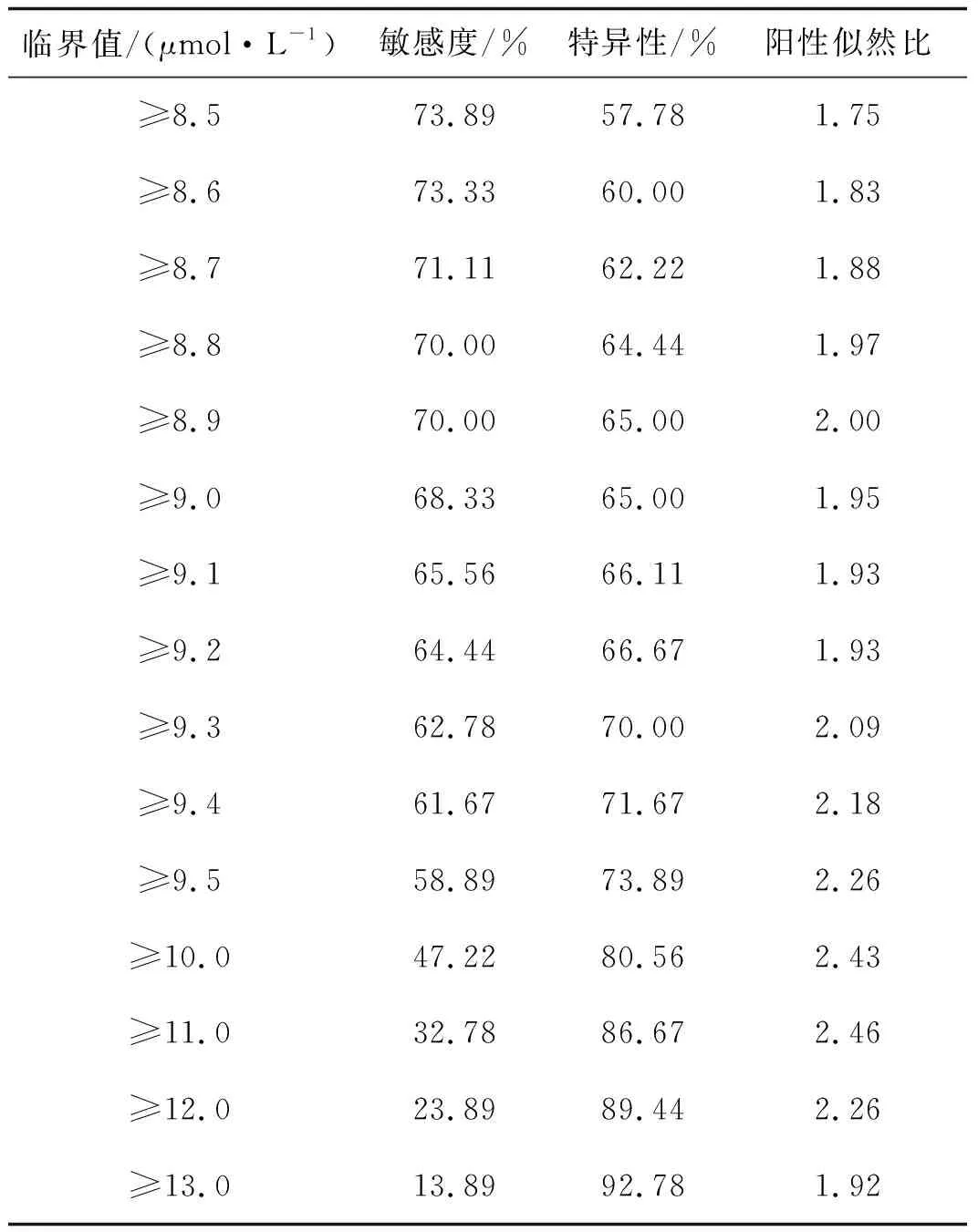
临界值/(μmol·L-1)敏感度/%特异性/%阳性似然比≥8.573.8957.781.75≥8.673.3360.001.83≥8.771.1162.221.88≥8.870.0064.441.97≥8.970.0065.002.00≥9.068.3365.001.95≥9.165.5666.111.93≥9.264.4466.671.93≥9.362.7870.002.09≥9.461.6771.672.18≥9.558.8973.892.26≥10.047.2280.562.43≥11.032.7886.672.46≥12.023.8989.442.26≥13.013.8992.781.92
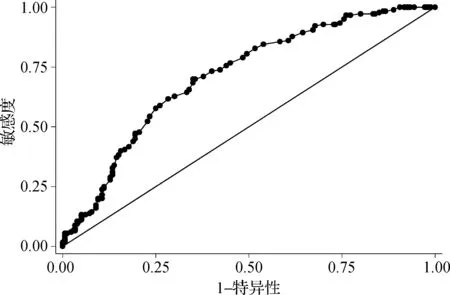
图1与子代先心病相关的母亲HCY的ROC曲线图
Fig1ROCcurveofmaternalHCYrelatedtooffspringCHD
2.3 血清中叶酸、VB12的检测结果
病例组平均叶酸浓度为(9.81±4.02)nmoL·L-1,对照组为(10.48±3.96)nmoL·L-1,两组差异无统计学意义(t=1.17,P>0.05)。病例组平均VB12浓度为(124.6±12.59)μmol·L-1,对照组为(129.1±12.97)μmol·L-1,两组差异也无统计学意义(t=-1.33,P>0.05)。
3 讨 论
先心病是胎儿时期心血管系统发育异常而致的先天畸形。我国出生缺陷监测中心数据显示,先心病的发病率呈逐年上升趋势。自2005年起,先心病始终居出生缺陷发生率的首位,同时也是5岁以下儿童死亡的主要原因之一。目前认为先心病是由遗传因素和环境因素共同作用形成的[2]。

HCY的主要检测方法包括循环酶法、高效液相色谱法、化学发光法、酶联免疫分析法等等,临床常用循环酶法。目前比较公认的成人HCY参考范围是5~15 μmol·L-1,其中>15 μmol·L-1被认为是HHcy。 而我们前期研究发现,先心病患儿的母亲HCY浓度均低于该标准[13]。国外也有报道称正常非妊娠、哺乳期健康妇女外周血HCY浓度为5.8~12.8 μmol·L-1,在妊娠过程中,可能由于血浆容量增多、母胎两者对蛋氨酸的需求增加等,HCY浓度会更低[14]。由此可见,目前临床常用的参考范围用于诊断育龄妇女高同型半胱氨酸血症可能并不合适,所以本项研究的目的是针对生育愿望较集中的35岁以下育龄期妇女,确立与先心病相关的非孕期同型半胱氨酸的风险值。
我们选取了先心病患儿母亲和生育无出生缺陷儿童母亲各180例,检测HCY浓度分别为(10.48±3.34)μmol·L-1和(8.48±2.53)μmol·L-1,两者差异有统计学意义(P<0.05)。同时我们用ROC曲线进行分析发现,当HCY诊断临界值为8.9 μmol·L-1时,AUC最大为0.714,此时敏感度为70.00%,特异性为65.00%,阳性似然比为2.00。AUC可以反映诊断实验的准确性,一般认为AUC在0.5以下时,实验没有诊断价值;在0.5~0.6时,诊断准确度较低;在0.7~ 0.9时表明诊断有一定的准确性[15]。本实验AUC为0.714,说明建立起的与子代先心病相关的母亲同型半胱氨酸风险值有一定价值。
有研究报道,叶酸与VB12的缺乏可引起体内HCY浓度的增高[12]。在本项研究中虽然没有发现病例组与对照组之间的叶酸和VB12水平有差异,但在叶酸含量中,病例组与对照组相比有降低趋势。因此,我们认为,由于这次研究的样本量较小,可能不能真实反映HCY与叶酸和VB12之间的关系,也有可能是由于HCY代谢关键酶的基因突变导致先心病患儿母亲体内HCY浓度的明显增高。所以,我们将扩大样本量,同时对HCY代谢关键酶基因的突变作进一步研究。
先心病引起儿童伤残或死亡,给家庭造成沉重的精神和经济方面的负担,是重要的公共卫生问题。我们有必要检测与先心病相关的风险指标,通过有效的优生健康检查,避免和降低危险因素的暴露。而HCY的升高,可以通过补充叶酸、维生素等方法进行调节、干预。目前我国采用补充叶酸的方法作为预防出生缺陷的手段之一,不同的个体使用相应的剂量。
总之,我们可以在孕前期或婚检时增加检测母体HCY项目,参照风险值对母体HCY水平进行评估、预警、干预,制定个性化的叶酸增补方案,调节孕前期母体内HCY水平,最大程度地降低子代先心病的患病风险,做好出生缺陷一级预防,提高出生人口质量。

