钠型Amberlite IRC-50树脂分离提取ε-聚赖氨酸的条件优化
何洪刚,李芳良,马玉,陈旭升,毛忠贵
(江南大学 生物工程学院,江苏 无锡,214122)
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由放线菌生产的次级代谢产物,由25~35个L-赖氨酸残基通过α-羧基与ε-氨基缩合形成的同型氨基酸聚合物[1],分子质量为3 200~4 500 Da。在中性和酸性水溶液环境中ε-PL呈现多聚阳离子体形式,可与微生物细胞表面相结合,对微生物细胞膜的结构造成损伤,导致微生物生长传代受阻,甚至死亡[2],从而达到抑菌作用。因此,目前ε-PL主要被用作一种天然、安全的食品防腐剂,在日本、韩国和美国的食品工业中得到广泛应用。2014年,我国也正式批准ε-PL及其盐酸盐为新的食品添加剂品种[3]。
目前ε-PL的生产只能通过微生物发酵法实现。通过近20年不断的菌种选育和发酵工艺优化,我国ε-PL发酵产量最高为54.7 g/L[4],已达到工业化生产的要求。如何实现从发酵液中高效分离ε-PL越来越受到学术界和产业界的关注。由于ε-PL具有等电点高的特性(pI=9.0),故采用阳离子交换树脂吸附提取ε-PL就成为其从发酵液中进行分离的一种有效方法。近年来,许多研究者采用具有吸附容量大、易再生的大孔弱酸阳离子交换树脂作为主要研究对象,用于ε-PL的分离和提取。刘洁萍[5]在弱酸阳离子树脂D152静态条件优化的基础上确定了动态交换的条件,最终树脂工作交换容量为77.81 g/L(湿树脂)。莫树平等[6]采用静态实验对弱酸阳离子树脂D113的解吸条件做了系统优化,在最佳解吸条件下解吸率达到96.8%。宗红等[7]通过静态吸附法在3种树脂中筛选出了适合ε-PL提取的弱酸阳离子树脂HD-2,最终使ε-PL的回收率达到92.0%,树脂静态吸附量为8.34 mg/g湿树脂。刘延岭等[8]选用弱酸阳离子树脂HD-2对超滤液进行离子交换,树脂静态吸附量为15.2 mg/g湿树脂。朱玛骁骐等[9]系统分析了弱酸阳离子交换树脂HZD-3B和D155在分离发酵液中的ε-PL时的吸附等温线和吸附动力学,通过优化该两种树脂的静态吸附条件,最终静态吸附量达到200 mg/g湿树脂以上。上述研究中所采用的树脂均为氢型弱酸阳离子树脂,该类树脂在离子交换过程中pH处于一直下降趋势,从而降低了树脂的选择性和吸附量。另外,研究者仅研究了静态条件下树脂吸附ε-PL的条件,而忽略了静态与动态实验操作条件存在着明显差异。
本研究团队在前期大量树脂筛选基础上,获得了一种适合ε-PL分离提取的大孔弱酸型离子交换树脂Amberlite IRC-50。通过将该树脂分别转型成钠型和氨型,比较了它们对ε-PL吸附与解吸的差异分析,确定了钠型Amberlite IRC-50树脂更有利于ε-PL的分离提取[10]。本论文重点考察了上样料液pH值和上样速度对钠型Amberlite IRC-50吸附ε-PL的影响;并研究了不同洗涤条件对ε-PL纯度影响,同时还考察了洗脱剂浓度和洗脱速度对ε-PL洗脱效果的影响。最后,评估了钠型Amberlite IRC-50对ε-PL纯度提升的贡献。
1 材料与方法
1.1 材料与试剂
发酵液由本实验室提供,制备方法见文献[11];大孔弱酸离子交换树脂Amberlite IRC-50,广州佰默生物科技有限公司;ε-PL样品(纯度≥95%),郑州拜纳佛生物工程股份有限公司;甲醇、乙腈:色谱纯,美国TEDIA天地试剂公司;盐酸、氢氧化钠、氨水:分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
3K15离心机,德国Sigma Inc.;Millipore切向流超滤系统,美国Millipore公司;Agilent 1260 Infinity高效液相色谱仪(HPLC),美国Agilent 公司;BT100-1F四通道蠕动泵,保定兰格恒流泵有限公司;30 mm×200 mm玻璃层析柱,泰兴市三爱思实验仪器厂;UV-2100分光光度计,尤尼可仪器有限公司;HYL-C组合摇床,太仓市强乐实验设备有限公司;AR224CN分析天平,奥豪斯仪器有限公司;FE20 pH计,瑞士Mettler Toledo公司。
1.3 方法
1.3.1 发酵液的预处理
将发酵液进行离心(离心力为10 800×g)15 min收集上清液,菌体加水洗涤后重复离心操作获得上清液。将上清液合并后用超滤膜过滤,收集透过液用于后续分离提取实验,为保证回收率在95%以上,期间多次加去离子水进行稀释操作。最终获得ε-PL质量浓度约为4 g/L的超滤液。
1.3.2 IRC-50树脂的预处理
称取一定质量的IRC-50树脂(出厂类型为氢型),先用去离子水洗涤树脂以去除破损树脂及杂质,再依次使用5倍体积1 mol/L的NaOH、HCl、NaOH溶液在摇床振荡4 h,200 r/min。每次酸碱洗涤后均使用去离子水冲洗3~5次去除残留在树脂间的酸碱溶液。依照上述步骤完成树脂的转型。
1.3.3 分析方法
ε-PL质量浓度采用LTZHAKI检测法[12]测定;ε-PL损失率计算公式为:
(1)
式中:C0和C1分别为经过处理前后料液中的ε-PL质量浓度,g/L,V0和V1为料液经过处理前后的体积,L。
蛋白质量浓度采用考马斯亮蓝法[13]测定;蛋白去除率计算公式为:
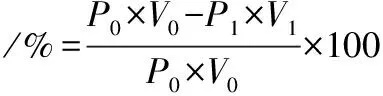
(2)
式中:P0和P1分别为经过处理前后料液中的蛋白质量浓度,g/L;V0和V1为料液经过处理前后的体积,L。
色度采用分光光度法测定。经前期研究发现,发酵液在425 nm处存在可见光最大吸收峰[14];采用425 nm作为色度的检测波长。待测液用去离子水稀释,使其吸光值在0.2~0.6之间。色度值R为待测液在425 nm处的吸光值与其稀释倍数的乘积。色素去除率计算公式为:
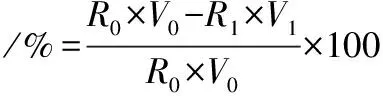
(3)
式中:R0和R1分别为料液经过处理前后的色度值;V0和V1为料液经过处理前后的体积,L。
1.3.4 最适动态离子交换条件的确定
1.3.4.1 动态上样pH 的确定
分别量取63.6 mL(对应于氢型湿树脂的质量为23.8 g)预处理好的IRC-50钠型树脂,湿法装柱,树脂床高径比为3∶1。调节蠕动泵流速为2.12 mL/min(2 BV/h),使用去离子水自上而下洗涤树脂床至流出液pH在10.3以下。使用6 mol/L NaOH溶液调节超滤液pH为5.5、6.0、6.5、7.0、7.5、8.0、8.5。采用2 BV/h上样速度进行上样,待使用德拉道夫检测流出液出现微量砖红色沉淀时停止上样,并使用2~3倍柱体积的去离子水冲洗,记录上样体积。洗脱条件根据预实验暂定为0.2 mol/L NaOH溶液以2 BV/h速度洗脱(此洗脱条件树脂解吸率均在95%以上),待使用德拉道夫检测流出液时出现微量砖红色沉淀时开始收集,砖红色沉淀消失时停止收集。
树脂工作交换容量[15]计算公式为:
(4)
式中,C0为超滤液原始ε-PL质量浓度,mg/mL;V0为上样体积,mL;m为湿树脂的质量,g。
IRC-50树脂解吸率的计算公式为:

(5)
式中:C0为上样液中的ε-PL质量浓度,g/L;Cr为洗脱液中的ε-PL质量浓度,g/L;V0为上样体积,L,Vr为洗脱液体积,L。
1.3.4.2 动态上样速度的确定
根据前期实验确定最适上样pH为7.0,使用6 mol/L NaOH溶液调节超滤液pH为7.0,调节蠕动泵流速为2、3、4、5、6、7 BV/h进行上样,待使用德拉道夫检测流出液时出现微量砖红色沉淀时开始定时取样,一个柱体积取一个样,直到使用德拉道夫检测流出液出现大量砖红色沉淀时停止取样,上样过程结束。测定所取样品的ε-PL质量浓度,根据到达穿透点(穿透点定义为流出液中ε-PL质量浓度达到上样ε-PL质量浓度的5%)时的上样体积计算树脂吸附量。以不显著降低树脂吸附量的前提下最大限度节省上样时间为指标,筛选出最适上样速度用于后续实验。
1.3.4.3 洗涤条件的确定
在最适上样条件(上样pH 7.0,上样速度5 BV/h)下进行上样,待使用德拉道夫检测流出液时出现微量砖红色沉淀时停止上样。使用去离子水和不同浓度的氨水(0.02~0.05 mol/L)作为洗涤剂,洗涤速度为2 BV/h,洗涤时间为2 h。根据最终洗脱液的色素去除率、蛋白去除率及纯度指标综合评定洗涤结果,筛选出最适洗涤条件。
1.3.4.4 洗脱浓度的确定
在最适上样条件下进行上样,待使用德拉道夫检测流出液时出现微量砖红色沉淀时停止上样,使用去离子水2 BV/h洗涤2 h。配制0.05、0.10、0.15、0.20、0.25、0.30 mol/L的NaOH 溶液作为洗脱剂,洗脱速度暂定为2 BV/h。为了使洗脱具有充足的时间,洗脱最长时间定为8 h。洗脱操作开始时记录开始洗脱时间,待流出液使用德拉道夫检测时出现微量砖红色沉淀时开始收集,待检测不到砖红色沉淀时停止收集并记录结束洗脱的时间;计算洗脱过程中洗脱剂的消耗量。根据洗脱所消耗的时间和洗脱剂的消耗量确定最适的洗脱浓度。
1.3.4.5 洗脱速度的确定
上样、洗涤条件与确定洗脱浓度时所采用的条件一致,使用最适洗脱浓度的洗脱剂(0.25 mol/L NaOH溶液),调节蠕动泵流速为1.0、1.5、2.0、2.5、3.0 BV/h进行洗脱。待流出液使用德拉道夫检测时出现微量砖红色沉淀时开始收集,待检测不到砖红色沉淀时停止收集;记录洗脱总耗时,计算洗脱过程中洗脱剂的消耗量。以较少消耗洗脱剂的前提下最大幅度的节省洗脱时间为指标确定最适的洗脱速度。
1.3.5 HPLC法检测实验室提取的ε-PL纯度及过程样品的ε-PL色谱分析
ε-PL样品纯度采用HPLC检测ε-PL法[16]测定。过程样品用流动相稀释4~10倍,再用0.45 μm微孔滤膜过滤,在检测波长为215 nm条件下进行液相色谱分析。
2 结果与分析
2.1 上样条件的优化
2.1.1 上样pH对树脂工作交换容量、蛋白及色素去除率的影响
如图1所示,上样pH在5.5~7.0范围时,树脂的工作交换容量随pH升高而不断增加,蛋白和色素的去除率也表现出缓慢增加趋势。此阶段随着pH的升高,等电点在5.5~7.0的杂蛋白和色素会逐渐带上负电而不被树脂吸附,使原本吸附这些杂质的树脂活性位点空余出来以吸附更多的ε-PL。在此pH范围下,上样pH越高,这种趋势就越明显,从图中也可以看出上样pH在7.0时达到树脂的最大工作交换容量。上样pH在7.0~8.5范围时,树脂工作交换容量呈现逐渐下降的趋势,而蛋白及色素去除率仍呈现显著增加的趋势。由于该树脂是大孔弱酸钠型树脂,其离子交换基团为—COONa,树脂上的羧基存在电离平衡,会优先结合H+,从而使树脂水溶液pH在10.3左右。ε-PL的等电点在9.0左右,随着上样pH的升高,在树脂内部发生交换时的pH会越来越接近甚至超过ε-PL的等电点,从而使ε-PL的带电性质发生变化,与树脂的结合能力减弱,导致ε-PL不能被完全吸附而穿透,从图上反映出工作交换容量呈下降趋势。而一般杂蛋白的等电点为5~7[17],当上样pH超过9.0后,会使越来越多的杂蛋白和色素带上负电而不被树脂吸附,从而使这些杂质被去除。综合考虑树脂工作交换容量与杂质的去除效果,最适上样pH为7.0。
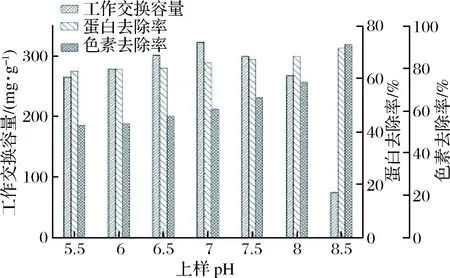
图1 pH对树脂工作交换容量、蛋白及色素去除率的影响Fig.1 Effect of pH values on the working exchange capacity,deproteinization ratio and decolorization ratio of resin
2.1.2 上样速度对树脂工作交换容量的影响
由图2可知,随着上样速度的增加,树脂工作交换容量逐渐降低,特别是上样速度超过5 BV/h后,下降趋势更加明显。离子交换过程中扩散是主要的限速步骤,而扩散又分为内部扩散和外部扩散。当树脂在低流速的条件下吸附低浓度目的产物时,主要是外部扩散为限速步骤[18]。本实验所使用的料液中ε-PL质量浓度较低(约为4 g/L),在较低的上样速度(2 BV/h)时,外部扩散为限速步骤。因此,适当的提高上样速度并不会降低树脂吸附ε-PL的能力,从图中也可以看出上样速度由2 BV/h 提升至5 BV/h 时树脂工作交换容量只有略微的降低。但是当上样速度继续提升(由5 BV/h 提升至7 BV/h)时,ε-PL来不及吸附到树脂表面,从而使流出液中ε-PL质量浓度提前达到穿透点,导致树脂工作交换容量的下降。为了提高树脂吸附效率,要在不显著降低树脂工作交换容量的前提下尽可能的缩短上样时间。因此,最适上样速度应为 5 BV/h,此时树脂的工作交换容量为305.12 mg/g(以湿树脂质量计算)。
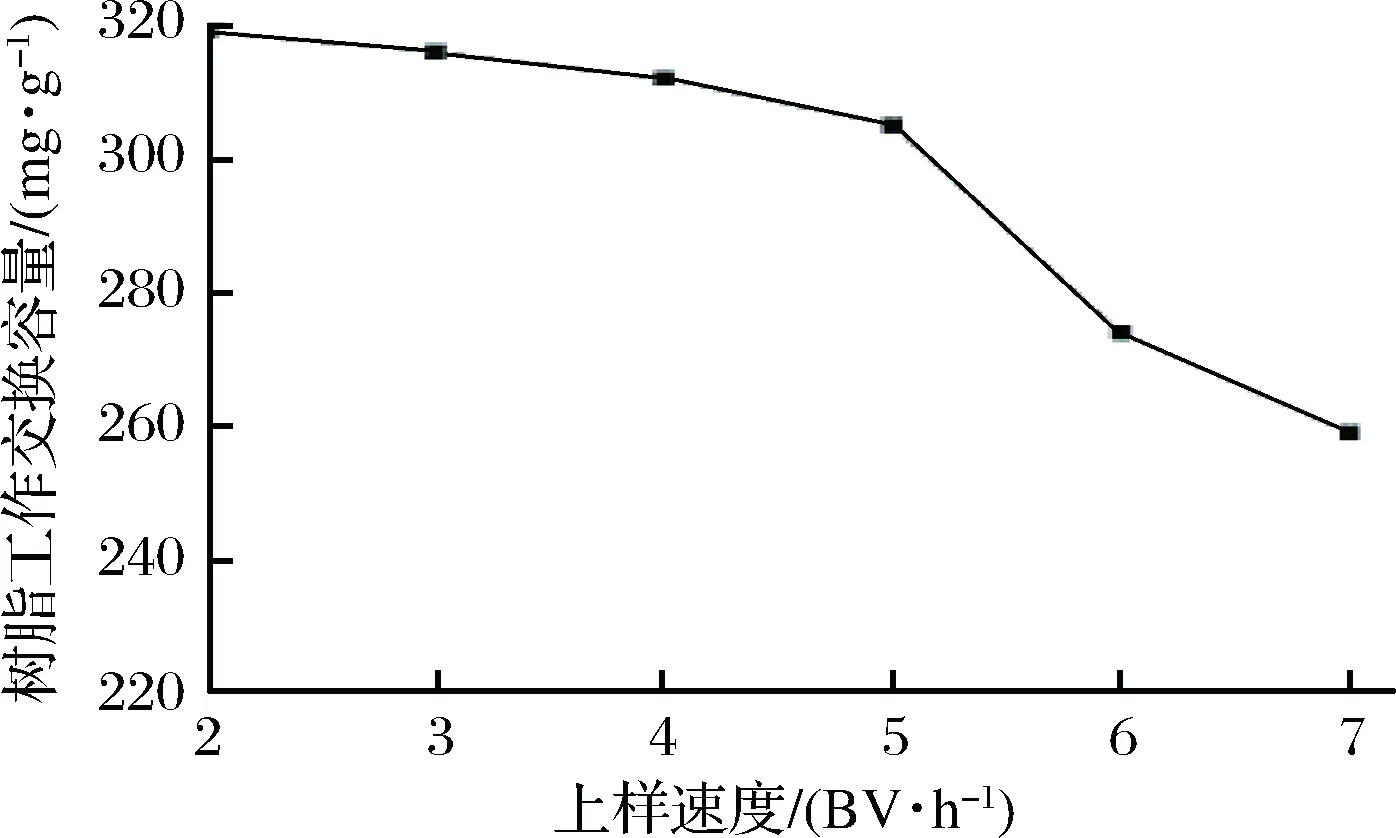
图2 上样速度对树脂工作交换容量的影响Fig.2 Effect of flow rate on working exchange capacity of resin
2.2 洗涤条件的优化
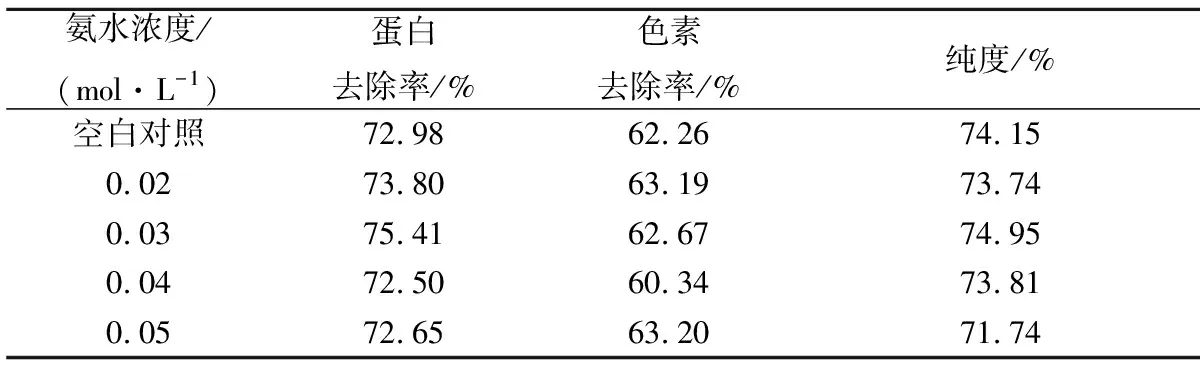
表1 洗涤剂浓度对洗脱液蛋白、色素去除率及纯度的影响Table 1 Effect of detergent concentration on the removalrate of protein, pigment removal rate and purity of eluate
注:空白对照的洗涤剂为去离子水
由表1可知,使用去离子水与使用不同浓度氨水洗涤时,蛋白及色素的去除率相差不大;就纯度而言,由于未对洗脱液进行脱盐,所得纯度只能作为参考,纯度变化不显著。总体来看实验中所采用的洗涤剂效果基本一致,蛋白去除率和纯度均在70%以上,色素去除率均在60%以上。考虑到后期脱盐,最终选择以去离子水作为洗涤剂进行后续实验。
2.3 洗脱条件的优化
2.3.1 洗脱剂浓度对ε-PL解吸的影响
由于解吸率与洗脱时间有关,为了保证解吸完全,最长洗脱时间定为8 h。实验结果见表2。由表2可知,0.05 mol/L和0.1 mol/L的NaOH溶液对树脂的解吸率均不到90%,表明在规定洗脱时间内此范围的洗脱剂浓度不能使吸附ε-PL的树脂完全解吸。NaOH溶液浓度超过0.15 mol/L时,树脂解吸率均在95%以上,表明该树脂解吸性能良好;从表中可以看出洗脱剂浓度越大,洗脱时间越短,对应洗脱剂消耗量也越大。洗脱主要是将吸附到树脂内部的ε-PL释放到树脂外部,内部扩散为限速步骤,而扩散速度与扩散界面两侧的浓度差成正比[19],所以树脂外部NaOH溶液浓度越高,越有利于ε-PL的扩散,从而减少洗脱时间。当NaOH溶液浓度过高时会使部分钠离子来不及结合到树脂上而导致NaOH利用率的降低,从而使NaOH的消耗量升高。为了降低后期脱盐的压力,洗脱剂浓度不能设置过高,但低浓度的洗脱剂会使洗脱时间过长从而影响后续的处理工艺。综合考虑洗脱时间、NaOH消耗量及后续脱盐,0.25 mol/L的NaOH为最适洗脱浓度。

表2 洗脱剂浓度对树脂解吸效率的影响Table 2 Effect of eluant concentration on desorptionefficiency of resin
2.3.2 洗脱剂流速对ε-PL解吸的影响
不同的洗脱流速下,树脂解吸率均达到95%以上。随着洗脱速度的增加,洗脱时间和浓缩比逐渐减少,而洗脱剂的消耗量逐渐增加。在0.25 mol/L NaOH溶液作为洗脱剂的条件下,外部扩散为洗脱的主要限制条件,洗脱流速主要影响外部扩散速度,在一定的范围内,增加洗脱速度会减少洗脱耗时,从而提高洗脱效率。但是随着洗脱速度的不断提升,会造成洗脱剂用量增加,并且浓缩效应也会降低。综合考虑洗脱时间、浓缩比和洗脱剂消耗量,2 BV/h为最适洗脱速度。
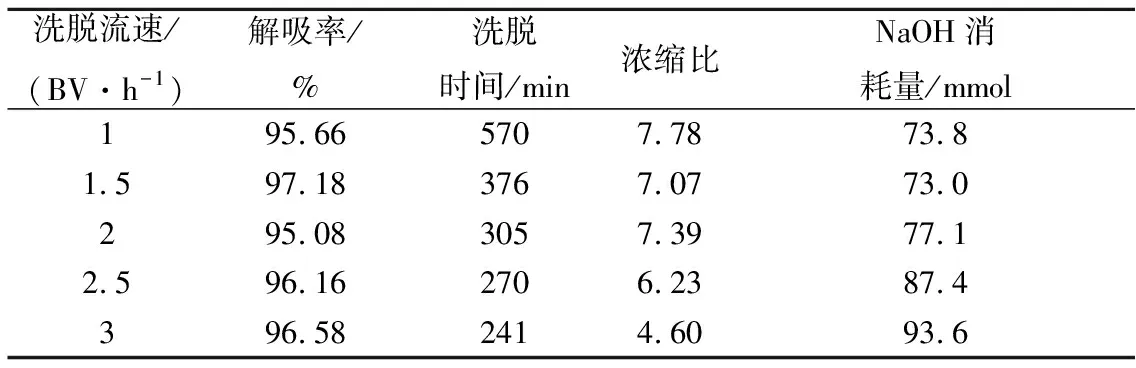
表3 洗脱流速对树脂解吸效率的影响Table 3 Effect of elution rate on desorption efficiencyof resin
2.4 钠型Amberlite IRC-50树脂分离ε-PL过程
2.4.1 最优条件下钠型Amberlite IRC-50树脂上样-洗涤-洗脱曲线
图3为钠型Amberlite IRC-50树脂在吸附ε-PL过程中的吸附穿透曲线,由于该树脂可交换离子为Na+,在交换过程中不会引起pH的大幅度变化。上样流出液pH稳定在8~9之间,此pH条件下弱酸树脂的交换基团充分解离,ε-PL带正电从而被树脂吸附。在52个柱体积的交换过程中,流出液中的色素和蛋白浓度保持稳定,流出液中没有检测到ε-PL,表明树脂在上样过程中交换性能保持稳定。pH是影响离子交换的关键因素,只有保证交换过程中pH的稳定,弱酸树脂的吸附选择性才不会受到影响。52个柱体积之后,即将达到树脂的工作交换容量,从而在流出液中检测到有ε-PL穿透,当ε-PL穿透浓度达到上样浓度的5%时整个上样过程结束。
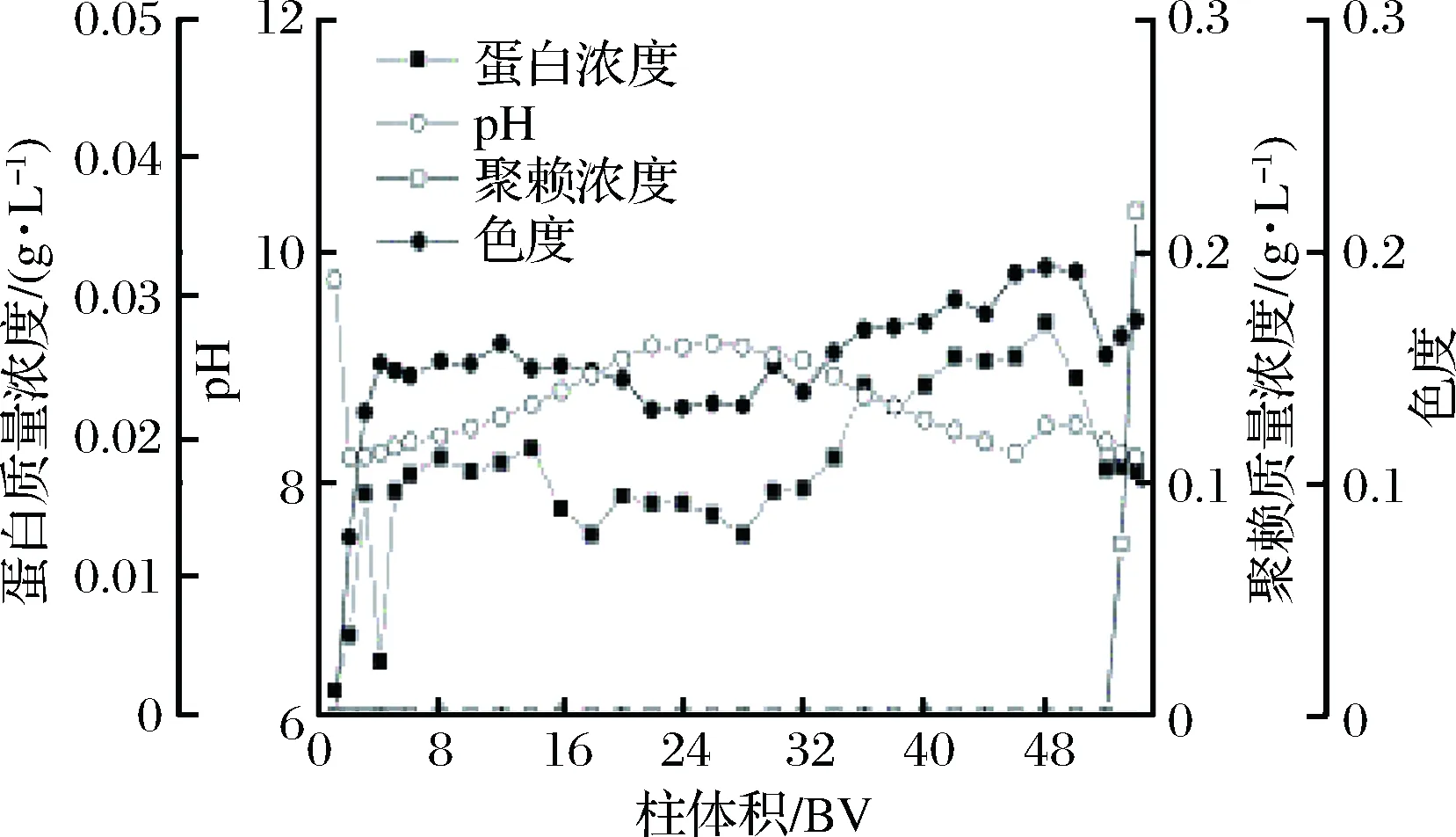
图3 IRC-50 钠型树脂吸附穿透曲线Fig.3 Adsorption breakthrough curve of IRC-50 in the forms of Na+
采用洗涤剂为去离子水,洗涤体积为4 BV;洗涤速度与洗脱速度一致,均为2 BV/h。如图4所示,在洗涤过程中,pH呈现上升的趋势,这主要是由于弱酸树脂的性质引起的;色度呈现降低的趋势,随着洗涤的进行,树脂床中残留的料液被去离子取代,从而引起流出液色度的降低;蛋白浓度呈现略微上升,表明可以通过洗涤使结合到树脂上的部分蛋白解吸,从而去除该部分蛋白。在洗脱过程中,在起始阶段流出液中没有检测到ε-PL,但蛋白浓度和色度明显增大,表明ε-PL与树脂的结合能力要大于蛋白和色素杂质,使得在洗脱过程中,蛋白和色素被优先解吸。随着洗脱的进行,蛋白浓度逐渐降低;色度的变化情况与ε-PL浓度类似,ε-PL本身具有颜色,这可能是导致这一现象的原因;随着ε-PL浓度的升高,pH变化不大,这是由于ε-PL具有大量的胺基,会结合氢氧根,导致pH没有明显的上升,随着洗脱的继续,之前结合到树脂的ε-PL大量被解吸,从而无法充分的结合洗脱剂中的氢氧根,导致洗脱液pH的升高;在洗脱将要结束时,树脂上吸附的物质都被解吸下来,洗脱液液中大部分为洗脱剂(0.25 M的NaOH溶液)。
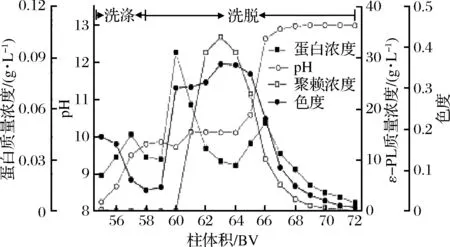
图4 IRC-50 钠型树脂洗涤与洗脱曲线Fig.4 Washing and elution curves of IRC-50 in the forms of Na+
2.4.2 离子交换单元杂质去除情况及收率纯度分析
图5为离子交换前后料液在215 nm处的液相色谱图,第1个峰为ε-PL的峰,其余峰均为杂质。从图中可以明显看出,经过离子交换处理后,杂峰的个数明显减少,仅剩余2个杂质峰。对比离子交换之前,这2个杂峰的高度也明显降低。因此推测在pH 为7.0的超滤液中杂质主要为不带电或带负电的物质,在离子交换过程中不被阳离子树脂吸附,从而得以去除。C图为ε-PL样品的液相图谱,对比标准液相图谱发现,经过离子交换的料液ε-PL的峰与标准图谱非常一致,表明经过离子交换没有使ε-PL成分受到破坏。经过离子交换后,大部分杂质被去除,纯度由24.29%提升至75.26%,此时料液中主要杂质为无机离子(Na+等)。经过前期离子交换条件的优化,离子交换步骤的损失率较低,最终离子交换步骤的收率为96.40%。将此洗脱液进行脱色及纳滤脱盐等操作,最终获得纯度在95%以上,收率在60%以上的ε-PL盐酸盐样品。
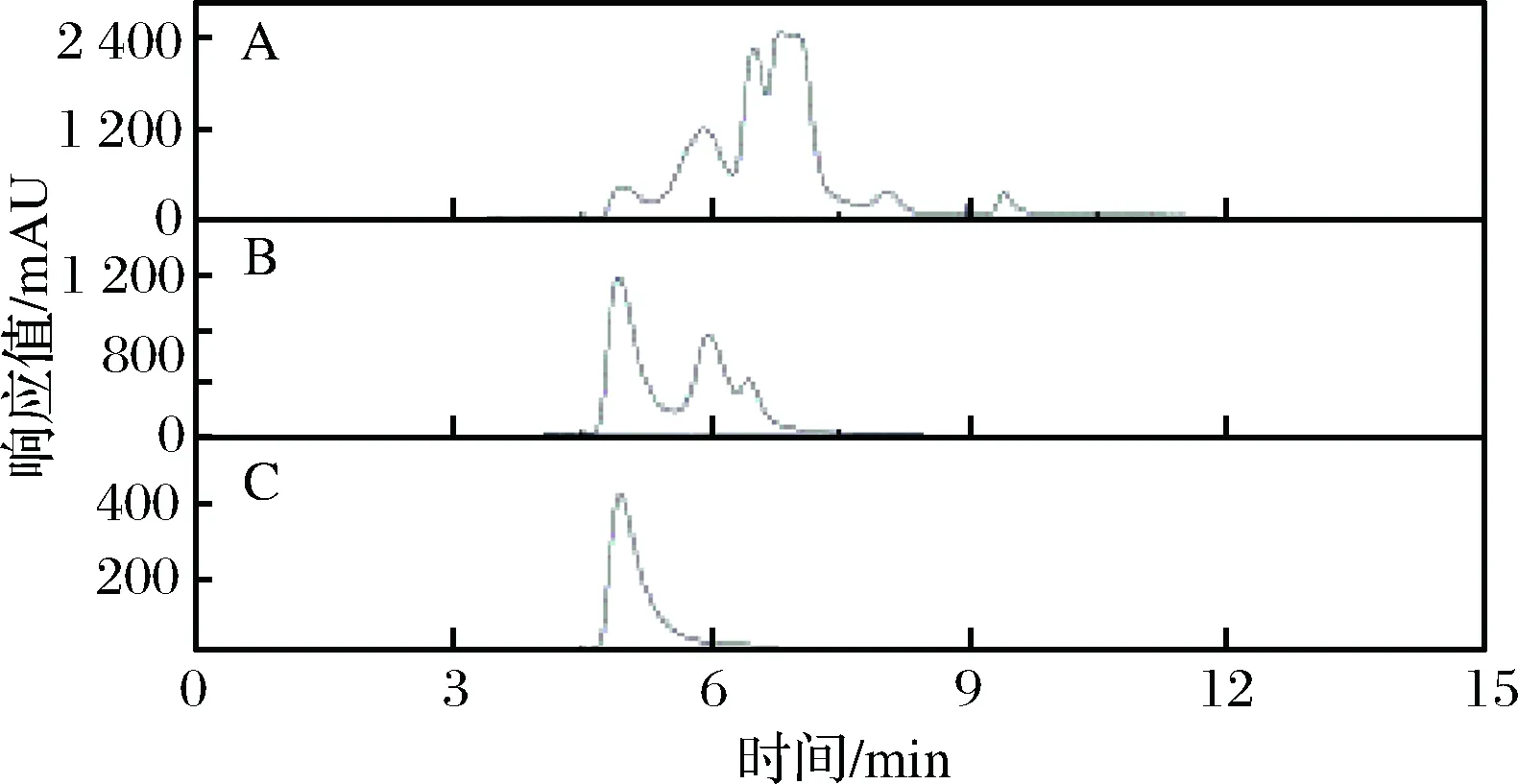
图5 超滤液、树脂洗脱液及ε-PL商品的液相色谱图Fig.5 The chromatograms of ultrafiltrate, ion exchanging eluate and the product of ε-PL注:A、B、C分别表示超滤液、离子交换洗脱液及ε-PL商品
3 结论
通过对IRC-50钠型树脂分离发酵液中ε-PL动态条件的优化,使树脂具有更好的分离效果。动态最适条件为:上样pH为7.0、上样速度为5 BV/h、洗涤剂为去离子水、洗涤速度为2 BV/h,洗脱剂为0.25 mol/L的NaOH溶液、洗脱速度为2 BV/h。在此离子交换条件下,树脂工作交换容量为305.12 mg/g(以湿树脂质量计算),树脂解吸率在95%以上;ε-PL纯度由24.29%提升至75.26%,ε-PL回收率为96.40%。结合后续工序处理,最终获得ε-PL总收率在60%以上,各项指标符合国家标准规定的ε-PL盐酸盐样品。

