酵素控制水中铜绿微囊藻的实验效果研究
余国忠,王世香,邹发俊,李浩然
(1.信阳师范学院 地理科学学院,河南 信阳 464000; 2.信阳市环境保护局,河南 信阳 464000)
0 引言
水体蓝藻污染一直是困扰人类社会发展的严重问题之一,长期以来,人类一直在寻找水体蓝藻污染的有效控制措施,虽然产生了一些物理、化学、生物、生态或它们之间的组合的控制方法,但由于这些方法各自的局限性,人类依然需要探索高效、持久的控制途径.蓝藻中的铜绿微囊藻(Microcystisaeruginosa)由于其分布广泛、爆发频繁、对人畜和水生态危害严重与控制困难等,为人类社会重点关注[1-3].随着全球暖化,铜绿微囊藻污染有加剧趋势[4],迫切需要开发新的控制技术.近年来,利用废弃生物质制作酵素风靡海内外,有报道认为酵素可以改善水体水质[5,6],在我国个别地方的人代会上有代表建议采用酵素治水[7],但也存在争议.关于酵素抑制水体藻类方面的研究报道很少,赵立新等[8]在北京潮白河喷洒酵素进行试验,取得了一定的抑藻效果,但他们认为仍存在许多值得商榷的问题,因此,对于酵素抑制水体藻类问题,目前尚缺乏规范、严密的研究成果,更缺乏酵素控制水体中铜绿微囊藻污染的效果的研究报道.本文尝试制作一种酵素,以发生铜绿微囊藻水华的水体水作为实验对象,以叶绿素a(Chl-a)去除率作指标,检验该酵素对藻类的控制效果,并考察水样pH值的变化.
1 材料和方法
1.1 材料
(1)试剂 用废弃蔬果做原料,自制一种酵素,采用纱布过滤液作为实验试剂(文中称作试剂a);实验室内配制浓度为10 g/L的碳酸镁悬浊液、浓度为90%的丙酮溶液.
(2)仪器 普析通用T6新世纪型紫外可见分光光度计(北京普析通用仪器有限责任公司),OLYMPUS CX41-32C02光学显微镜(奥林巴斯公司),pH计,水样采集、搅拌、过滤与Chl-a萃取设备[9].
(3)含铜绿微囊藻原水 实验用含铜绿微囊藻的原水水样取自信阳师范学院校园内景明墓前小水渠.取样时,水面水华明显,使用采水器于水面下30 cm深处采集水样.镜检发现水样的藻类构成非常简单,除极少量的小球藻外,其余均为铜绿微囊藻,即铜绿微囊藻是绝对优势藻种.
1.2 方法
由于Chl-a可以表征水中浮游藻类活细胞的生物量,Chl-a含量的高低是水体富营养化程度的一个重要指标[8],因此,本实验采用加入酵素前后水样Chl-a浓度变化及其去除率作为指标来考察酵素的控藻效果.水样中Chl-a含量的测定采用《湖泊富营养化调查规范》(第二版)提供的方法[8].Chl-a浓度去除的百分率公式如下:
式中: ρ 为Chl-a浓度去除百分率,%;C0为 原水水样的Chl-a浓度,μg/L;C1为加入试剂a后水样的Chl-a浓度,μg/L.
取1L烧杯6只,用自来水冲洗干净、晾干后,分别编号为1、2、3、4、5、6,将采得的水样迅速送入实验室摇匀后,用水样水先分别清洗上述已编号的烧杯,循1-6的序号分别加入水样1000、980、960、940、920、900mL,然后分别加入试剂a0(作为空白对照)、20、40、60、80、100mL,用玻璃棒搅拌均匀,形成试剂a体积分数分别为0%、2%、4%、6%、8%、10%的混合液序列,配制完毕后用纱布盖好.
在实验室温度、光照条件下将序列混合液先放置14h,搅拌后取样测定Chl-a浓度,比较不同体积分数下的Chl-a浓度去除率,找出去除率最高的体积分数所对应的样品号,然后将此样品的混合时间分别延长至26、38、50、62h,在每时段末搅拌水样均匀后取样测定Chl-a浓度.每个水样、每个时段的Chl-a浓度的测定进行三次,取三次测定值的平均值作为该水样该时段的Chl-a浓度值.水样摇匀取样前,用pH计测定水样的pH值.
实验于2017年4月进行,测得酵素的pH为3.4, 测得原水水样Chl-a浓度为303.9μg/L、pH为7.0.对照中国湖泊富营养化评价标准,从Chl-a浓度看,此水体达到重富营养化或超富营养化水平[9].
2 结果与讨论
2.1 混合14 h后水样Chl-a的去除效果
水样序列混合14h后的Chl-a浓度去除实验结果见图1.在图1中,1号水样即原水水样在实验室放置14h后,Chl-a浓度为317.8μg/L,相比原水取样时的303.9μg/L,升高了13.9μg/L,表明在这段时间内水样中的藻细胞仍然处于增殖阶段.
投加试剂a后,水样Chl-a浓度减小,在体积分数从2%到8%(对应图1烧杯序号2-5号)范围内,随试剂a投加量的增加,水样Chl-a浓度降低,Chl-a浓度的去除率从33.33%上升到53.17%,与原水以及1号烧杯水样结果比较,试剂对水中Chl-a有比较明显的降解作用,表明投加酵素不仅对水样中藻类的生长有一定的抑制作用,而且对水样中的活藻细胞产生了一定的灭活效果.但图1显示,当试剂a的体积分数为2%时,水样Chl-a浓度快速下降,随着试剂a体积分数继续增加,水样Chl-a浓度虽然继续降低,但降低速度减慢,当试剂a体积分数为10%时,水样Chl-a浓度的去除率下降为50.14%,说明酵素对藻类的灭活效果存在投量限制,并非投量越高效果越好,酵素体积分数为8%时的藻类控制效果最佳.

图1 混合14 h后不同体积分数的水样Chl-a浓度去除变化Fig. 1 Removal of Chl-a concentration from raw water samplesmixed with different volume fractions of Regent a for 14 hours
2.2 试剂a体积分数为8%、不同混合时间条件下水样Chl-a浓度的去除效果
继续延长试剂a体积分数为8%的水样的混合时间分别为26、38、50、62 h,不同混合时间条件下水样Chl-a浓度去除结果见图2.从图2可以看出,随着混合时间延长,水样中Chl-a浓度呈现持续下降趋势,到第62 h末,水样中的Chl-a浓度降低为64.51 μg/L,去除率也由第14 h末的53.17%上升为第62 h末的78.77%,可见试剂a对水样中Chl-a浓度具有一定的持续降低效果,表明一定体积分数的酵素对原水水样中的藻类具有一定的持续控制作用,由于铜绿微囊藻在实验采用的原水藻类组成中绝对优势地位.可以认为,实验用酵素对受试原水中的铜绿微囊藻有一定的灭活作用.

图2 体积分数为8%的混合水样中Chl-a浓度随时间的变化Fig. 2 Changes of Chl-a concentration with time in raw watersample mixed with 8% volume fraction of Regent a
2.3 水样与试剂a混合后的pH值变化
实验中测定混合水样pH值并与原水水样pH值比较,发现试剂加入后,混合水样的pH值发生了显著变化(图3、图4).

图3 不同体积分数的混合水样14 h后的pH值变化Fig. 3 Changes of pH values in raw water samples mixed withdifferent volume fractions of Regent a for 14 hours
图3中,相同的混合时间下,随试剂a从0%增大到8%,水样pH分别为7.5、3.9、3.5、3.4、3.2、3.2,原水的pH为7.0,可见混合水样的pH下降非常明显.试剂a的pH为3.4,试剂a体积分数在6%时,混合水样的pH为3.4,试剂a体积分数达到8%、10%时,混合水样的pH为3.2,小于试剂a的pH,但是投加10%的试剂a与投加8%的试剂a相比,水样的pH没有变化,这是一个值得注意的现象.试剂a为0%的水样的pH比原水水样的pH高出0.5,说明原水水样在14 h内没有发生自然酸化,因此可以排除这段时间内原水水样自然酸化对混合水样酸度值的影响.由于体积分数占8%、10%的试剂a的投加并没有彻底消除水样中的Chl-a(图1),可以推测,混合水样中试剂a的体积浓度超过一定程度时,混合水样的物质成分可能产生了某些变化,从而使混合水样的pH降低,而且,这种物质体系的变化又有一定的稳定性,从而使得混合水样的pH保持相对的稳定性.产生这种现象的具体原因需要进一步研究.
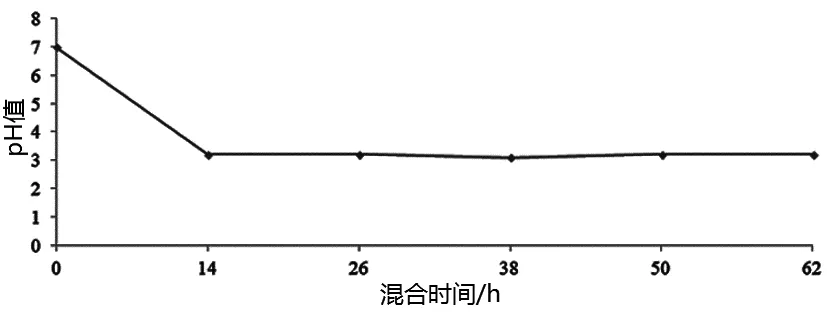
图4 体积分数为8%时的混合水样pH值随时间的变化Fig. 4 Changes of pH with time in raw watersample mixed with 8% volume fraction of Regent a
图4中,试剂a体积分数为8%的混合水样混合时间在0~62 h内,水样pH分别为7.0、3.2、3.1、3.1、3.2、3.2,明显地,除在0~14 h的混合时间内pH降低显著外,再延长混合时间,pH则降低且变化缓慢,从第14 h末~第26 h末,pH只降低了0.1;在随后的第26 h~第28 h内,水样pH保持3.1不变;以后的12 h内,水样pH又升高到3.2,从第50 h末~第62 h末,水样pH保持3.2不变.因此,混合14 h以后,随着混合时间的继续延长,水样的pH变化并不十分明显,但是仍呈现酸性,且比试剂a的酸性强,这同样可能是混合水样中的物质体系发生了变化引起的.
诸多研究和实践表明,水体pH值是水体内外众多因素综合作用的结果,外来因素造成水体pH值变化后会引发水体物质体系变化,进而导致水体生态的变化,影响水体正常功能,激剧的水体pH值变化的结果是水体出现不可逆的变化,最终造成水体出现生态灾难.图3、图4表明,酵素的使用会引起水样的pH变化,显著降低了水样的pH,使水变酸,而且水样的酸度值会维持几十个小时,这种情况如果出现在具体水体,必然会使水体失去正常功能.当然,本文结果虽然基于原水基础,但是仍为实验室结果,对水体的缓冲性能考虑不够,实验用酵素对具体水体pH影响如何,还需要开展进一步的实验调查研究.
将图1-图4关联起来,可以看出,原水中的铜绿微囊藻具有相当强的耐酸能力,体积分数占8%的试剂a对水样作用了62 h后,水样的剩余Chl-a浓度仍然高达64.51 μg/L,根据有关标准,从Chl-a浓度看,水样水仍处于富营养化水平[9],表明对于铜绿微囊藻在藻类构成中占绝对优势的富营养化水体,本实验用酵素难以高效控制这类水体的铜绿微囊藻,说明酵素存在抑藻应用上的局限性.另外,废弃生物质种类众多,成分复杂,不同生物质或生物质的组合发酵后会形成不同特性的酵素,在利用酵素进行铜绿微囊藻占优势的水体富营养化污染控制时,应根据酵素性质、水体情况,在实验的基础上谨慎行事.
3 结论
实验结果表明:1)适量的废弃生物质制作的酵素对铜绿微囊藻占绝对优势的富营养化原水中的藻类具有一定程度和一定持续时间的灭活作用,但不能够彻底杀灭水中的铜绿微囊藻;2)酵素本身的酸性及其投加到水中可能引起的作用,导致受试水的酸化现象,水的酸化程度并不随着酵素量的提高以及酵素作用时间的延长而发生明显的波动.铜绿微囊藻细胞对投加酵素所形成的酸化水具有一定的耐受性;3)酵素对富营养化水中铜绿微囊藻污染的控制具有局限性,其实践应用应在深入研究的基础上审慎进行.

