六偏磷酸钠分散剂和聚羧酸减水剂对硅镁胶凝材料水化进程的影响
李兆恒 ,李伟 ,韦江雄 ,余其俊
(1.华南理工大学 材料科学与工程学院,广东 广州 510640;2.广东省水利水电科学研究院,广东省水利新材料与结构工程技术研究中心,广东 广州 510635)
0 引言
随着我国经济持续、健康、快速的发展和人民生活水平的迅速提高,为建筑材料提供了广阔的市场和机遇,同时也提出了更严格的要求。大力发展新型建筑材料,坚持走绿色发展之路,是当今重要的课题之一。相比于传统硅酸盐水泥,利用氧化镁生产胶凝材料具有明显的节能减排优势,MgO可以用来生产氯氧镁水泥[1]、磷酸镁水泥[2]、硫氧镁水泥[3],均能提供良好的物理性能。研究表明[4],MgO和SiO2在有水存在条件下可发生反应生成水化硅酸镁凝胶(M-S-H)。但实际上,该反应原材料比表面积非常大,制约反应的关键是MgO和SiO2的分散与溶解。前期试验表明,聚羧酸减水剂和六偏磷酸钠可以较好的分散原材料,但分散剂的加入势必会影响硅镁胶凝材料的水化进程。
本文的研究目的是研究不同的外加剂在不同掺量下对硅镁胶凝材料水化进程的影响。通过孔溶液中离子浓度变化和水化热试验,分别从微观和宏观进行表征;最后通过XRD,热分析和SEM分析其反应产物种类、形态及反应程度。探讨硅镁胶凝材料反应机理和过程,为制备高性能水化硅酸镁材料指明方向,为开辟一类新型水硬性胶凝材料提供一定的理论基础和实践基础。另一方面,对节能减排、节约资源能源具有重要的经济、社会意义。
1 试验
1.1 原材料及仪器设备
MgO:由菱镁石在850℃煅烧2 h,制得轻烧MgO,活性为80 s;硅灰(SF):挪威埃肯公司提供的半聚集态硅微粉;分散剂:六偏磷酸钠:分析纯,天津市福晨化学试剂厂;聚羧酸减水剂:RHEOPLUS 420,固含量20%,巴斯夫。MgO和SF的化学组成如表1所示。试验仪器设备如表2所示。
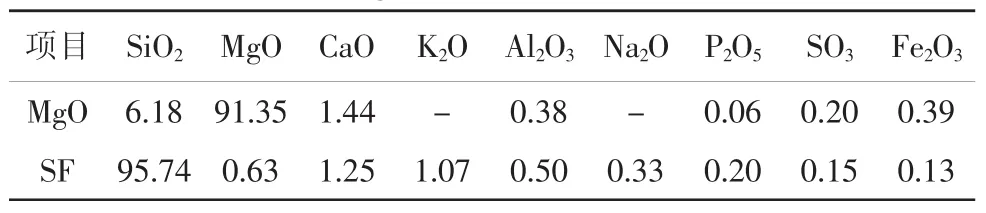
表1MgO和SF的化学成分 %
表2 主要仪器设备
1.2 试样制备
采用 MgO和硅灰(质量比 6∶4,Mg/Si比约1.0)的混合原料,在V型混料机中混合20 min,然后将混合试样装入密封袋备用。试样制备时加入不同掺量的减水剂或分散剂(按MgO和SF总质量百分比计),使用去离子水按照0.5的水灰比成型。采用净浆搅拌机搅拌均匀后装入密封袋密封放入标准养护箱[(20±1)℃,相对湿度>90%]养护。按要求将试件标准养护至规定龄期后取出,敲碎并取内部浆体,编号装入密封袋中,用无水乙醇终止水化,置于65℃真空干燥箱中干燥备用。
1.3 测试与表征
水化放热反应是反映胶凝材料水化过程的一个重要的指标,通过观察水化放热速率和放热量的变化,可以反映水化进行的快慢和水化程度。本试验中采用TAM air水化热测量仪测试混合料的水化放热情况。通过水化放热速率曲线和累积水化放热量曲线来分析掺加不同分散剂后硅镁胶凝材料的水化放热量及水化放热速率变化。
目前提取硬化水泥浆体孔溶液的方法主要分为3种:固液萃取法[4-6]、高压压榨法[7]、原位溶出法[8]。本文采用自制的孔溶液榨取模具,将养护不同龄期的试样放入模具内,控制压力机以1 MPa/s的速率均匀加压,抽滤收集的孔溶液,装入50 ml塑料瓶中,立即使用便携式pH计测试试样提取的孔溶液pH值,随后用6 mol/L盐酸酸化pH至1.0左右,封存备用。使用火焰原子吸收光谱分析孔溶液中的Mg2+浓度,以此来表征体系微观离子变化,分析其变化规律。
水化产物分析采用荷兰Panalytical公司X-ray衍射分析仪测试终止水化后的样品的矿物组成,测试条件为Cu靶,Kα1线,管电压40 kV,管电流30 mA,测量方式为连续扫描。同时采用德国耐驰公司的STA449C/3/MFC/G型热分析仪进行水化样的热分析测试,测试条件为:温度为40~1000℃,升温速率10℃/min,N2保护。采用德国Carl Zeiss公司生产的EVO18型扫描电镜观察终止水化后样品的微观形貌与结构。
2 结果与讨论
2.1 减水剂和分散剂对水化热的影响
图1为掺加不同减水剂和分散剂的硅镁胶凝材料的水化放热速率曲线和累计放热量曲线。
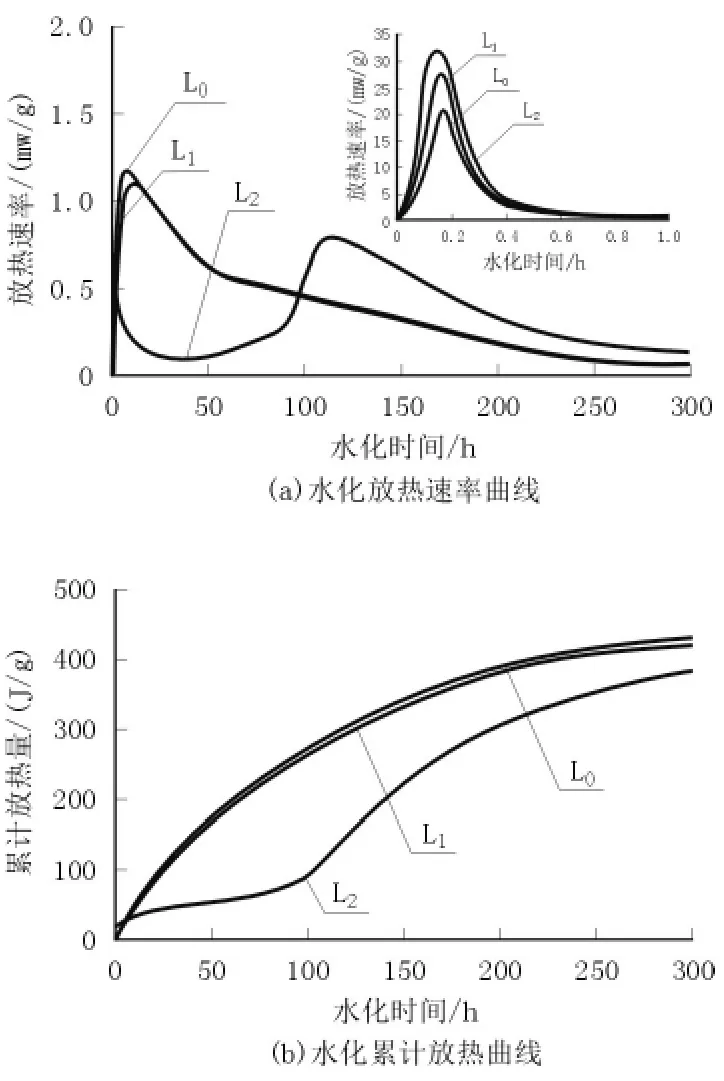
图1 掺加不同分散剂的试样水化放热曲线
从图1可以看出,未掺分散剂的试样和掺0.4%的聚羧酸减水剂的试样水化放热曲线基本相同,而掺有4%六偏磷酸钠的试样水化放热曲线与前两者相差较大。图1(a)为水化放热速率曲线,硅镁胶凝材料的水化放热速率曲线与硅酸盐水泥的水化放热速率曲线相似,初始放热峰为MgO和硅灰的润湿热和溶解热。加入分散剂后初始放热峰增大,说明颗粒得到了较好的分散,加速了颗粒的溶解放热;第二阶段的放热峰为MgO溶解形成Mg(OH)2以及Mg2+和可溶性SiO2反应生成M-S-H凝胶的反应热,六偏磷酸钠的加入明显延缓了第二阶段放热峰的出现,这主要是由于六偏磷酸钠为Mg2+络合剂,形成稳定的络合物包裹在MgO颗粒表面,从而起到了缓凝的作用。图1(b)为水化累积放热曲线,表明掺加六偏磷酸钠后水化累积放热量显著降低。
2.2 减水剂和分散剂对孔溶液的影响
MgO-SiO2-H2O胶凝体系是以液相为介质发生反应的,其反应过程主要有2个步骤:
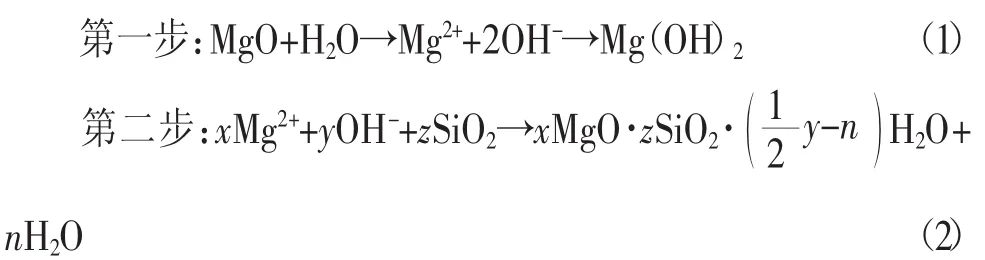
由式(1)可知轻烧氧化镁在水中溶解,形成饱和Mg(OH)2溶液,受到 Mg(OH)2的溶度积的影响,孔溶液中 Mg2+和OH-离子浓度很低。由式(2)可知,Mg2+,OH-和可溶性 SiO2反应生成M-S-H凝胶,随着反应的进行,pH值逐渐降低,最终趋于平稳,形成了低碱度的胶凝体系[9]。
图2为掺入减水剂和分散剂后硅镁材料浆体孔溶液的pH值。
由图2可知,在没有外加剂的情况下,溶液中的pH值(OH-离子浓度大小)在3 d之前的龄期内逐渐升高达到最大值;聚羧酸减水剂的加入对孔溶液碱度影响不显著;六偏磷酸钠的加入提高了孔溶液的pH值,且随着掺量的增加pH值也相应的增大,总体趋势呈现先升高后降低。这主要是由于六偏磷酸钠的加入,提高了体系Na+浓度,进而使OH-浓度增大,随着反应的进行,OH-被消耗,生成的M-S-H凝胶也吸附了部分Na+,pH值逐渐降低。
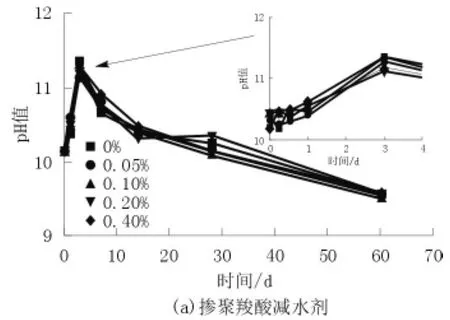
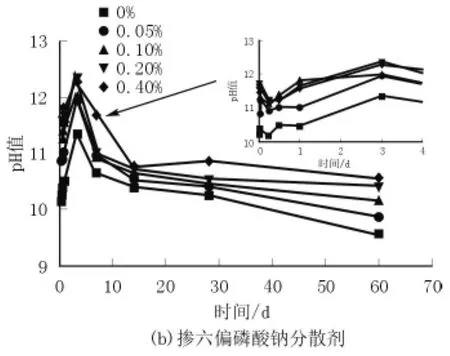
图2 不同掺量分散剂对孔溶液碱度的影响
水化硅酸镁的生成反应是以可溶性SiO2和溶液中Mg2+的反应进行。图3为不同掺量分散剂对孔溶液Mg2+浓度的影响。

图3 不同掺量分散剂对孔溶液Mg2+浓度的影响
由图3可以看出,聚羧酸减水剂在早期促使Mg2+浓度提高了近5倍,后期逐渐一致;六偏磷酸钠的加入使早期Mg2+浓度提高了50多倍,后期逐渐一致。这是因为MgO溶解到水溶液后,由于Mg2+离子极性作用,形成了水合镁离子配位体[Mgp(OH)q(H2O)]2p-q,及其带电荷的胶体团,加入少量的外加离子,特别是加入具有分散作用的外加剂后,可以提高了水合镁离子[Mgp(OH)q(H2O)]2p-q及其胶体的稳定性,因而溶液中水合镁离子的浓度得以提高,而六偏磷酸钠为Ca2+、Mg2+螯合剂,与Mg2+形成络合物,从而显著提高Mg2+浓度。
2.3 水化产物分析
由于分散剂引起孔溶液碱度以及主要的离子浓度的发生变化,势必会影响水化产物的种类及数量。
图4为硅镁材料及掺不同减水剂或分散剂不同龄期的水化试样XRD图谱。

图4 掺不同分散剂硅镁材料浆体在不同龄期的XRD图谱
由图4可见,MgO的峰高随时间的延长而下降,其中2θ为 32°~37°、58°~62°之间出现了 2个非晶相峰,与采用化学方法合成的M-S-H凝胶的非结晶峰相一致[10],且随着龄期的延长该非结晶峰更加明显。硅镁胶凝材料的水化产物主要为Mg(OH)2,M-S-H凝胶以及未水化完全的MgO和硅灰[10]。聚羧酸减水剂对水化产物几乎无影响,六偏磷酸钠的加入导致水化产物中几乎不存在Mg(OH)2,而未水化的MgO的量增多。这主要是因为六偏磷酸钠的加入提高了孔溶液碱度,抑制了MgO溶解形成Mg(OH)2。结合图2和图4,说明六偏磷酸钠的加入提升了反应pH值抑制了Mg(OH)2的生成,降低了MgO水化生成 Mg(OH)2的量。
图5为掺不同分散剂的硅镁材料硬化浆体28 d试样的热分析曲线。
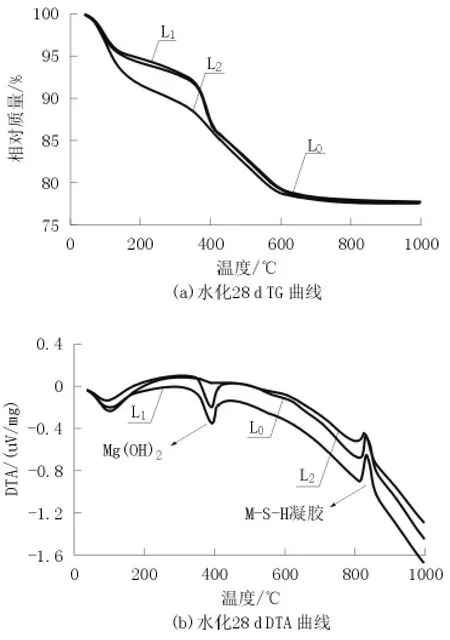
图 5 掺不同分散剂硅镁材料浆体28 d的热分析曲线
由图5可见,硅镁胶凝材料的水化产物含有2个吸热谷,1个放热峰。120℃左右有1个吸热谷,同时伴随有质量的变化,这是M-S-H凝胶脱去吸附水的特征吸热谷;在400℃左右有1个较窄的吸热谷,这是Mg(OH)2脱去OH-的反应,并且伴有明显的重量变化,在850℃左右的放热峰很尖锐,且没有质量损失。这是水化硅酸镁向镁橄榄石转变的析晶峰[12-13]。掺加六偏磷酸钠的试样在400℃左右的吸热谷不明显,说明水化产物中Mg(OH)2的量很少,与XRD分析结果相一致。
2.4 微观结构分析(见图6)

图 6 掺不同分散剂28 d试样的SEM照片
由图6可以看出,未掺分散剂和掺0.4%聚羧酸减水剂的试样明显存在棱柱状的Mg(OH)2结晶相,M-S-H凝胶包裹在Mg(OH)2周围,起到胶结的作用;掺有六偏磷酸钠的试样中不存在Mg(OH)2,这也与XRD和热分析的结果相一致;水化硅酸镁凝胶呈现絮凝状、点滴状,M-S-H凝胶之间以及与其它相之间搭接进从而提供强度。
3 结论
(1)硅镁胶凝材料的水化放热曲线与硅酸盐水泥相似,掺加六偏磷酸钠分散剂起到一定的缓凝效果,延缓了水化放热。硅镁胶凝材料为低碱度的胶凝体系,六偏磷酸钠的掺入提高了pH值,同时由于其具有较强的Mg2+络合作用,使得早期Mg2+浓度提高了近50倍。聚羧酸减水剂对水化热和孔溶液影响较小。
(2)硅镁胶凝材料的水化产物主要为 Mg(OH)2、M-S-H凝胶以及未水化完全的MgO和硅灰。M-S-H凝胶呈现絮凝状、点滴状,随着反应的进行M-S-H凝胶的量不断增加,MS-H凝胶之间以及与其它相之间搭接进而提供强度。六偏磷酸钠的加入提高了碱度,抑制了MgO溶解形成Mg(OH)2。

