牛脂肪组织中miRNA的研究进展
纪 会,柴志欣,王 会,钟金城
(西南民族大学青藏高原研究院,四川 成都 610041)
miRNA是一类长20~25个核苷酸的非编码小RNA,一般以互补配对的方式与靶基因结合,引导RNA诱导沉默复合物(RNA-induced silencing complex,RISC)清除mRNA或抑制mRNA的翻译,从而影响编码蛋白基因的表达。miRNA最先是在秀丽线虫中被发现,现已发现miRNA广泛存在于哺乳动物、果蝇和植物等生物中。miRNA基因尽管不编码蛋白,但其编码的RNA在生物整个生命活动中发挥着重要作用。近年来,科学家们在有关牛miRNA的研究方面也做了大量研究,发现miRNA在牛的脂肪沉积与代谢,脂肪细胞生成、增殖与分化过程中起关键作用。本文就miRNA生物合成机制、最新研究进展及在牛脂肪代谢中的研究进行总结,以期为今后更好地发掘牛脂肪组织中miRNA的功能提供参考。
1 miRNA的合成及其作用机制
1.1 miRNA的合成
miRNA是一类由基因组DNA转录生成用于调控RNA的非编码序列。miRNA生物合成过程主要分为在细胞核内和细胞质中2个阶段(图1[1])。首先,在细胞核内RNA聚合酶Ⅱ(RNA polymeraseⅡ)的催化作用下,miRNA相关基因转录得到初级miRNA(pri-miRNA),此时pri-miRNA含有1个茎环,在5′端有帽状结构,3′端包含长达几千核苷酸(nt)的多聚腺苷酸尾状结构。随后内切酶Drosha(RNA聚合酶Ⅲ)与微处理复合物亚基DGCR8结合识别pri-miRNA,将pri-miRNA剪切成60~70 nt的发卡小分子RNA(即pre-miRNA前体),由输出蛋白Exportin-5与RAN-GTP结合蛋白相互作用将pre-miRNA 转运出细胞核[2-3];其次,在细胞质中,premiRNA被Dicer内切酶剪切掉茎环结构后形成长19~25 nt的双链RNA,小分子双链RNA随后结合到(Argonaute)AGO蛋白上形成一个复合物前体(PrimiRISC),miRNA 的过客链(Passenger strand)被 PrimiRISC迅速移去后降解,剩下的成熟导向链(guide strand)与AGO蛋白相互作用形成RNA诱导的沉默复合物(RNA-induced silencing complex,RISC)。关于两条链在RISC复合物中是如何分开、如何外排,此过程目前还没有明确解释。
1.2 miRNA的作用机制
miRNA主要的作用机制是诱导靶mRNA降解或阻止翻译起始,从而在转录后水平实现对靶基因的表达调控,降解靶mRNA序列。miRNA降解mRNA过程:miRNA通过5′端被称为种子序列(Seed sequence)的7nt序列与靶基因mRNA 3′UTR(非编码区)完全互补结合,部分功能性miRNA也可与5′UTR中开放阅读框架结合,RNA诱导基因沉默复合物(RNA-induced silencing complex,RISC)诱导mRNA序列poly-A尾巴脱腺苷酸化随后脱帽[4],使其失去稳定性而降解,mRNA丰度减少,翻译减少。阻止翻译起始:如果miRNA与靶mRNA序列部分互补,通常不会导致mRNA降解[5],而是RISC复合物定位于3′UTR,阻碍起始蛋白与mRNA 5′帽子结合,从而抑制靶mRNA翻译起始[6](图1)。miRNA调控通过RISC复合物完成,AGO家族蛋白是复合物的核心元件,也是miRNA功能途径中的关键蛋白,其能够结合miRNA以及剪切靶标基因。AGO蛋白(Argonaute proteins)由 N末端、PAZ、MID和PIWI四个结构域组成,PIWI区具有切割mRNA的催化中心。通常认为,miRNA与AGO1结合组成miRNA效应器复合物(miRNARISC,miRISC)引导靶mRNA裂解或抑制翻译,这种结合作用主要在植物和果蝇中研究发现[7-8],在哺乳动物中研究较少。然而,miRNA-AGO2机制在哺乳动物中作用显著,AGO2具有RNA酶切活性,催化miRNA切割mRNA[9]。有研究表明,AGO2介导的RNA沉默途径与肿瘤密切相关。Chiyomaru 等[10]研究发现,miR-141 依赖AGO2介导HOTAIR基因沉默,抑制肿瘤增殖。到目前为止,miRNA-AGO2作用机制在生物体内有许多功能不为所知,需要继续探索、发现。
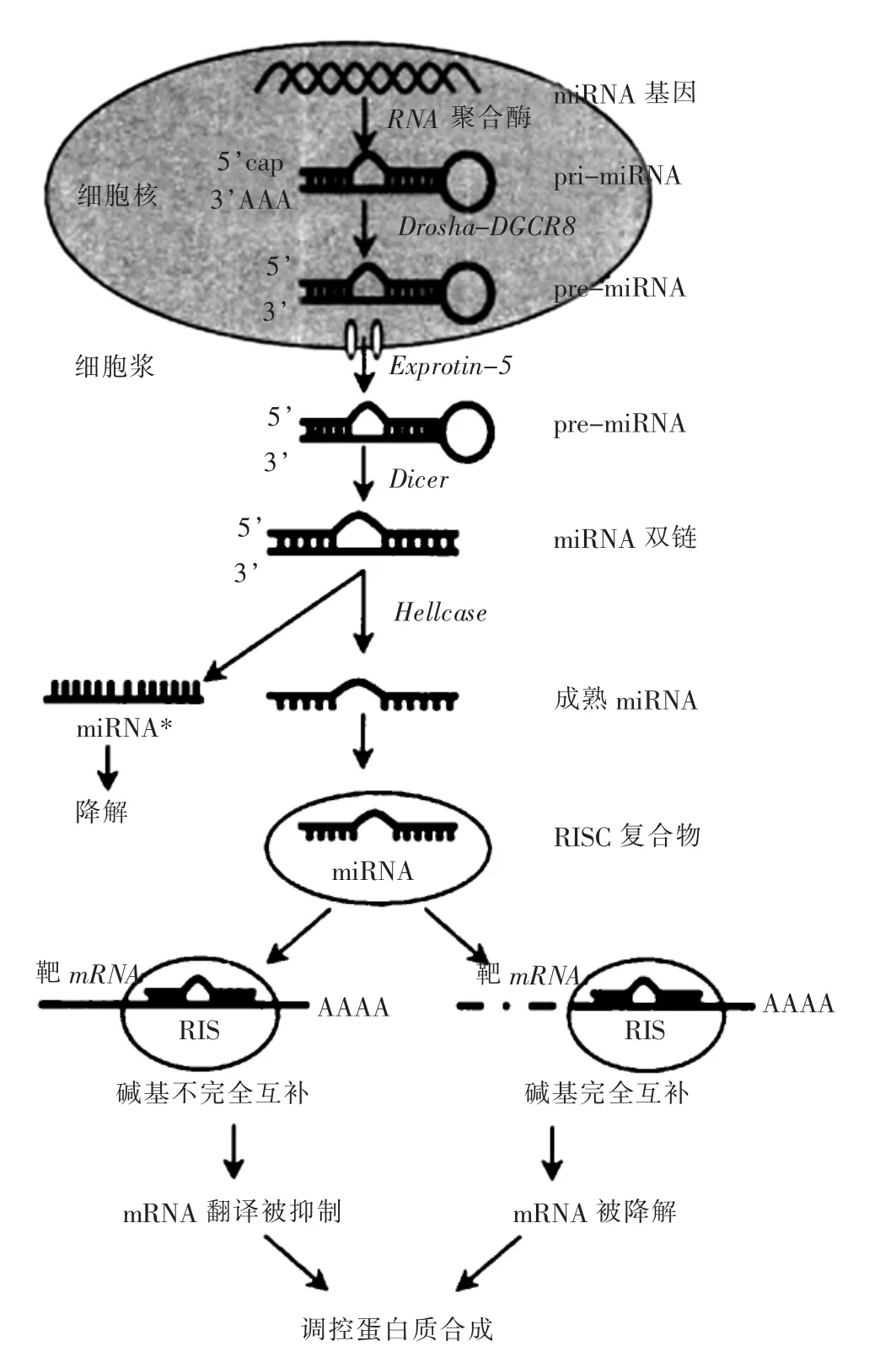
图1miRNA的合成及其作用机制
2 牛脂肪组织中miRNA的相关研究进展
胴体中皮下和肌内脂肪含量是家畜肉品质评价的重要指标,因胴体肌内脂肪较皮下脂肪难沉积而导致肌内脂肪不足和皮下脂肪过多,成为高品质家畜肉质生产的难点之一。近年来,研究人员运用高通量测序技术不断挖掘牛脂肪组织中发挥作用的miRNA并探究其功能,发现其中的 miR-378、miR-27b、miR-320a、miR-2400、miR-23a等发挥重要调控作用。
2.1 miR-378调控脂质代谢的研究
Jin等[11]利用qRT-PCR分析比较了不同背脂厚度杂种阉牛皮下脂肪组织中特异miRNA的表达模式,实验共检测到18个miRNAs的表达与背脂厚度相关,其中miR-378表达显著。Hu等[12]通过对映射激酶介导的PPARγ磷酸化作用抑制脂肪生成的研究发现,816个潜在的靶基因中,其中靶基因MAPK1(蛋白激酶1)可介导脂肪形成转录因子PPARγ(过氧化物酶体增殖物激活受体γ)磷酸化并降低其转录活性。Rangwala等[13]和Rosen等[14]的研究结果表明,PPARγ在牛前脂肪细胞脂肪形成过程中表达量上调,降低PPARγ水平可显著抑制3T3-L1细胞中前脂肪细胞向脂肪细胞的转化[15],推测miR-378通过靶向调控MAPK1和PPARγ来促进牛白色脂肪组织中脂肪的形成。Liu等[16]研究发现,在过表达miR-378的牛脂肪细胞分化过程中,脂滴体积增大,甘油三酯含量增加,说明miR-378可促进牛前体脂肪细胞分化。Kulyté等[17]研究发现,miR-378 过表达会导致人体脂肪细胞脂肪分解加速,而脂肪细胞脂解增强是导致癌症恶病质的原因之一,说明miRNA-378的表达与人患癌症有相关性。也有大量研究发现,miR-378在哺乳动物脂肪细胞分化过程中的调控作用至关重要,且具有保守性。
2.2 miR-27b等其他转录因子对脂质代谢调控作用
Gu等[18]从牛脂肪和乳腺组织中共鉴定出59个不同的miRNA。Moura等[19]通过检测饲喂不同日粮(高或低脂肪含量)对牛皮下脂肪和内脏脂肪的影响,发现在高脂日粮组牛脂肪组织中检测到的miRNA数量高于低脂日粮组牛,其中 miRNA(miR-19a,miR-92a,miR-92b,miR-101,miR-103,miR-106,miR-142-5p 和 miR-296)差异表达显著(P<0.05),说明这 8种 miRNAs相应靶基因可能参与饲喂高脂肪日粮诱导牛脂肪组织脂肪沉积过程。汪海洋等[20]利用miRNA微阵列芯片技术对西门塔尔牛肌内脂肪和皮下脂肪miRNA表达谱进行了检测和分析,发现在差异表达极显著的88个miRNA中,miR-27b等重要miRNA可能以其独特通路(如MAPK信号)来调节牛肌内脂肪的形成。Romao等[21]从3个不同发育时段的8头英国大陆杂种阉牛中获得24个皮下脂肪组织,共检测到224个miRNA,预测其中17个特异性miRNA可能参与调节牛脂肪组织的能量平衡。褚敏[22]利用Solexa高通量测序技术筛选冷暖两季牦牛皮下脂肪及背最长肌miRNAs,并分析其分子代谢通路,结果共检测到70个miRNA在2个季节皮下脂肪组织的表达量达到差异显著水平(P<0.05),其中miR-335、miR-378b、miR-200a、miR-200b、miR-200c 及miR-210对牦牛脂肪代谢起调控作用;皮下脂肪组织差异表达miRNA共预测到815个达到显著水平(P<0.05)的靶基因,主要富集在脂肪细胞生成与代谢、脂肪酸合成与分解等77个通路中。孙加节[23]通过测序筛选秦川牛胎牛期和成年期背部脂肪组织中特异性表达miRNAs,利用qRT-PCR分析发现miRNA-n25和miRNA-n26在脂肪组织中高表达,且在母牛背部脂肪组织中表达量显著上调(P<0.05),其靶基因与脂肪形成或脂滴沉积等过程显著相关(P<0.05)。郭云涛[24]利用 RNA-Seq技术对日本黑毛和牛及荷斯坦牛背部皮下脂肪组织miRNA表达情况进行了比较分析,鉴定出bta-miR-30f、bta-miR-196b和bta-miR-2887等14个上调表达miRNA,3 个下调表达 miRNA(bta-miR-320a、bta-miR-874和bta-miR-1247-3p),预测出15个新miRNA。其中在日本黑毛和牛中下调表达且丰度较高的bta-miR-320a在各物种间较保守,bta-miR-320a启动子区域有多个转录因子结合位点,通过p53(抑癌基因)、细胞周期和MAPK等信号转导通路负调控牛脂肪细胞分化,进而影响牛脂肪沉积。Wei等[25]提出,miR-2400可通过调节靶向PRDM11(转录抑制子)促进前脂肪细胞增殖。Long等[26]从胎牛骨骼肌中分离出血小板源性前体细胞并诱导其成为脂肪细胞。使用miRNAome测序发现,下调bta-miR-23a可以增加脂质积累和C/EBPα(转录因子 CCAAT/增强子结合蛋白 α)、PPARγ及 FABP4(脂肪酸结合蛋白4)的表达,促进牛骨骼肌中脂肪形成,说明在早期肌内脂肪细胞中bta-miR-23a作为一种抗脂肪形成调节因子发挥作用。
2.3 miRNA调控脂质代谢通路
不同研究者在皮下脂肪和肌内脂肪、不同品种牛脂肪组织间及在不同环境或不同饲养条件下的牛脂肪组织中筛选出大量差异表达miRNA,分析miRNA在脂肪组织中的生物学功能及调控机制,也验证了miRNA通过特定信号转导通路参与调节牛脂肪组织中脂肪生成,说明miRNA在牛脂肪组织中发挥重要调控作用,需要不断研究挖掘关键miRNA,并且了解miRNA在牛体内的作用机制和生物学功能,才能将理论运用到实践,指导不同牛品种的培育,获得高品质牛肉。在信号通路研究中,MAPK信号通路对细胞周期运行和基因表达具有重要调控作用,MAPK包括多个成员,是miRNA调控基因表达的重要信号通路,活化后的MAPK成员向核内迁移,磷酸化包括转录因子(如PPARγ)在内的核蛋白和膜受体,实现miRNA对靶基因转录和其他事件的调节,在牛脂肪组织中MAPK与miRNA的调控网络值得深入探究。
miRNA可以稳定地存在于血清和血浆等多种体液中,这类miRNA称为循环miRNA,一般以内分泌或旁分泌的形式发挥作用。研究发现,脂肪细胞间的循环miRNA可调节细胞中脂质生成和积累,且效果显著[27]。Kahn等[28]鉴定出脂肪细胞可通过“外泌体”微小囊泡将miRNA分泌到血液中,且所分泌的miRNA有助于调节肝脏等组织器官,小鼠体内多个循环miRNA均来自脂肪组织,循环miRNA在肝脏中能够调节基因表达。目前,对循环miRNA的生物学功能及作用机制研究较少,牛脂肪组织中相关循环miRNA尚未见报道,但可推测牛体内关键循环miRNA对脂肪组织细胞中脂质生成和积累均具有调节作用,比如皮下脂肪组织与肌肉组织之间是否存在特异循环miRNA参与调节还有待验证。
3 miRNA在牛其他组织中的调控作用
对牛miRNA的研究结果显示,miRNA除了参与调控脂肪生成代谢,对其他器官的发育也发挥着重要调控作用。研究发现,大量miRNA与牛乳腺发育和泌乳繁殖性状相关。李惠侠等[29]应用miRNA基因沉默技术研究了高温条件下miR-24对奶牛乳腺上皮细胞增殖和凋亡的影响,发现miRNA-24对乳腺组织发育具有重要调控作用,抑制miRNA-24的表达可以缓解高温诱导下奶牛乳腺上皮细胞凋亡发生率、促进细胞的生长发育。王杰等[30]也利用基因沉默技术,发现miR-152在奶牛乳腺上皮细胞中通过抑制靶基因SOCS3(细胞因子信号转导抑制蛋白 3)的表达,调控 p-STAT5、p-mTOR、S6K1、cyclinD1信号转导,从而促进乳蛋白合成和乳腺上皮细胞增殖。目前,对miRNA在奶牛乳腺发育中的调控研究已有大量报道,但microRNA在乳腺发育和泌乳等生物学过程中的调节作用还有待研究。此外,部分miRNA对犏牛雄性不育有重要调控作用。李彩霞等[31]通过高通量测序技术,比较分析了牦牛和犏牛睾丸组织中miRNA的数量和种类,筛选出差异显著的10个miRNA,与牦牛相比,犏牛睾丸中有8个miRNA表达上调,2个表达下调。其中miR-34c、miR-34b和miR-355分别与性别决定、附睾及精子发生密切关系,其他7个miRNA可能在牦牛精子发生中起重要调节作用。廖珂[32]为了解miRNA在犏牛睾丸功能发挥及生殖调控过程中的作用,通过对牦牛、普通牛、犏牛睾丸组织中miRNA鉴定及生物学功能研究,发现睾丸组织中表达量较高的miRNA(bta-miR-125a、bta-miR-125b、bta-miR-26a、bta-miR-26b)可调控靶基因,可能与犏牛精子发生阻滞相关。牦牛与普通牛杂交,得到的后代犏牛具有显著的杂种优势,产肉、产乳量均高于牦牛,但表现出雄性不育,杂种优势的利用受到极大限制,目前相关研究报道较少。
4 结语
目前,miRNA在牛脂肪组织及其他组织中的生物学调控作用方面的研究越来越多,利用高通量测序或芯片技术筛选影响牛脂肪细胞分化过程及脂代谢过程中的关键miRNA,利用生物信息学手段预测其靶基因并进行GO功能和KEGG通路分析,得到靶基因在脂肪细胞生成与代谢、脂肪酸合成与分解的信号通路。继而,对牛前脂肪细胞中目标miRNA进行干扰或过表达,根据脂肪细胞分化状态变化和脂质积聚情况验证miRNA调控作用。高通量测序由于测序成本逐年降低和测序技术本身的优势如准确定量和新miRNA的鉴定等原因受到广泛青睐。但是,在对miRNA的研究过程还存在较多疑问,在生物体中,miRNA与靶基因间的调控机制具有一定规律,但对此规律性了解得不够透彻,miRNA对靶基因的调节通过多种组合模式构成一个复杂的调控网络,一个miRNA分子可调控多个靶基因,而一个基因则被多个miRNA分子调控,在某些信号刺激下,从整体上调控有机体的生命活动,在没有彻底理清这个复杂的调控网络前,无法把miRNA功能开发运用到真正的肉牛培育上。目前已有近上万条miRNA被鉴定,miRNA功能分析方法主要依赖GO分类法、信号通路分析和基因调控网络分析,但均存在不足,导致绝大多数miRNA的功能尚不明确,所以开发高效的生物信息分析工具也是未来研究中急需解决的主要问题。现阶段处于挖掘牛新的miRNA及其功能的实验探索时期,相信不久的将来,miRNA在调控牛生长发育、改良肉品质、调节脂肪代谢、均衡牛营养水平等方面的作用将有突破性进展,进而在牛肉生产中实现量与质的飞跃。

