小尾寒羊GnRH基因CDS区的生物信息学分析
黄冬丽,丁功涛,王福彬
(西北民族大学生命科学与工程学院,兰州 730124)
促性腺释放激素(Gonadotropin-releasing hormone,GnRH),是一种由下丘脑分泌,用来刺激或抑制垂体促性腺激素的分泌,以调控脊椎动物生殖系统功能的十肽神经激素[1]。内源性GnRH是由下丘脑的GnRH神经元合成并释放,通过垂体门静脉系统作用于垂体前叶的GnRH受体,从而刺激垂体合成并释放促黄体生成激素(Luteinizing hormone,LH)和促卵泡激素(Folliclestimulating hormone,FSH)[2-5]。自 1971 年从猪和羊的脑分离出GnRH以来,到目前GnRH家族至少已有28个类型,其中15种来自脊椎动物,13种来自无脊椎动物。除章鱼GnRH外,所有GnRH肽都由10个氨基酸组成,其分子长度和部分氨基酸序列非常保守。哺乳动物的GnRH基因内有3个内含子和4个外显子,属单拷贝基因,其中第2、3个外显子和部分第4个外显子编码GnRH蛋白前体[3]。
目前,国内对于GnRH的研究大多集中在基因克隆与表达方面,但对编码蛋白的性质和功能及基因的同源性方面的研究却鲜有报道[6-7]。因此,为深入研究小尾寒羊GnRH基因编码蛋白的性质、功能及基因的同源性,本研究采用生物信息学方法对小尾寒羊GnRH基因编码产物的理化特性和蛋白质结构功能进行了预测分析;同时借助MEGA软件构建系统发育进化树,对GnRH基因在不同物种间的同源性进行分析,以期为今后关于GnRH基因多态性及功能的研究提供理论基础。
1 材料与方法
1.1 小尾寒羊GnRH基因序列来源
小尾寒羊的GnRH基因CDS区序列由NCBI上查找获得(GeneBank no:NM-00100937)。
1.2 方法
对小尾寒羊GnRH基因CDS编码产物的理化特性、功能预测及基因的同源性进化关系的分析与预测所用的软件及网址见表1。

表1 对小尾寒羊GnRH基因进行生物信息学分析的主要软件
2 结果与分析
2.1 小尾寒羊GnRH基因CDS区编码蛋白质理化性质
小尾寒羊的GnRH基因CDS区编码蛋白质理化性质分析结果表明,羊的GnRH基因CDS区编码328个氨基酸。20种氨基酸所占数量如图1所示,其中占整个氨基酸组成比重最大的为亮氨酸(Leu),占比49%;比重最小的为谷氨酸(Glu),占比5%。负电荷残基总数(Asp+Glu)15,正电荷残基总数(Arg+Lys)27,其分子式C1762H2696N432O446S20,分子质量37 708 kDa,基因编码产物半衰期30 h,等电点9.39,不稳定指数32.51,其中不稳定指数小于40,可判定该基因编码产物为稳定蛋白。
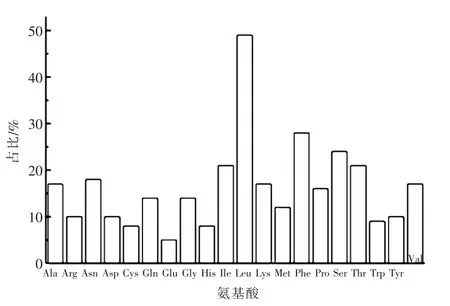
图1 小尾寒羊GnRH基因CDS区编码蛋白的氨基酸组成预测
2.2 小尾寒羊GnRH基因CDS区编码蛋白质的亲疏水性预测
小尾寒羊GnRH基因CDS区编码氨基酸序列亲水性/疏水性预测结果如图2所示,其中第225位亮氨酸(Leu)疏水性最强,疏水分值+3.300;第68位的谷氨酸(Glu)亲水性最强,亲水分值-3.311。整条氨基酸肽链中,亲水氨基酸占32.5%,疏水氨基酸占67.5%,总平均疏水性分值+0.175,总体表现为疏水性,故可推断小尾寒羊GnRH基因CDS区编码产物是一种不溶于水的蛋白质。
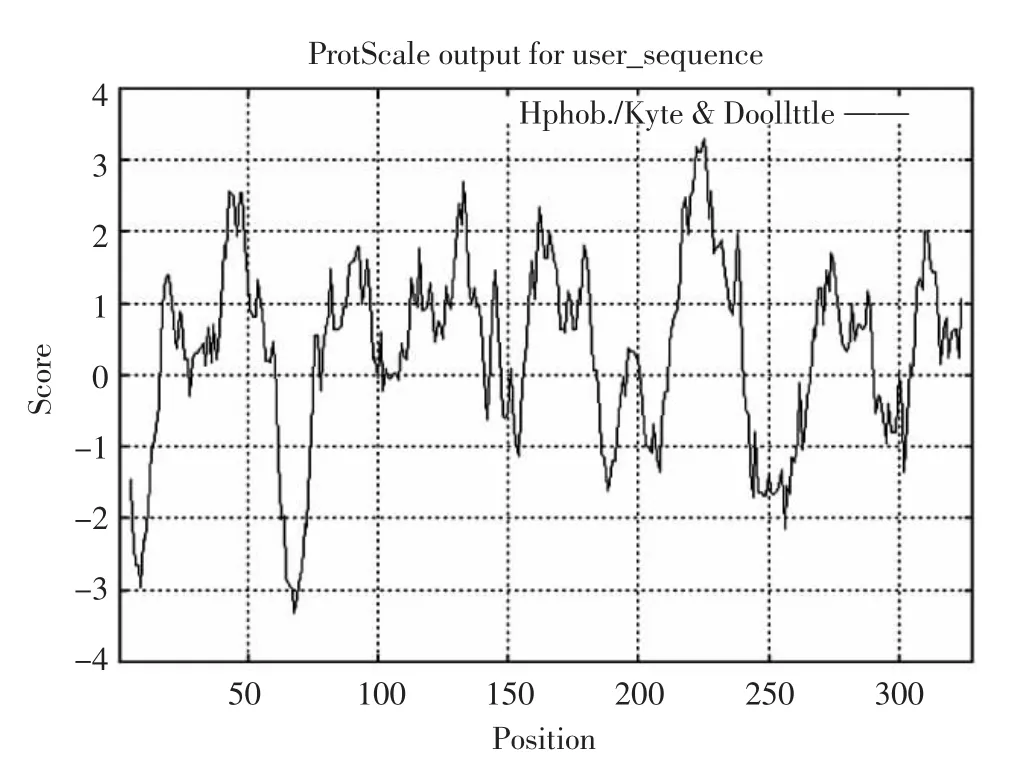
图2 小尾寒羊GnRH基因CDS区编码的蛋白质疏水性/亲水性预测分析
2.3 小尾寒羊GnRH基因CDS区编码的蛋白质结构预测
2.3.1 小尾寒羊GnRH基因CDS区编码蛋白质二级结构分析 如图3所示,二级结构组分中α-螺旋(Hh)、β-折叠(Ee)、β-转角(Tt)和无规则卷曲(Cc)分别占37.20%、25.61%、2.74%、34.45%。从中可以看出,GnRH基因编码的二级结构中α-螺旋占主导地位,其次是无规则卷曲。根据二级结构中α-螺旋所占比例小于40%,无规则卷曲所占比例大于20%,故可以推断该基因编码的蛋白质为混合型二级结构。

图3 小尾寒羊GnRH基因CDS区编码蛋白质的二级结构预测
2.3.2 小尾寒羊GnRH基因CDS区编码蛋白质三级结构分析 由图4可知,小尾寒羊GnRH基因CDS区编码蛋白三级结构中主要成分也是α-螺旋和无规则卷曲,与二级结构预测结果相符。
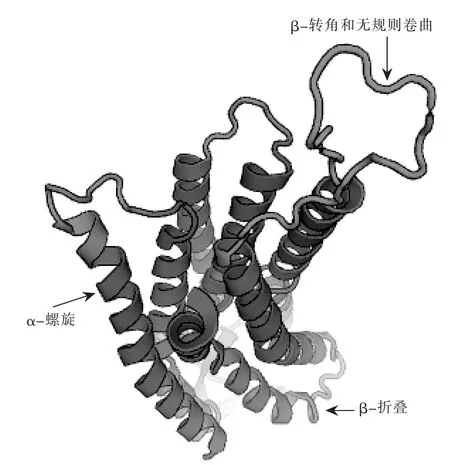
图4 小尾寒羊GnRH基因CDS区编码蛋白质的三级结构预测
2.4 小尾寒羊GnRH基因CDS区编码的蛋白质功能预测
小尾寒羊GnRH基因CDS区编码的蛋白质功能预测结果表明(表2),该蛋白在信号转导、免疫应答过程以及生长因子和荷尔蒙分泌中发挥作用的几率相对较高,分别为1.271%、1.447%、2.857%和17.528%。从中可以看出,在荷尔蒙分泌中发挥作用的几率最高,这表明GnRH基因在动物机体性激素的释放上发挥关键作用;同时,还可以预测GnRH基因在羊的生长代谢和免疫调节上也发挥重要作用,与羊繁殖力的提高显著相关[8-9]。
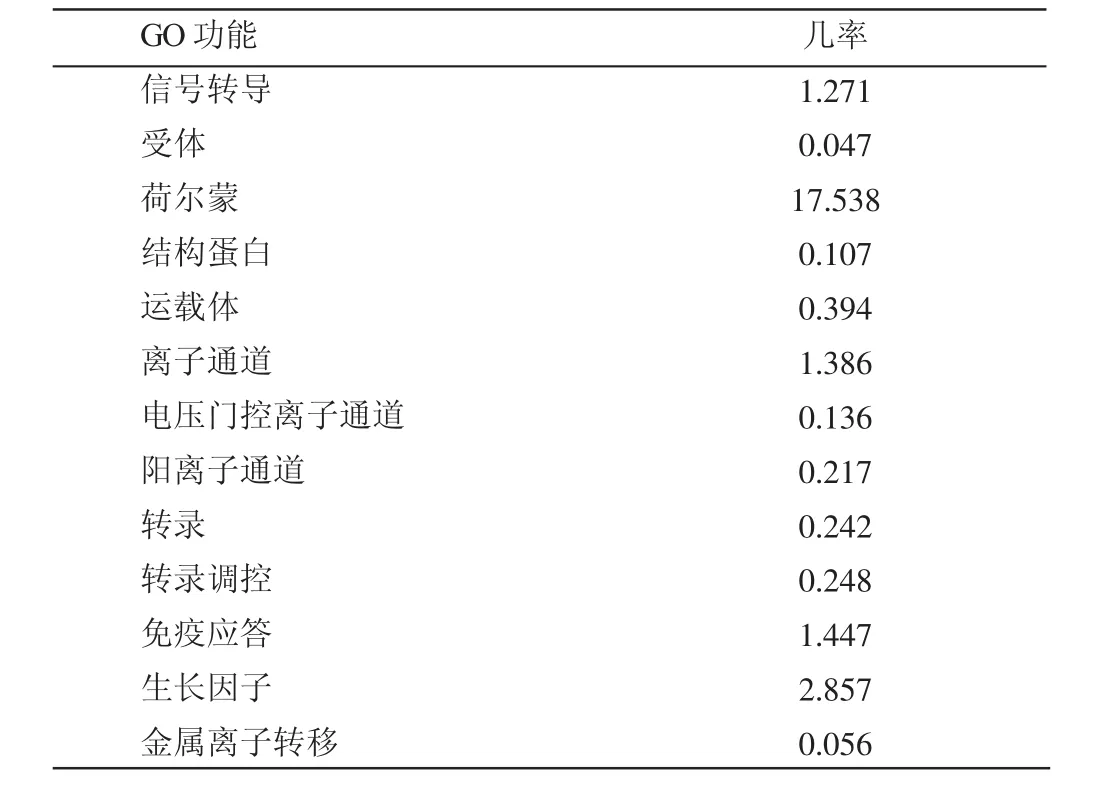
表2 小尾寒羊GnRH基因CDS区编码蛋白质功能预测%
2.5 小尾寒羊GnRH基因系统发育进化树构建
使用MEGA软件对11个物种GnRH基因编码产物进行同源性分析,并构建发育进化树(图5)。结果表明,不同物种之间的GnRH基因在进化上具有高度的同源性和保守性,在多数哺乳动物中都有表达[10],其中,小尾寒羊与山羊GnRH基因的同源性最高。同时还发现,偶蹄目的绵羊、山羊、水牛和牦牛等亲缘关系较近,GnRH基因同源性较高;而与灵长目、啮齿目、翼手目和鲸目的亲缘关系较远,GnRH基因同源性较低。
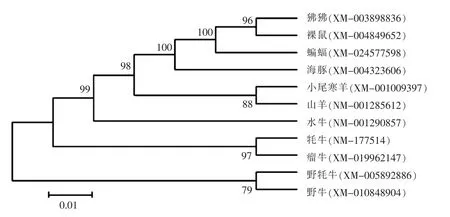
图5 小尾寒羊GnRH基因系统发育树
3 讨论
GnRH基因通过指导蛋白质的合成,控制蛋白质结构,从而间接地对生物体性状发挥作用。本研究通过生物信息学方法对小尾寒羊GnRH基因CDS区编码的蛋白质的理化性质、结构功能以及基因的同源关系进行分析,并对结果进行讨论。对蛋白质的理化性质分析结果表明,GnRH基因CDS区由96个碱基对组成,共编码328个氨基酸,编码产物具有较长的半衰期和较高的稳定系数,蛋白质总体表现为不溶于水的稳定蛋白。贾浩等[11]研究发现,蛋白质的半衰期与稳定系数成正比,半衰期越长稳定系数越高,这与本研究分析结果一致。
蛋白质的生物学活性不仅决定于蛋白质分子的一级结构,而且与其特定的空间结构密切相关。因此,在对蛋白质的功能进行预测分析时,就必须要清楚蛋白质的空间结构组成。本研究通过生物信息学方法对蛋白质的二级结构和三级结构进行预测分析,结果表明该基因编码产物的二级结构主要由α-螺旋和无规则卷曲构成,它们的占比分别为37.20%和34.45%。由于无规则卷曲(Cc)所占比例大于20%,α-螺旋(Hh)所占比例小于45%,因此可以推断,该基因编码蛋白质的二级结构为混合型。由于蛋白质的二级结构中α-螺旋的占比较大,因此该基因编码产物较稳定,这与蛋白质理化性质的分析结果一致。
在预测分析蛋白质功能的结果中发现,该蛋白在信号转导、免疫应答过程以及生长因子和荷尔蒙分泌中发挥作用的几率相对较高,由此说明GnRH基因CDS区编码的蛋白质对生殖过程中性激素的分泌调控起着中心作用,是性行为的重要介导者[12]。GnRH虽在动物体内含量极低,但却发挥着及其重要的作用,它不仅调节动物机体的生殖过程,还对动物机体的免疫应答和生长代谢起着重要作用[13]。最新研究表明,肿瘤细胞中的GnRH可抑制癌细胞的增殖,并且GnRH还对消化系统的功能起调节作用。
最后,在对小尾寒羊GnRH基因同源关系进行分析的结果中发现,小尾寒羊与山羊GnRH基因同源性最高,亲缘关系最近;同时在对牛科动物GnRH基因进行分析时发现,小尾寒羊与其基因的同源性也较高。在动物分类学上,牛和羊同属牛科,分属于不同亚科,因此,本研究可以为今后关于GnRH基因在不同亚科动物之间功能的联系提供理论基础。

