栉孔扇贝Foxl2蛋白的原核表达、纯化及多克隆抗体制备与检测
刘晓玲,王振东,孙涵甜,王振华,赵振军,李 忌
(烟台大学生命科学学院,山东烟台 264005)
Foxl2(forkhead box l2)是叉头框转录因子基因,研究发现其在脊椎动物卵巢中高表达,而在精巢中弱表达或不表达[1],深入的功能研究表明,该基因参与哺乳动物卵巢功能维持[1-2]。该基因在无脊椎动物中的相关研究相当有限,在海胆 (Strongylocentrotus purpuratus)[3]、皮 海 绵(Suberites domuncula)[4]、太 平 洋 牡 蛎(Crassostrea gigas)[5]和 栉 孔 扇 贝 (Chlamys farreri)[6]中有表达研究,且其表达研究主要集中在转录水平:其中 TU等[3]对紫色球海胆的Foxl2研究仅发现胚胎期都有表达,是一种合子基因,未有深入研究。DHEILLY等[5]利用基因芯片技术通过差异检测发现Foxl2在太平洋牡蛎中是雌性相关基因,在卵巢中特异表达。刘晓玲等[7]发现Foxl2在成体栉孔扇贝中具与已报道的脊椎动物一样的明显性别二态性表达,推测该基因在性别稳定的无脊椎动物栉孔扇贝的卵巢中发挥一定功能。LI等[8]通过转录组测序发现Foxl2在虾夷扇贝 (Patinopecten yessoensis)卵巢中高表达,推测参与卵巢决定和分化。然而上述无脊椎Foxl2的性别相关表达研究仅集中在转录水平,仅ADELL等[4]利用免疫组化技术对皮海绵的Sd-Foxl2进行了蛋白水平表达检测,发现在各种细胞中都有表达,认为在皮海绵中该基因不是性别相关基因。
综上,Foxl2基因在低等动物中的功能尚需深入研究。在前期研究的基础上,本研究继续选取性别稳定的栉孔扇贝为研究对象,通过PCR克隆栉孔扇贝Foxl2基因,构建了大肠杆菌表达载体并诱导获得重组蛋白,纯化后制备了多克隆抗体,探索了Foxl2蛋白在性腺中的表达,旨在为进一步研究Foxl2在栉孔扇贝卵巢中的作用奠定实验基础。
1 材料与方法
1.1 材料
栉孔扇贝cDNA、质粒及菌种cDNA均由本实验室制备,DH5α、BL21(DE3)及载 pET-28a等则购自宝生物工程(大连)有限公司。
1.2 试剂与仪器
限制性内切酶 EcoRΙ和 HindIII、T4 DNA连接酶等工具酶以及IPTG等购自宝生物工程 (大连)有限公司;PCR反应体系、质粒提取试剂盒、DNA回收试剂盒、Ni-NTA蛋白纯化试剂盒、DNA Marker、动物组织总蛋白提取试剂盒、羊抗兔IgG购自生工生物工程 (上海)股份有限公司;蛋白Marker购自北京经科宏达生物技术有限公司;新西兰大白兔 (New Zealand white rabbits)由烟台绿叶制药公司提供,弗氏完全佐剂及弗氏不完全佐剂、考马斯亮蓝染色液、脱色液等购自德国Sigma公司,PVDF膜购自博士德公司。
仪器包括:摇床DYY-Ⅲ型稳流稳压电泳仪(北京市六一仪器厂);高速冷冻离心机5810R型(Eppendorf公司);凝胶成像系统(美国 UVP公司);NANODROP 1000核酸蛋白测定仪 (Thermo公司);TC-XP型基因扩增仪 (杭州博日科技有限公司);RT-6000酶标分析仪(Rayto公司)。
1.3 引物设计
根据栉孔扇贝 Foxl2基因cDNA全长(GenBank JN642286)[7]设计引物,以期扩增获得其完整的开放阅读框。对其阅读框内所含的酶切位点及pET-28a载体多克隆位点进行分析,在上下游引物中增加EcoRΙ和HindIII两个酶切位点序列(下划线),引物由华大基因公司合成,序列如下:5′GAATTCATGGCCTTGTCATTTTACGA 3′;5′AAGCTTTCACCTCTCTCCCCAGTATG3′。
1.4 目的基因PCR扩增、TA克隆及质粒提取
采用柱式动物RNAout试剂盒(北京天恩泽公司)提取栉孔扇贝卵巢RNA,cDNA反转录试剂盒(大连宝生物公司)反转录形成cDNA,以此cDNA为模板,构建如下20μL PCR体系:10×PCR buffer 2.0μL;MgCl2(25 mM)1.6μL;dNTP(10 mM)0.4μL;引物 (10μM)各2.0μL;Taq DNA聚合酶 (5UμL-1)0.2μL;cDNA模板 1 μL,ddH2O补齐。反应条件为:95℃预变性5 min;95℃变性30 s,57℃退火35 s,72℃延伸90 s,30个循环;72℃充分延伸10 min。产物电泳鉴定后TA连接,转化DH5α,筛选阳性克隆后提取质粒。
1.5 重组表达质粒构建与测序鉴定
上述提取的质粒与pET-28a分别进行EcoRΙ和HindIII双酶切,对酶切产物进行胶回收,T4连接酶16℃温育连接过夜,连接产物转化感受态DH5α,卡那霉素及菌落PCR筛选阳性克隆,提取质粒双酶切鉴定,对应菌株送华大基因测序。
1.6 重组质粒提取及BL21转化
将测序结果与栉孔扇贝Foxl2基因序列一致的阳性菌株大量培养,提取质粒后转化感受态BL21,卡那霉素筛选阳性克隆,并再次测序验证序列。
1.7 蛋白诱导条件优化与表达
分别取阳性克隆30 mL,37℃培养至OD 600 nm达0.6左右,分别加入IPTG至终浓度为0.2、0.4、0.8、1.0、1.2 mmol·L-1,诱导 6 h对 IPTG诱导浓度进行优化。
1.8 目标蛋白的SDS-PAGE分析及镍柱纯化
取含重组质粒的诱导后菌液4 000 r·min-1离心5 min,收集沉淀,加入无菌1×PBS溶液悬浮,于冰浴中200 W超声波破碎细胞。分别取全细胞、12 000 r·min-1离心后的上清和沉淀进行SDS-PAGE分析以确定重组蛋白的可溶性。
大量诱导的菌液,用Ni-NTA蛋白纯化试剂盒中的Binding/wash buffer(含有终浓度为8 M的尿素)溶解(包涵体),室温下温育30~60 min。待温育完全后,12 000 r·min-1离心30 min,将上清进行Ni柱亲和层析纯化,核酸蛋白测定仪检测纯化蛋白浓度。
1.9 抗体制备与检测
取200μg纯化后的重组Foxl2蛋白,与弗式完全佐剂按1∶1的体积比乳化完全(油包水状),采用背部皮下多点注射的方法分别免疫两只雄性新西兰大白兔;两周后取100μg纯化的Foxl2蛋白与弗式不完全佐剂按1∶1的体积比乳化完全,进行二次免疫,两周后以同样的方法进行第三次免疫,一周后取血,4℃静置24 h后,血液变为胶冻状,5 000 rpm离心10 min,收集上层血清。
以纯化后的Foxl2蛋白为抗原,将制备的抗体血清按照1∶200~1∶256 000倍稀释,采用HRP(辣根过氧化物酶)标记的羊抗兔IgG为二抗,进行间接ELISA分析,当OD450nm=1.0时,抗血清的稀释度即为抗体效价[9]
WB(Western blot)分析所制备抗体的特异性,利用蛋白提取试剂盒(上海生工生物工程公司)提取扇贝成体精卵巢组织蛋白,分别进行SDS-PAGE电泳(兔抗β-actin多抗调平组织蛋白上样量),将蛋白转到PVDF膜上,用稀释到1∶2 000的所制抗体血清进行孵育,洗膜后再用羊抗兔IgG孵育后显色,凝胶成像系统拍照观察结果。
2 结果与分析
2.1 PCR扩增得到的Foxl2基因
如图1所示,利用设计的引物扩增目的基因,获得与预期大小(1 119 bp,含引物中增加的酶切位点序列)相符的片段。

图1 Foxl2基因PCR扩增结果Fig.1 PCR amplification results of Foxl2 gene注:1:Foxl2基因扩增产物;M:DL2000 DNA markerNotes:1:Foxl2 PCR amplification product;M:DL2000 DNA marker
2.2 重组质粒p ET-28a的构建与鉴定结果
目的基因与pET-28a连接后转化感受态DH5α,选阳性克隆提取重组质粒pET-28a进行双酶切鉴定,结果如图2显示:酶切后出现与目的条带大小吻合的片段。选取对应的阳性菌株送华大基因有限公司完成DNA序列测序,结果显示与扇贝Foxl2基因序列完全一致。提取质粒转入BL21后再次测序仍与目的基因序列一致。

图2 重组载体的酶切鉴定Fig.2 Identification of recombinant vector by enzyme digestion注:M1:DL2000 DNA marker;1:双酶切重组质粒 pET-28a(箭头所指为酶切后的目的条带,另一条为酶切后的pET-28a);M2:λDNA/HindIII MarkerNotes:M1:DL2000 DNA marker;1:recombinant plasmid pET-28a digested by double restriction enzymes(arrow represents the objective gene fragment,the other band is pET-28a after enzyme digestion);M2:λDNA/HindIII Marker
2.3 重组蛋白的表达与鉴定(含条件优化)结果
对IPTG诱导浓度进行优化,结果如图3所示,IPTG终浓度在1.0 mmol L-1以内时,诱导效果随IPTG浓度增加而增强,故选择1.0 mmol L-1为最终诱导浓度。
对含空质粒及含重组质粒的菌液诱导6 h后进行SDS-PAGE电泳分析,结果如图4所示,与对应含空载体pET-28a的菌液相比,含重组载体的菌液经6 h诱导后约在46 KD(采用Dnastar软件预测Foxl2蛋白分子量约为41.96 KD,载体上融合表达的标签约3.7 KD)左右出现较粗的蛋白条带。
收集细菌超声破碎后,离心获得沉淀和上清,SDS-PAGE电泳结果显示:重组蛋白主要存在于沉淀中,说明pET-28a原核表达的Foxl2蛋白产物主要以包涵体形式存在。
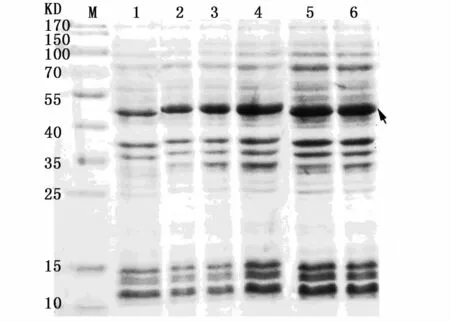
图3 IPTG浓度对诱导效果的影响Fig.3 Induction effect of different IPTG concentrations注:1:IPTG终浓度为 0 mmol·L-1;2:IPTG终浓度为 0.2 mmol·L-1;3:IPTG浓度为0.4 mmol·L-1;4:IPTG浓度为0.8 mmol·L-1;5:IPTG浓度为 1.0 mmol·L-1;6:IPTG浓度为1.2 mmol·L-1;箭头所指为目的蛋白Notes:1:IPTG final concentration was 0 mmol·L-1;2:IPTG final concentration was 0.2 mmol· L-1;3: IPTG final concentration was 0.4 mmol·L-1;4:IPTG final concentration was 0.8 mmol·L-1;5:IPTG final concentration was 1.0 mmol·L-1;6:IPTG final concentration was 1.2 mmol·L-1;the arrow shows interest protein

图4 诱导蛋白SDS-PAGE图Fig.4 SDS-PAGE of induced protein注:1:空质粒菌液全细胞;2:空质粒菌液上清;3:空质粒菌液沉淀;4:重组质粒菌液全细胞;5:重组质粒菌液上清;6:重组质粒菌液沉淀;箭头所指为目的蛋白Notes:1:whole cell with empty plasmid;2:supernatant with empty plasmid;3:precipitation with empty plasmid;4:whole cell with recombinant plasmid;5:supernatant with recombinant plasmid;6:precipitation with recombinant plasmid;the arrow shows interest protein
2.4 包涵体的溶解与纯化结果
包涵体用含8 M尿素的Binding/wash buffer(Ni-NTA蛋白试剂盒中提供)溶解,利用Ni柱进行目的蛋白纯化,结果如图5所示,获得目的蛋白,进一步测得纯化所得蛋白浓度为800μg mL-1。

图5 蛋白纯化SDS-PAGE图Fig.5 SDS-PAGE of purified protein注:1:纯化前蛋白;2:过柱流出液;3:纯化后蛋白;箭头所指为目的蛋白Notes:1:protein before purified;2:column effluent;3:purified protein;the arrow shows interest protein
2.5 多克隆抗体的制备与鉴定
ELISA效价测定显示所制备抗体效价大于1:128 000。WB结果显示所制备抗体血清能特异识别扇贝卵巢中42 KD左右蛋白(与Foxl2大小吻合),Foxl2蛋白在卵巢中表达,而精巢中几乎不表达。

图6 栉孔扇贝性腺组织中Foxl2蛋白表达的Western blot图Fig.6 Western blot of Foxl2 protein expression in gonads of scallop Chlamys farreri注:1:卵巢;2:精巢Note:1:Ovary;2:Spermary
3 讨论
本研究中含Foxl2基因重组pET-28a载体的大肠杆菌在37℃诱导系统中有表达,但主要以不溶性包涵体形式存在,实验尝试用较低温度条件诱导表达,其表达的目的蛋白仍不可溶,或与表达的Foxl2蛋白偏大有关,通常大肠杆菌所表达的胞质蛋白大于100个氨基酸,则容易形成包涵体[10]。本研究中,包涵体经尿素溶解后纯化所得蛋白免疫新西兰大白兔,所得抗体效价高、特异性强,已能满足后续研究需要。
在哺乳动物中Foxl2基因被认为是卵巢分化的早期标记分子[11],对其功能研究发现,该基因可调节卵巢颗粒细胞分化,在卵巢发育及功能维持方面发挥作用[12]。而该基因在无脊椎动物中的功能研究极少见报道,LIU等[6,13]通过对栉孔扇贝中Foxl2 mRNA水平表达模式研究,推测其在成体卵巢发育及幼贝卵巢分化中发挥作用,其具体功能研究有待进行。
Foxl2属于叉头框转录因子家族,其功能主要依靠蛋白水平对其他基因的调控来发挥[14-15],对于哺乳动物Foxl2基因的研究发现其蛋白水平与mRNA水平的表达与定位存在差异,小鼠卵母细胞中可定位到该基因的mRNA[16],小鼠和山羊的睾丸中也可检测到该基因的mRNA[16-17],但对哺乳动物 Foxl2蛋白的表达研究却发现,其仅在卵巢颗粒细胞中表达,而在精巢和卵母细胞中不表达[11],故有研究者认为该蛋白最终是通过调节卵巢颗粒细胞增殖的方式发挥作用[1]。无脊椎动物中Foxl2的表达研究多集中在RNA水平,仅在皮海绵中通过免疫组化研究了Foxl2蛋白的表达,却显示其在各类细胞中都有所表达[4],Foxl2蛋白在无脊椎动物中的表达模式仍不明确。本研究通过制备栉孔扇贝Foxl2多克隆抗体,进一步通过WB检测到Foxl2在卵巢中强表达,而在精巢中几乎不表达,该结果与刘晓玲等[7]对栉孔扇贝成体性腺中RNA的表达模式相吻合,也与 LI等[8]对虾夷扇贝中Foxl2转录水平表达的研究相符,推测该蛋白在扇贝卵巢中发挥重要作用。
对栉孔扇贝Foxl2蛋白进行体外表达及抗体制备可为扇贝卵巢中该蛋白的具体细胞定位提供分子工具,从而为进一步研究其在贝类卵巢中的作用机制奠定实验基础。
4 小结
本研究首次在大肠杆菌原核表达系统中表达出栉孔扇贝的Foxl2蛋白,其在BL21中主要以包涵体形式高效表达,经纯化后获得的Foxl2具强免疫原性,免疫新西兰大白兔获得效价高且能特异识别天然Foxl2的多克隆抗体,用WB检测发现Foxl2蛋白在栉孔扇贝成体中呈雌性性别相关表达,该表达模式暗示Foxl2蛋白在栉孔扇贝卵巢中发挥重要功能。

