DCE-MRI定量诊断宫颈癌的价值研究*
1.广州市第一人民医院(广东 广州 510180)
2.广州市红十字会医院(广东 广州 510180)
宫颈癌是最常见的恶性肿瘤之一,居我国妇科恶性肿瘤第二位,其早期的诊断和治疗,对愈后具有重要意义[1]。磁共振成像技术因其有较高的软组织分辨力已成为术前评价宫颈癌肿瘤大小、浸润深度和术前分期最有价值的影像学方法[2]。磁共振动态增强成像(DCE-MRI)是通过对比增强无创地反应肿瘤与组织血管特性的一种磁共振功能成像方法。通过观察病灶强化特征、计算早期增强率、绘制时间-信号强度曲线(time-signal intensity curve,TIC)和计算各种定量参数等对DCE-MRI进行定性、半定量、定量分析,分析病灶血流动力学特点,对肿瘤分子生物学特性进行间接性分析,进一步评估肿瘤的微环境[3]。本研究探讨DCE-MRI对宫颈癌的诊断效能,以期为宫颈癌的诊断、分期提供新的依据。
1 材料与方法
1.1 研究对象选择2013年1月~2015年3月在广州市第一人民医院经病理证实的30例中晚期宫颈癌患者。年龄33~67岁[平均(48±10)岁]。选取患者的正常子宫肌层作为对照组。
1.2 仪器与方法采用SIEMENSMagnetomVerio3.0T磁共振扫描仪,平扫扫描序列有:轴位T1WI、T2WI、矢状位T2WI、冠状压脂T2WI。DCE-MR序列如下:注射对比剂前校正T1 VIBE横断扫描(TR=5.08ms,TE=1.74ms,平均次数8次,矩阵138×192,体素1.9×1.4×3.6mm,层厚3.6mm,层间距3.6mm×20%,反转角2°、15°)。定量动态增强扫描参数:翻转角15°,TR=4.24ms,TE=1.66ms,层厚3.6mm,矩阵138×192,体素1.9×1.4×3.6mm,采集次数35次,扫描时间共5分31秒。采用钆喷酸葡胺(Gd-DTPA)对比剂注射液20ml,以3ml/s速率高压注射器注入,以20ml生理盐水助推。扫描结束后将数据导入工作站(syngo Multimodality Workplace)。
随后对所得出SI-Time曲线进行分型及评价。按参考文献[4]提出的TIC曲线分类方法分三型:I型“持续型”,在整个动态增强观察时间内信号强度有迅速增加;II型“速升平稳型”,早期信号强化可迅速增加,达到一定值后信号强度的增加速度明显变缓,形成相对静止的平台;III型“流出型”,早期信号强度可增加,达到高峰后信号强度的增加突然中断,随后信号强度下降,呈廓清状态。应用4Dtissue软件,采用Tofts双室的药物代谢动力学模型,对DCE-MRI数据进行定量分析与评估。定量参数主要包括:Ktrans、Kep及Ve。
1.3 统计处理选用Medcalc软件及SPSS13.0软件进行资料录入及统计学分析。数据以(±s)表示,肿瘤与子宫肌层组间血管功能参数比较釆用独立样本t检验。P<0.05为有统计学意义。
2 结 果
2.1 宫颈癌组织与子宫肌层TIC曲线宫颈癌以III型曲线为主,如图(1、2),I型1例(3.33%),II型3例(10%),III型26例(86.67%);子宫肌层以I型曲线为主,如图(3、4),I型18例(60%),II型12例(40%)。
2.2 肿瘤组织与子宫肌层间的各定量参数比较宫颈癌组与正常子宫肌层组各定量参数比较结果如下(见表1、图5-9)。宫颈癌组的Ktrans、Kep、Ve值明显高于正常子宫肌层组,差异有统计学意义(P<0.05)。
3 讨 论
磁共振动态增强成像(DCEMRI)定性分析主要是通过对图像进行直观的观察而进行评价分析,使用方便,但它有较多的主观性,更适合于筛选,不能满足大部分病例的诊断要求。半定量分析基于时间-信号强度曲线TIC,可通过多种指标对组织强化进行分析,时间-信号强度曲线反映了病变的血流灌注和流出等多种要素。DCE-MRI的定量分析以药代动力学模型为基础,量化分析各定量参数:转运常数Ktrans、血管外细胞空间(EES)体积百分数Ve和速率常数Kep。转运常数Ktrans代表单位时间内每单位体积组织内从血液进入血管外细胞外间隙的对比剂量,血管外细胞空间体积百分数Ve代表单位体积组织内血管外细胞外空间的体积。速率常数Kep代表单位时间内由EES进入血管的对比剂量。三者间的关系如下:Kep=Ktrans/Ve。目前各种不同的设备所使用的定量分析模型及处理软件不同,由于不同的模型存在一定的假设条件,所得的定量参数也就存在一定的误差,要得到最优化的模型还需要进一步的探索研究。本研究采用Tofts模型,Tofts模型是目前被广泛应用于临床中的开放的双室药代动力学模型,表现了对比剂在组织间隙和血液间交换的动力学过程。以往的灌注成像多为半定量分析,不够精确。我们通过DCE-MRI的定量分析,有望为宫颈癌的诊断、分期提供新的依据,从而为其治疗提供有意义的参考。
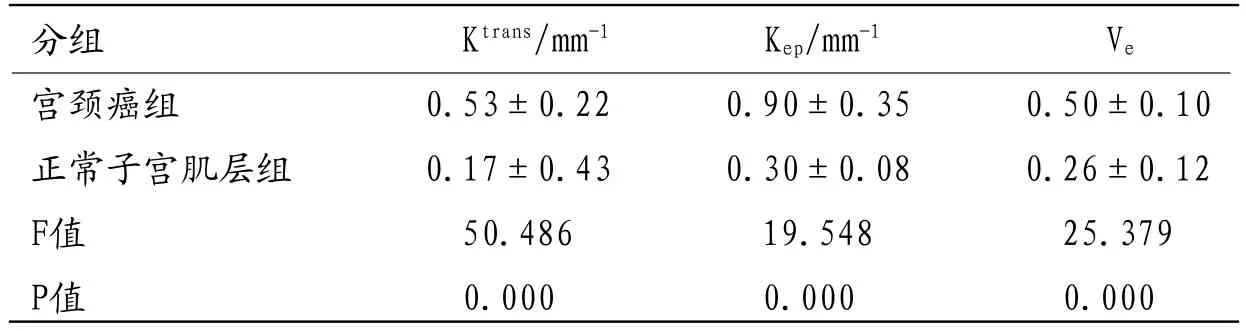
表1 宫颈癌组与正常子宫肌层组定量参数值比较
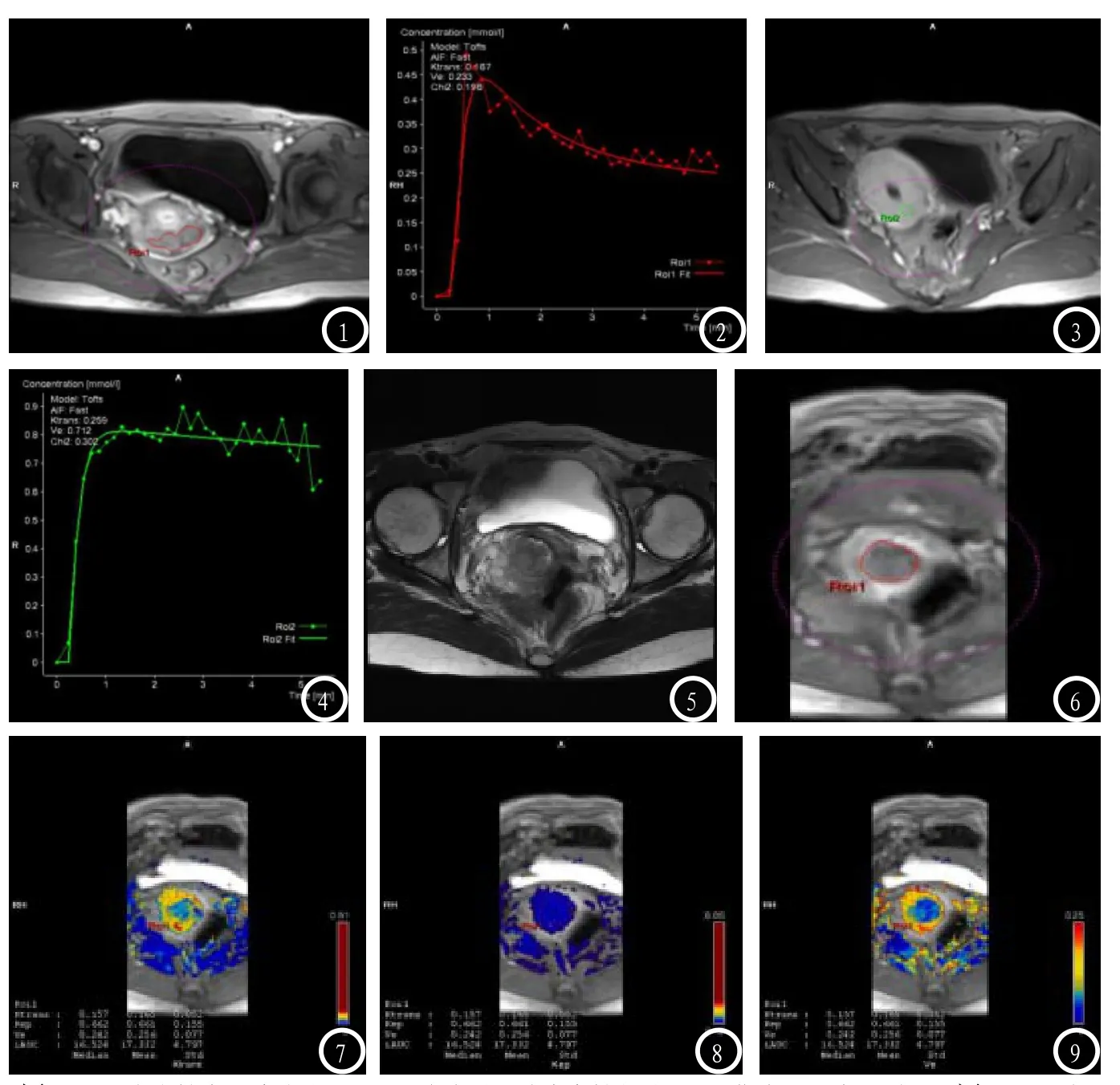
图1-2 47岁女性宫颈癌患者,ROI区域放置于肿瘤实性部分,TIC曲线呈“流出型”;图3-4 正常子宫肌层TIC曲线,表现为“平台型”。图5-9分别为T2WI轴位、肿瘤ROI区域(ROI1)、Ktrans图、Kep图、Ve图。42岁女性患者,宫颈癌IIb期,肿瘤ROI区域各项定量参数值如图所示。
研究表明宫颈癌强化模式主要为“流出型”,增强早期明显强化,表现为高信号,增强中期肿瘤强化程度减弱,晚期肿瘤进一步减弱呈低信号。本组子宫颈癌患者治疗前TIC曲线以III型为主(86.67%,26/30),与既往文献报道[5]相似。这主要是由于肿瘤组织新生的血管明显增多,其微血管密度明显高于正常组织[6],但是肿瘤组织的新生微血管不成熟,基底膜不完整,内皮细胞间隔增宽,异常的基底膜及内皮细胞覆盖都将导致微血管通透性增加,再加上动静脉短路等原因,都将使对比剂早期容易从血管内大量进入组织内,表现为早期的明显强化,同样对比剂也容易从组织内进入血管腔,快速廓清,表现为快进快出的强化模式。文献报道正常子宫肌层多表现为缓慢渐进性的强化特征[5]。这主要是由于其血管内皮结构完整,DCE-MRI扫描时,对比剂逐渐聚集于组织间隙形成的。本组病例显示子宫肌层TIC曲线大部分表现为I型曲线,这与既往文献报道[5]相似。与定量分析相比,TIC曲线分析比较简便、直观,对软件要求低,并可对数据进行量化分析,因此是目前最为广泛应用的分析方法,在肿瘤的诊断、分期和疗效评估等方面均有较大价值。但是半定量分析也存在许多局限性,如良、恶性病变的时间-信号强度曲线类型存在叠加,不能仅仅依靠曲线类型辨别良、恶性;不能准确地反映组织内对比剂浓度的变化、不能直接反映组织的生理信息等,所以说半定量分析不够精确。这些局限性在定量分析中有所克服。定量参数可以更准确、如实地反映组织内对比剂的浓度变化和肿瘤内部的血流动力学信息,直接反映组织生理学信息。通过引入Toft模型得到的定量参数可反映肿瘤的生理状态,通过定量分析可以评估动脉与组织间隙之间的对比剂浓度变化的差异,在肿瘤磁共振成像研究领域得到广泛的应用[7]。
王大伟[8]等研究表明乳腺恶性病变的Ktrans值、Kep值明显高于良性病变。朱海滨等[6]对前列腺定量参数分析显示,肿瘤组织的Ktrans值、Kep值明显高于正常外周带。国内外对宫颈癌的定量磁共振动态增强扫描各参数值研究较少,Lankester等[9]对20例妇科肿瘤患者进行T1WI动态增强扫描,结果显示宫颈癌的Ktrans值约0.393(范围为0.192-1.081mm-1);Kep值约为0.967(范围约0.449-2.684mm-1);Ve值约40.8%(范围约27.1-65.2)。虞祝娟等[10]研究表明宫颈癌组Ktrans、Kep、Ve值较正常组明显升高,宫颈癌组的Ktrans值约(0.65±0.34)mm-1,Kep值约为(0.94±0.40)mm-1,Ve值约为(0.45±0.12)mm-1;正常宫颈组的Ktrans值约(0.16±0.44)mm-1,Kep值约为(0.34±0.11)mm-1,Ve值约为(0.25±0.13)mm-1。
本次研究显示宫颈癌的Ktrans值约为(0.53±0.22),Kep值约为(0.90±0.35),Ve值约为(0.50±0.10),与文献报道相符。同时宫颈癌的Ktrans值、Kep值、Ve值明显高于正常肌层组织,且差异有显著性,与既往研究相仿。分析原因这种差异与宫颈癌组织的生物学特征和病理生理学有关:宫颈癌细胞生长旺盛,新生血管增多明显,微血管密度增加显著,但血管基底膜及内皮细胞生长异常,血管通透性明显增高,注入对比剂后,对比剂交换加快,表现为高灌注,对比剂从新生的血管内流入血管外间隙速度加快,Ktrans值增大;同样对比剂从血管外间隙回流入血管内的速度也增快,故Kep值升高;另外细胞周围间隙松散,血管外细胞外间隙增加,Ve值增大。而正常子宫肌层组织新生血管较少,血管内皮生长相对完整,对比剂交换较慢,血流灌注相对较低,对比剂从血管内流入血管外间隙速度慢,回流速度也慢,Ktrans、Ve、Kep值均较小,因此宫颈癌组织的Ktrans、Kep、Ve值明显高于子宫肌层。
综上所述,DCE-MRI对宫颈癌的诊断具有一定的价值。

