导电性生物炭促进Geobacter和Methanosarcina共培养体系互营产甲烷过程
李坚 ,汤佳,庄莉,许杰龙*
1.中国科学院广州地球化学研究所,广东 广州 510640;2. 中国科学院大学,北京 100039;3.广东省生态环境技术研究所,广东 广州 510650;4. 厦门市环境科学研究院,福建 厦门 361006
长期以来,微生物互营过程中的电子转移机制是“种间氢转移”或“种间甲酸转移”,互营微生物以“氢气”或“甲酸”作为电子载体进行微生物间的电子传递(刘鹏飞等,2013;Stams et al.,2009;Sieber et al.,2012)。“种间直接电子传递”(direct interspecies electron transfer,DIET)是最新被发现的一种互营机制,它与传统“种间氢转移”或“种间甲酸转移”的本质区别在于互营微生物之间的电子转移不依赖化学物质作为载体,而是通过微生物自身产生的导电性鞭毛、分泌的细胞色素或外源导电物质进行直接电子传递(Shrestha et al.,2014;Lovley,2017a,2017b)。在DIET过程中,电子传递不受氢气或甲酸扩散速度的影响,极大地提高了电子传递效率,且简单直接的传递步骤为微生物节省更多能量,节省的能量可供自身生长利用,因而具有“经济”与“高效”的特点(Lovley,2011a,2011b,2011c)。DIET可能是微生物为提高互营协作效率进化形成的一种有效的电子传递方式,是研究微生物互营过程及机制的新思路。
目前,研究者们提出了 3种可能的种间直接电子传递方式:(1)导电性菌毛(纳米导线),比如地杆菌(Geobacter)产生的菌毛具有类似金属的导电性,与互营微生物形成的团聚体具有导电性,电子供体微生物产生电子通过菌毛直接传递至电子受体微生物(Summers et al.,2010;Shrestha et al.,2013;Rotaru et al.,2014a,2014b);(2)细胞色素 c,比如甲烷氧化菌 ANME-2氧化甲烷产生的电子通过外膜细胞色素 c传递至胞外,然后通过细胞间隙的细胞色素将电子直接传递至硫酸还原菌的外膜细胞色素(McGlynn et al.,2015);(3)导电物质,以具有导电性的颗粒物质作为电子供体微生物和电子受体微生物之间直接电子传递的“导管”,目前已证实具有这种功能的导电物质有导电性铁氧化物、生物炭、活性炭等(Liu et al.,2012,2015;Chen et al.,2014a,2014b;Tang et al.,2016)。
目前关于 DIET的报道主要集中在地杆菌和地杆菌之间,以及地杆菌与产甲烷菌之间的互营过程。已证实具有DIET功能的微生物主要包括Geobacter metallireducens、 Geobacter sulfurreducens、Methanosarcina barkeri和 Methanosaeta harundinacea(Lovley,2017a,2017b)。Morita et al.(2011)首次在啤酒废水厌氧污泥床的颗粒污泥中发现了DIET介导的产甲烷过程,因为颗粒污泥中H2/甲酸介导的产甲烷速率远远低于乙醇降解速率,作者推测体系中可能还存在其他互营途径,由于颗粒污泥中微生物形成的团聚体具有“类金属”的强导电性,因此作者提出直接电子传递在互营产甲烷过程中的可能性,并推测团聚体中的主要细菌Geobacter通过自身的导电性菌毛与产甲烷菌Methanosaeta进行直接电子传递。Rotaru et al.(2014a)通过Geobacter metallireducens和Methanosarcina barkeri和Geobacter metallireducens和Methanosaeta harundinacea(Rotaru et al.,2014b)纯菌共培养体系,进一步直接证实了DIET介导的乙醇互营氧化产甲烷过程。
目前已证实的地杆菌与产甲烷菌之间的直接电子传递都以乙醇为电子供体,在乙醇互营氧化产甲烷过程中,Geobacter氧化乙醇产生的电子通过导电性菌毛直接传递至产甲烷菌还原 CO2产生甲烷,这个过程产生的中间产物乙酸由乙酸营养型产甲烷菌利用而产生甲烷。乙酸是有机物厌氧降解产甲烷过程中的重要中间产物,尽管 Kato et al.(2012a)认为当导电性磁铁矿/赤铁矿存在时,Geobacter氧化乙酸产生的电子能直接传递给Methanosarcina还原CO2产生甲烷,但还未在纯菌共培养体系中得到验证。本实验以具有DIET功能的 Geobacter sulfurreducens和 Methanosarcina barkeri为研究对象,构建Geobacter sulfurreducens和Methanosarcina barkeri共培养体系,以生物炭的导电性为切入点,研究共培养体系中乙酸产甲烷的代谢过程和电子传递途径,以期为揭示DIET对乙酸产甲烷过程的影响机制和温室气体排放或清洁能源生产提供科学依据。
1 材料与方法
1.1 微生物、培养基和培养条件
实验所用的微生物分别为 Geobacter sulfurreducens(DSM12127)和 Methanosarcina barkeri(DSM800),购买于德国菌种保藏中心(DSMZ)。Geobacter sulfurreducens的培养基为NBAF(Coppi et al.,2001),Methanosarcina barkeri培养基为120(Bryant et al.,1987)。所有的培养操作都是在严格厌氧条件下进行,培养基在121 ℃灭菌20 min后,通入N2/CO2(80%∶20%)混合气1 h至形成充分厌氧状态。以10 mmol·L-1乙酸作为电子供体,40 mmol·L-1延胡索酸作为电子受体在NBAF培养基中培养Geobacter sulfurreducens;以乙酸为产甲烷基质在 120培养基中培养 Methanosarcina barkeri。Geobacter sulfurreducens和 Methanosarcina barkeri的培养温度分别为30 ℃和37 ℃。
1.2 生物炭的制备及理化性质的测定
所用的生物炭以水稻秸秆为原料制备,炭化前先将水稻秸秆的穗部、叶子和根部去除,茎秆部分剪成2~3 cm长的小片段,置于烘箱中80 ℃下烘干。将预处理后的水稻秸秆装入石英管(长1.2 m,内径7 cm)后,管口密封并通入氮气(1.5 L·min-1),然后置于电阻炉上以20 ℃·min-1的速率加热至恒定的温度(本实验用400 ℃和900 ℃)并维持1 h。持续通N2条件下自然冷却至室温后,用蒸馏水清洗去除杂质,105 ℃烘干干燥,研磨成约0.15 mm大小的碳颗粒,并过100目筛子,于干燥器中贮存备用。
生物炭的元素组成用元素分析仪(Vario EL Cube,Elementar Co.,德国)测定(Yu et al.,2015);电导率的测定方法参照Mochidzuki et al.(2003)和Xu et al.(2013)提出的双探针床法进行测定,具体而言,双探针床由压力装置、手持欧姆表和带有两个不锈钢活塞(分别位于顶部和底部)的圆柱形铁床构成,铁床的内表面内嵌聚丙烯材料,与生物炭完全绝缘,大约放置1.0 g的生物炭于铁床内,在施加4 MPa的高压时,记录整个铁床的电阻即可得到该生物炭的电导率;表面官能团通过红外光谱仪(NICOLET iS50FT-IR Thermo)进行测定。
本文中生物炭-1是指在 900 ℃炭化的秸秆生物炭,生物炭-2是指在400 ℃炭化的秸秆生物炭。
在培养实验中,生物炭加入培养基溶液后于121 ℃灭菌20 min。
1.3 共培养实验
构建共培养体系前分别培养 Geobacter sulfurreducens和Methanosarcina barkeri,收集对数生长期的微生物,离心后(8000 r·min-1,10 min)弃去上清液,重新悬浮于新鲜的不含有电子供体和电子受体的培养基中,重复操作3次。共培养体系在20 mL厌氧管中进行,其中含有6 mL培养基、0.5 mL Geobacter sulfurreducens和 0.5 mL Methanosarcina barkeri以及25 mmol乙酸,通入混合气除氧后密封,置于 37 ℃恒温培养箱中避光静止培养。
不同导电性生物炭对产甲烷过程的影响实验设计处理如下:(1)Geobacter sulfurreducens+Methanosarcina barkeri(biochar-free);(2)Geobacter sulfurreducens+Methanosarcina barkeri+12 g·L-1导电或非导电生物炭(12 g·L-1);(3)Geobacter sulfurreducens+Methanosarcina barkeri+25 g·L-1导电或非导电生物炭(25 g·L-1);(4)Geobacter sulfurreducens+Methanosarcina barkeri+50 g·L-1导电或非导电生物炭(50 g·L-1)。培养过程中,定点采样监测甲烷产量和微生物生长量。导电生物炭促进乙酸互营氧化产甲烷的实验设计如下:(1)Geobacter sulfurreducens+Methanosarcina barkeri+25 g·L-1导电或非导电生物炭(MB+25 g·L-1biochar-1+GS,MB+25 g·L-1biochar-2+ GS);(2)Methanosarcina barkeri+导电或非导电 25 g·L-1生物炭(MB+25 g·L-1biochar-1,MB+25 g·L-1biochar-2)。培养过程中定点监测甲烷产量和微生物生长量,并在培养结束后通过扫描电镜观察添加导电生物炭的共培养体系中 Geobacter sulfurreducens和Methanosarcina barkeri的空间分布状况。生物炭Eh对产甲烷的抑制实验设计如下:(1)Geobacter sulfurreducens+Methanosarcina barkeri(biochar-free);(2)Geobacter sulfurreducens+Methanosarcina barkeri+还原剂处理后的生物炭(treated biochar);(3)Geobacter sulfurreducens+Methanosarcina barkeri+未处理生物炭(untreated biochar)。
1.4 Geobacter sulfurreducens和Methanosarcina barkeri的荧光定量分析
通过荧光定量PCR仪(iQ5TM,伯乐生命医学产品有限公司)对 Geobacter sulfurreducens和Methanosarcina barkeri的数量进行测定(Summers et al.,2010;Kato et al.,2012a;Tang et al.,2016)。利用16S rRNA基因作为qPCR扩增模板,qPCR反应体系见表1。Geobacter sulfurreducens正向引物序列(Geo494F)为 5’-AGGAAGCACCGGCTAACT CC-3′,反向引物(Geo825R)序列为 5’-TACCCG CRACACCTAGT-3′。Methanosarcina barkeri 定量PCR 正向引物序列(ME1)为 5’-GCMATGCARA THGGWATGTC-3’,反向引物(MCR1R)序列为5’-ARCCADATYTGRTCRTA-3’。Geobacter扩增条件为95 ℃预变性4 min;95 ℃变性20 s,51 ℃退火20 s,72 ℃延伸30 s,35个循环;72 ℃延伸7 min。Methanosarcina扩增条件:95 ℃预变性4 min;95 ℃变性30 s,50 ℃退火60 s,72 ℃延伸60 s,40个循环。

表1 Geobacter sulfurreducens和Methanosarcina barkeri定量PCR的扩增反应体系Table 1 Real-time PCR of Geobacter sulfurreducens and Methanosarcina barkeri 16S rRNA gene
2 结果分析
2.1 生物炭的理化特性
两种生物炭的元素分析及导电特性的检测结果如表2所示,两者的碳、氮、氢、氧等元素含量差异不大,但是导电率差异较大,生物炭-1的导电率为 2.4 S·cm-1,有较强的导电性,生物炭-2只有3.4×10-6S·cm-1,几乎没有导电性。对两种生物炭进行红外光谱分析,结果如图1所示,两种生物炭表面官能团在吸收峰3435、1630、1082 cm-1处存在差异,3435 cm-1是-OH基团的吸收峰,代表着酚羟基或醇羟基的存在;1630 cm-1是C=C和C=O双键基团的吸收峰,代表着芳香化程度;1082 cm-1是C-O基团的吸收峰(Uchimiya et al.,2011a,2011b),红外结果初步表明生物炭-1的羟基、C-O基团和双键基团的含量低于生物炭-2。
2.2 不同导电性生物炭对产甲烷过程的影响
以乙酸为电子供体,向Geobacter sulfurreducens和Methanosarcina barkeri的共培养体系添加不同质量浓度(12、25和50 g·L-1)的生物炭-1和生物炭-2。如图2所示,生物炭的类型及浓度都影响共培养体系的甲烷产生过程,而且不同类型生物炭之间的差异非常明显。在添加生物炭-1的共培养体系中,与不添加生物炭的对照相比,12 g·L-1生物炭-1抑制了体系前10天的产甲烷活动,25 g·L-1生物炭-1抑制了前15天的产甲烷活动,但在培养后期它们的甲烷产量(约 0.14 mmol)都高于对照(约 0.13 mmol);50 g·L-1生物炭-1的产甲烷量(约0.11 mmol)则一直低于对照。从产甲烷速率来看(时间-甲烷量曲线的斜率),添加12、25和50 g·L-1生物炭-1体系的产甲烷速率分别在 6(0.015 mmol·d-1)、9(0.016 mmol·d-1)、18(0.017 mmol·d-1)天后开始明显高于对照处理。与生物炭-1不同,添加不具导电性的生物炭-2对甲烷产量抑制效应明显,且浓度越高抑制程度越高(图2b)。由此可见,生物炭的导电性质是影响共培养体系产甲烷过程的重要因素。
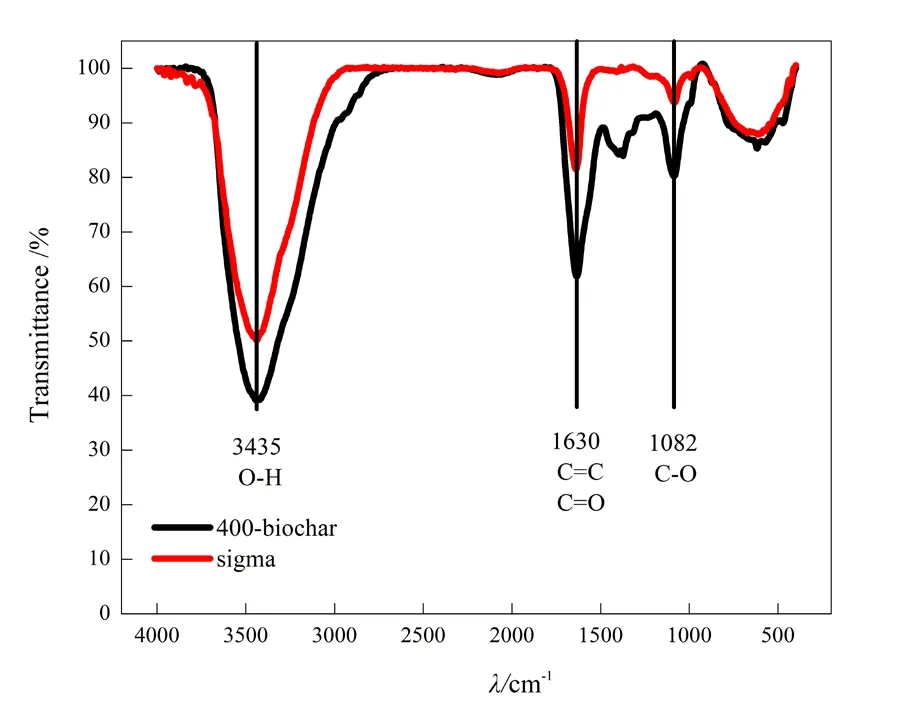
图1 生物炭的红外吸收光谱Fig. 1 Infrared spectra of biochar
采用定量PCR方法,观察了添加25 g·L-1生物炭-1的共培养体系中的 Methanosarcina barkeri和Geobacter sulfurreducens的生长情况(图 3)。Methanosarcina barkeri和Geobacter sulfurreducens的起始浓度分别为 5.48±0.22~5.78±0.24×106和3.24±0.15~3.6±0.21×106(单位为基因拷贝数/反应体系),随着培养的持续进行,微生物量不断增加,表明这两种微生物都通过代谢活动获得生长。生物炭-1对Methanosarcina barkeri微生物量的影响与其对甲烷产生量的影响规律一致;生物炭-1对Geobacter sulfurreducens的生长有促进作用,而生物炭-2对Geobacter sulfurreducens的生长则没有显著的影响。这说明在添加生物炭-1的条件下,共培养体系中 Geobacter sulfurreducens参与了代谢活动,这可能是:(1)生物炭的还原过程;(2)与Methanosarcina barkeri互营氧化乙酸产甲烷过程。
已有文献报道生物炭可被 Geobacter sulfurreducens用作胞外呼吸的电子受体(Yu et al.,2016)。以乙酸为电子供体,生物炭为电子受体,通过Geobacter sulfurreducens菌16S rRNA基因拷贝数的荧光定量PCR测定反映其生长情况(图4)。与不添加生物炭的处理相比,添加生物炭处理中的Geobacter sulfurreducens数量增长并不明显,培养期间最高基因拷贝数仅为起始数量的1.8~2.1倍。但是添加生物炭-1的共培养体系中 Geobacter sulfurreducens数量增长了近2个数量级(图3),这说明生物炭的微生物还原过程并不能完全解释共培养体系中Geobacter sulfurreducens的生长,这意味着Geobacter sulfurreducens还参与了其他代谢活动,即与Methanosarcina barkeri互营氧化乙酸产甲烷。
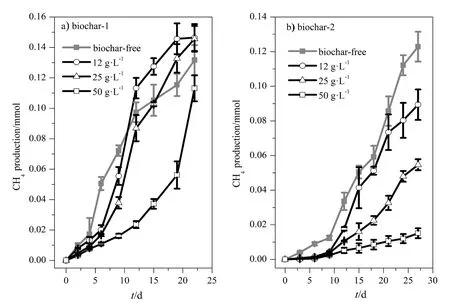
图2 Geobacter sulfurreducens和Methanosarcina barkeri共培养体系添加不同生物炭的甲烷产生量-时间动力曲线Fig. 2 Methane production in the co-culture of Geobacter sulfurreducens and Methanosarcina barkeri supplemented with different concentrations of conductive biochar-1 (a) and non-conductive biochar-2 (b)The error bars represent the standard deviations of the mean of three independent cultures. The same below
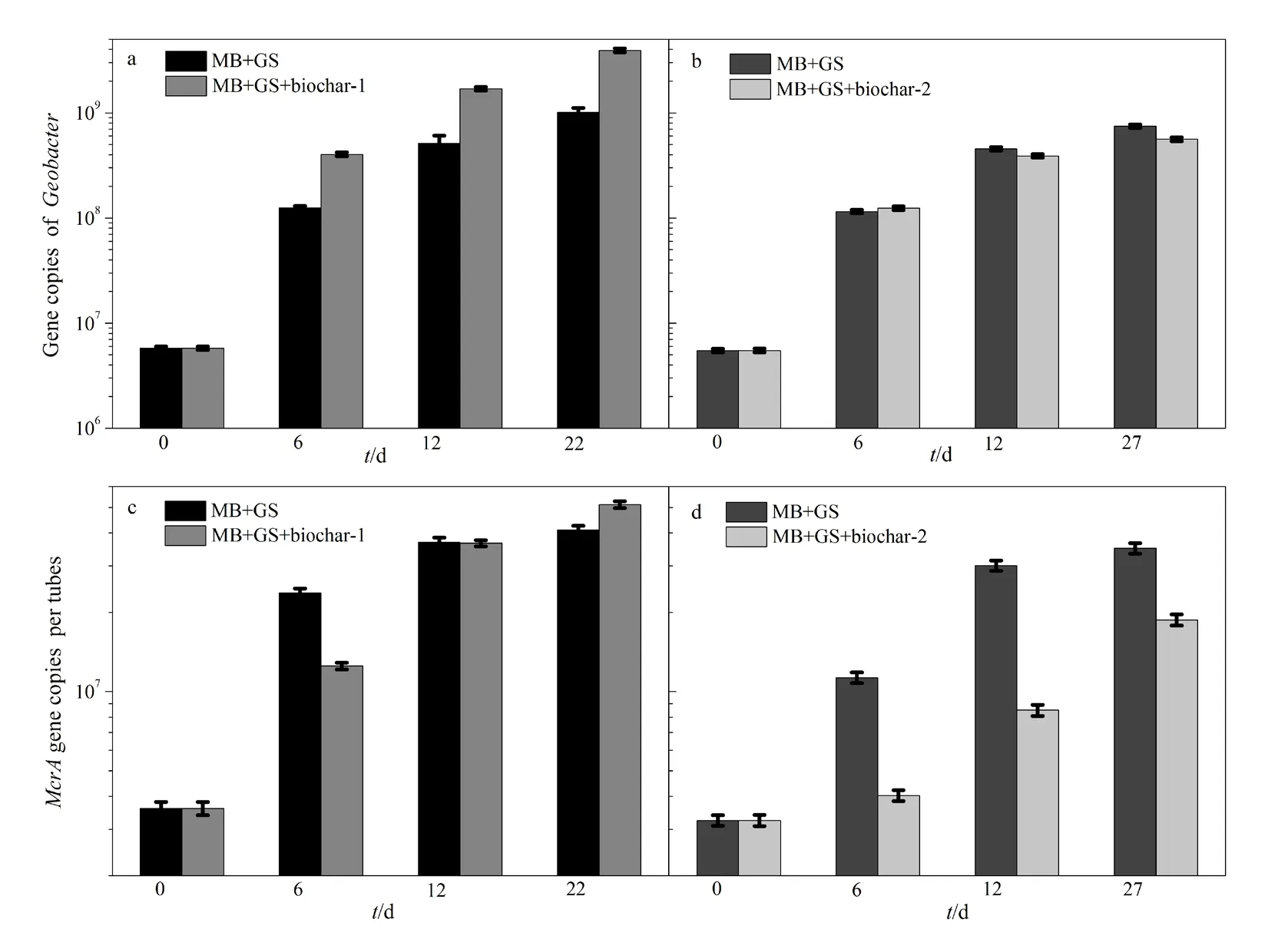
图3 Geobacter sulfurreducens和Methanosarcina barkeri共培养体系(添加和不添加生物炭-1)中Geobacter的基因拷贝数(a,b)和Methanosarcina的基因拷贝数(c,d)Fig. 3 The gene copy number of Geobacter in the co-culture of Geobacter sulfurreducens (GS) and Methanosarcina barkeri (MB) with and without 25 g·L-1 biochar-1 (a, b); mcrA gene copy number in the co-culture of Geobactersulfurreducens and Methanosarcina barkeri with and without 25 g·L-1 biochar-1 (c, d)
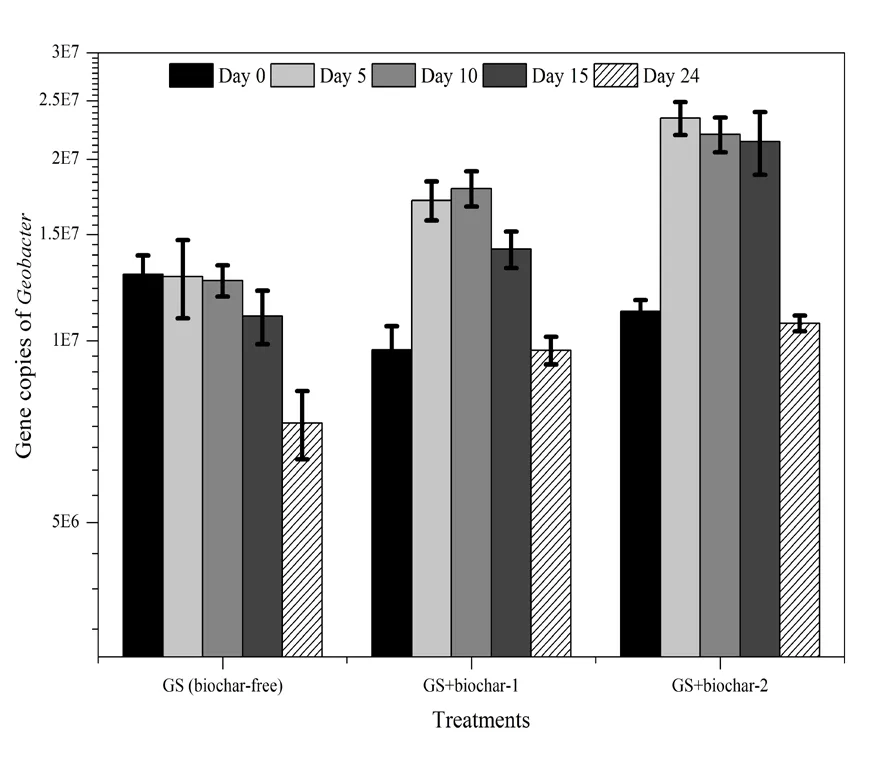
图4 生物炭作为电子受体时Geobacter sulfurreducens的生长情况Fig. 4 The gene copy number of pure culture Geobacter sulfurreducens degrading acetate with and without the two types of biochar(The concentration of biochar was 25 g·L-1)
2.3 导电性生物炭促进互营氧化乙酸产甲烷过程
为了进一步验证共培养体系中 Geobacter sulfurreducens是否参与互营氧化乙酸产甲烷过程,本实验对比了 Methanosarcina barkeri的单菌体系和Geobacter sulfurreducens+Methanosarcina barkeri共培养体系在添加不同生物炭条件下的产甲烷过程。结果表明(图5),添加生物炭-1的的单菌体系在培养22 d后的甲烷产量为0.095 mmol,在相同培养时间内,添加生物炭-1的共培养体系的甲烷产量达到0.146 mmol;而在添加生物炭-2的条件下,单菌体系和共培养体系的甲烷产量非常接近。通过定量 PCR方法监测单菌体系和共培养体系中的Methanosarcina barkeri的生长情况(图5c和5d),其趋势符合甲烷产量的规律。这表明在添加导电生物炭-1体系中,Geobacter sulfurreducens的存在可有效促进产甲烷过程,但在不导电生物炭-2体系中不起作用。由此可推测:(1)Geobacter sulfurreducens参与了产甲烷过程;(2)生物炭的导电性对Geobacter sulfurreducens和Methanosarcina barkeri介导的产甲烷过程至关重要。通过扫描电镜进一步观察 Geobacter sulfurreducens与 Methanosarcina barkeri在导电生物炭上的分布情况。Geobacter sulfurreducens的细胞形态为棒杆状(Summers et al.,2010),而 Methanosarcina barkeri的细胞形态为球菌叠堆状(Liu et al.,2012),二者形态差异显著。观察电镜图(图6)细胞形态可知,Geobacter sulfurreducens和 Methanosarcina barkeri并没有直接接触,但都紧紧吸附于生物炭表面。
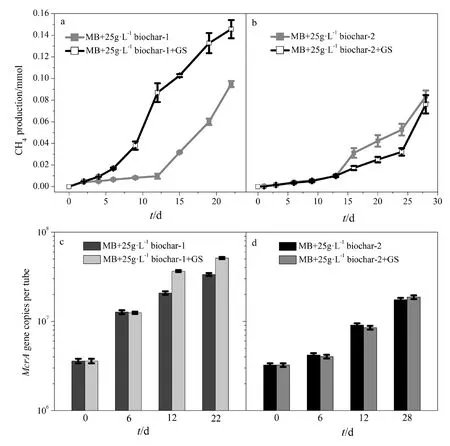
图5 Geobacter sulfurreducens 对甲烷产生量(a,b)和甲烷菌(b,d)的影响Fig. 5 The role of Geobacter sulfurreducens (GS) in methane production by Methanosarcina barkeri (MB) in the presence of 25 g·L-1 conductive biochar-1(a, c) and non-conductive biochar-2 (b, d)

图6 添加生物炭-1的Geobacter sulfurreducens and Methanosarcina barkeri共培养体系SEM图Fig. 6 Scanning electron micrography of biochar-amended co-culture of Geobacter sulfurreducens (rods) and Methanosarcina barkeri (spheres)The white arrows denote the representative microbes
2.4 生物炭的Eh对产甲烷的抑制
以上实验表明,导电性生物炭介导了Geobacter sulfurreducens和 Methanosarcina barkeri之间的直接电子传递,从而促进了产甲烷过程。但是,生物炭暂时性抑制共培养体系产甲烷过程(图 2)的原因不明。生物炭的结构和性质相对复杂,含有丰富的官能团,其存在会造成环境因子的改变。比如,土壤施加生物炭会改变营养元素的生物可利用性、pH值、氧化还原电位(Eh)或电导率(Beesley et al.,2011)。通过监测反应体系的 pH和 Eh,我们发现添加生物炭和未添加生物炭体系的pH值在整个培养期间变化不明显(6.8~7.2),且都符合产甲烷菌的适宜生长 pH 值(6.5~7.2,Wang et al.,1993)。但是,与不添加生物炭的对照相比(Eh=-60 mV),添加12、25和50 g·L-1生物炭-1后体系的Eh分别升高至60、100和130 mV。
为了验证添加生物炭改变体系Eh与抑制产甲烷过程的关系,设置了未处理生物炭-1和处理后生物炭-1的两个共培养体系,即在120培养基添加生物炭 30 d后再接种微生物构建共培养体系。经检测,放置30 d后,添加生物炭-1体系的Eh值降低至-249 mV。主要原因可能是120培养基中含有的还原剂(cysteine和Na2S)与生物炭中具有氧化性的官能团反应,降低了由生物炭造成的培养体系升高的Eh。如图 7所示,与未添加生物炭-1共培养体系相比,处理后的生物炭-1对整个培养期的产甲烷过程都有明显促进作用,而未处理生物炭-1体系中前期抑制后期促进的效果与共培养体系一致。在生物炭-2体系中,未添加生物炭体系和处理后生物炭体系的甲烷产量相似,但都明显高于未处理生物炭体系。这些结果表明,生物炭的高 Eh是抑制产甲烷过程的原因,这也解释了生物炭浓度越高抑制效应越明显的规律。该实验再次证明了导电性生物炭-1对共培养体系产甲烷过程的促进效应,以及促进效应与生物炭导电性的相关性。
3 讨论
由上述实验结果可知,导电生物炭促进了Geobacter sulfurreducens和Methanosarcina barkeri共培养体系中的乙酸产甲烷过程。Geobacter sulfurreducens和 Methanosarcina barkeri已被证实具备DIET功能:Geobacter sulfurreducens可以通过导电磁铁矿将氧化乙酸产生的电子传递至硝酸盐还原菌 Thibacillus denitrificans(Kato et al.,2012b);Methanosarcina barkeri可以直接或通过各种导电介质(磁铁矿、生物炭和活性炭等)从电子供体微生物接收电子还原CO2产生甲烷。Chen et al.(2014b)证明了生物炭可以作为导电介质加速 Geobacter metallireducens和Methanosarcina barkeri共培养体系乙醇互营氧化产甲烷过程,Geobacter metallireducens氧化乙醇产生的电子传递通过生物炭直接传递至Methanosarcina barkeri,从而促进甲烷产生。因此,导电生物炭、Geobacter sulfurreducens和Methanosarcina barkeri满足构成DIET介导乙酸互营氧化产甲烷体系的基本条件。
本实验的共培养体系中,Methanosarcina barkeri本身可以利用乙酸单独完成产甲烷这一代谢过程。因此,Geobacter sulfurreducens是否可以通过氧化乙酸,与Methanosarcina barkeri互营产甲烷,是证明体系中存在DIET介导乙酸互营氧化产甲烷的关键。我们以添加了生物炭的培养基分别构建 Methanosarcina barkeri单独培养体系和Geobactersulfurreducens+Methanosarcina barkeri的共培养体系,通过对比两种培养体系的产甲烷速率和微生物生长状况,验证Geobacter sulfurreducens与Methanosarcina barkeri是否存在互营反应。由实验结果可知,添加导电生物炭的 Methanosarcina barkeri单独培养体系的产甲烷速率和甲烷产量都低于添加导电生物炭 Geobacter sulfurreducens+Methanosarcina ta barkeri的共培养体系,且共培养体系中Geobacter sulfurreducens的生物量也有明显增长。这些结果说明Geobacter sulfurreducens参与了产甲烷过程。

图7 Geobacter sulfurreducens/Methanosarcina barkeri共培养体系添加处理生物炭-1和未处理生物炭-1的甲烷产生量-时间动力曲线Fig. 7 Methane production in the co-culture of Geobacter sulfurreducens and Methanosarcina barkeri amended with treated biochar and untreated biochar at a concentration of 25 g·L-1. (a) conductive biochar-1; (b) non-conductive biochar-2
已有文献报道Geobacter sulfurreducens不能与氢营养型的产甲烷菌通过种间氢转移或种间甲酸转移进行互营(Cord-Ruwisch et al.,1998;Butler et al.,2009),那就意味着在导电生物炭存在的条件下,Geobacter sulfurreducens和 Methanosarcina barkeri之间存在其他的互营方式。基于生物炭导电性对Geobacter sulfurreducens参与产甲烷过程的必要性,可以推测 Geobacter sulfurreducens和Methanosarcina barkeri之间的互营方式是导电生物炭介导的直接电子传递。SEM(图6)显示,杆状Geobacter sulfurreducens 和球菌叠状的Methanosarcina barkeri并没有直接接触,但都紧紧吸附于生物炭表面,说明Geobacter sulfurreducens与 Methanosarcina barkeri之间很可能通过导电生物炭传递电子,这一现象与Liu et al.(2012)的研究结果类似。Yu et al.(2015)研究900 ℃烧制的秸秆生物炭对Geobacter sulfurreducens还原降解五氯酚的影响机制时发现,导电生物炭的类石墨结构区域的π-π键与电子传递相关。因此,本实验中导电生物炭的石墨结构 π-π键导电网络可能介导了Geobacter sulfurreducens与Methanosarcina barkeri之间的电子传递,从而加速产甲烷进程。
4 结论与展望
实验结果表明,导电性生物炭能介导Geobacter sulfurreducens和Methanosarcina barkeri之间的直接电子传递,促进乙酸降解产甲烷过程。在水稻土或其他厌氧环境中,乙酸是有机物厌氧降解过程中最重要的中间产物,耦合电子受体还原过程最终矿化产物为CO2(比如硝酸盐作为电子受体)或甲烷(CO2作为电子受体)。
本实验研究结果解释了Geobacter在产甲烷环境中利用乙酸产生甲烷的代谢过程,即 Geobacter氧化乙酸产生的电子,通过导电生物炭将电子直接传递至产甲烷菌 Methanosarcina还原 CO2产生甲烷,这为揭示Geobacter在产甲烷环境中的生长提供了科学依据。将来的研究工作可利用稳定同位素13C标记技术表征 Geobacter sulfurreducens和Methanosarcina barkeri共培养体系中乙酸互营氧化途径,或利用Methanosarcina 突变菌株或抑制剂构建特定甲烷生成途径研究共培养中的DIET过程。

