MRI不同技术在脑胶质瘤术前分级中的应用价值
1.河南省安阳市中医院神经外科(河南 安阳 455000)
2.河南省安阳市人民医院神经外科(河南 安阳 455000)
3.河南省安阳市中医院CT室(河南 安阳 455000)
杨利民1 范海霞2 王景顺3
脑胶质瘤是常见的颅内恶性肿瘤之一,在所有颅内肿瘤中占比为1/3~1/2[1]。肿瘤病理分级是决定治疗方案制定及患者预后的重要因素,参照2007年世界卫生组织(World Health Organization,WHO)[2]公布的中枢神经系统肿瘤病理分级标准,脑神经胶质瘤可分为I~IV级,其中I、II级者行局部手术切除,辅以放化疗,即可取得较好预后;III~IV级者需行广泛切除联合放化疗等进行综合治疗,且预后往往较差[3]。因此,脑神经胶质瘤病理分级不同,治疗方案及预后亦存在较大差异,用于术前评估肿瘤病理分级的具有无创性特点的影像学手段自然尤为重要。磁共振成像(magnetic resonance imaging,MRI)常规序列能够较好地显示肿瘤形态、大小、部位等生物学特性,但在评估肿瘤病理分级上,与术后病理符合率不高[4]。磁敏感加权成像(susceptibility weighted imaging,SWI)是一种利用组织间磁敏感差异为成像基础的三维高分辨序列,且无须应用对比剂,在脑血管畸形、创伤性脑损伤等脑血管疾病诊断中已有广泛应用[5]。但SWI在脑神经胶质瘤诊断及术前分级中的应用价值目前仍处于探讨阶段。本研究旨在探讨SWI对脑神经胶质瘤分级的诊断价值,现报告如下。
1 资料与方法
1.1 一般资料回顾性收集2015年12月~2018年2月我院收治的40例经手术病理证实的脑神经胶质瘤患者临床资料,所有患者术前均接受常规MRI平扫、常规增强扫描及SWI检查,检查距手术切除时间不超过20d,检查前均未行放疗、化疗等。40例患者中,男29例,女11例;年龄23~67岁,平均(48.21±13.59)岁;肿瘤长径11~72mm,平均(36.78±10.45)mm;临床症状:头晕22例,头痛20例,呕吐12例,癫痫发作14例。
1.2 检查方法采用飞利浦Achieva 1.5T磁共振设备,头颈部专用8通道体相控阵线圈。检查时,患者取仰卧位,嘱患者保持平静呼吸。完全补偿的三维梯度回波序列在增强前行SWI扫描,扫描参数:TR为28ms,TE为20ms,FA为150°,FOV为23cm×23cm,层厚为1.5mm,采集时间为5min 25s。MRI常规序列包括轴位自旋回波T1加权成像(T1-weighted imaging,T1WI)序列(TR为250ms,TE为2.46ms)、快速自旋回波T2加权成像(T2-weighted imaging,T2WI)(TR为4000ms,TE为113ms)、液体衰减反转恢复序列(fluid attenuated inversion recovery, FLAIR)(TR为7000ms,TE为79.0ms,TI 为2500ms),其他扫描参数:FOV为23cm×23cm,矩阵为256×320,层厚为5mm,层间距为1.5mm。平扫后,以2.5mL/s速率经静脉团注0.1mL/kg钆喷替酸葡甲胺,采集横轴位、冠状位、矢状位图像,扫描参数与T1WI平扫序列相同。
1.3 图像处理将扫描图像上传至MRI后处理工作站AW4.1上,并采用系统软件Functool 2.0行SWI图像后处理,获取校正后的相位图与磁矩图,再经三维重建获取最小强度投影图(min IP)及SWI图。
1.4 胶质瘤影像分级标准(1)MRI常规序列(含增强)对胶质瘤分级评判标准:a.肿瘤占位效应:无占位效应,1分;轻度占位效应,2分;明显占位效应,3分;b.瘤周水肿情况:无明显水肿,1分;水肿带<2cm,2分;水肿带2~4cm,3分;水肿带>4cm,4分;强化程度:无强化,1分;可疑,2分;有强化,3分;明显强化,4分;强化方式:无,1分;规则环形,2分;片状,3分;环形、华环状、不规则形,4分;总分为15分,评分为4~6分为I级,7~9分为II级,10~11分为III级,12~15分为IV级。(2)SWI对胶质瘤分级评判标准:a.低信号区与肿瘤比较:无明显低信号区,1分;所有层面低信号区均小于肿瘤直径,2分;至少存在1个层面大于肿瘤直径,3分;肿瘤内低信号最大径:无明确低信号,1分;轴位低信号区最大径小于0.5cm,2分;轴位低信号区最大径为0.5~1.0cm,3分;轴位低信号区最大径大于1.0cm,4分;低信号形态学评价:无明确低信号区,1分;少许点状低信号,2分;点状或网点状低信号,3分;线状或弯曲状低信号,4分;总分11分,评分为3~4分为I级,5~6分为II级,7~8分为III级,9~11分为IV级。所有MRI影像图像均由2名副主任以上影像学医师共同评估,意见不一时经讨论达成一致。
1.5 病理分级参照2007年WHO公布的中枢神经系统肿瘤病理分级标准进行脑胶质瘤分级,由2名病理科副主任医师共同阅片,意见出现分歧时,经讨论取得一致。
1.6 统计学方法应用SPSS20.0软件处理研究数据,计数资料采用例和百分率表示,比较行卡方检验;计量资料均符合正态分布,采用(±s)表示,多组间比较采用单因素方差齐性检验,组间两两比较行t检验;以P<0.05为差异有统计学意义。
2 结 果
以病理分级结果为金标准,MRI常规序列术前分级的符合率为55.00%(22/40),SWI序列术前分级符合率为77.50%(31/40),两种技术术前分级符合率比较差异有统计学意义(χ2=4.528,P<0.05),见表1。MRI常规序列对脑胶质瘤术前分级主要依据肿瘤占位效应、瘤周水肿特点、强化程度及强化方式(见图1,3-5),SWI序列术前分级主要依据肿瘤内微出血及小血管检出(图2,6),不同级别脑胶质瘤肿瘤内微出血体积、肿瘤内小血管数目比较差异有统计学意义(P<0.05),见表2。
表2 WHO各级别脑胶质瘤肿瘤内微出血体积及小血管数目比较(±s)

表2 WHO各级别脑胶质瘤肿瘤内微出血体积及小血管数目比较(±s)
注:与I级脑胶质瘤比较,aP<0.05;与II级脑胶质瘤比较,bP<0.05;与III级脑胶质瘤比较,cP<0.05
?
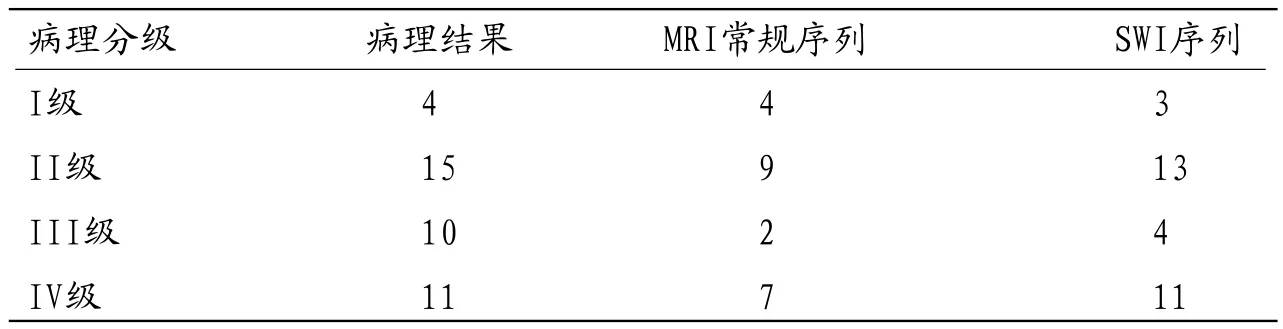
表1 MRI常规序列、SWI序列对脑胶质瘤的术前分级与术后病理分级比较
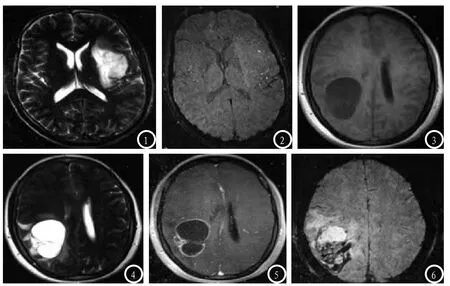
图1-2 女,39岁,WHO I级脑胶质瘤。术前MRI图像,图1,T2WI,无明显占位效应(1分),瘤周水肿<2cm(2分),无强化(1+1分),总分为5分,为I级;图2,SWI图,无低信号区,各项评分均为1分,评分为3分,属于I级。图3-6 男,36岁,WHO III级脑胶质瘤。术前MRI图像,3-5分别为横轴位T1WI、T2WI、CE-T1WI,轻度占位效应(2分),水肿<2cm(2分),有强化(3分),规则环形强化(2分),评分为9分,属于III级。
3 讨 论
MRI常规序列在脑胶质瘤术前分级上依赖于对比剂的应用,相应的病理机制在于肿瘤可致血脑屏障损伤、肿瘤血管生成等[6]。高级别脑胶质瘤血脑屏障受损明显,故增强扫描呈显著强化[7]。同时,低级别脑胶质瘤因存在由瘤周-瘤体血管内皮细胞组成的“血瘤屏障”,因此对比剂难以进入瘤体。MRI增强扫描在脑胶质瘤术前分级中敏感性较低,且具有较高假阳性率,造成MRI常规序列对脑胶质瘤术前分级符合率较低的原因可能有如下几点:(1)MRI常规序列无法提供血管生成、微坏死灶等肿瘤生理信息,而这些信息是评估肿瘤分级的重要因素;(2)MRI常规序列在肿瘤内血管新生评估上存在局限性,一些高级别(WHO III级、IV级)脑胶质瘤MRI无明显强化,而低级别(WHO I级、II级)脑胶质瘤由于血脑屏障受损明显,呈明显强化;(3)脑胶质瘤由于缺少包膜,故而难以完全切除,由于脑胶质瘤内可能同时存在多个级别,其恶性程度按最高级别而定,而实践发现肿瘤恶性程度与活检取样深度和广度等有关。
SWI序列在脑胶质瘤诊断上有着显著优势,能够清晰呈现病灶位置、边界、出血和血管生成等情况,从而可为脑胶质瘤的诊断及分级提供重要信息。有学者认为,脑胶质瘤等实体瘤,依赖于病理血管发生,高级别脑胶质瘤常存在出血灶,这能够为肿瘤术前分级提供有用指导[8]。SWI序列能够较好地显示肿瘤内微出血及小血管情况,从而有助于脑胶质瘤术前分级。初期脑胶质瘤瘤内新生血管能够与局部血管相连通,而随着胶质瘤恶性程度增加,血管生长速度无法跟上肿瘤生长,瘤体内部便易出现坏死,瘤内血管可因缺氧而致出血,因此,相比于低级别脑胶质瘤,高级别脑胶质瘤具有更多的微出血灶及小血管[9]。本研究结果显示,以病理分级结果为金标准,SWI序列术前分级的符合率为77.50%,明显高于MRI常规序列的55.00%,可见SWI序列有助于提高脑胶质瘤术前分级与病理分级符合率,与相关报道[10]类似。本研究还显示,SWI序列下,不同级别脑胶质瘤肿瘤内微出血体积、肿瘤内小血管数目比较差异有统计学意义,这可能是因为脑胶质瘤并不是实性肿瘤,其瘤体在脑组织中呈浸润生长,脑组织固有的血管能够满足低级别脑胶质瘤生长的需要,故相比于高级别脑胶质瘤,其新生血管明显要少。有研究表明MRI增强扫描联合SWI序列可有效提高术前分级诊断效能,增强后SWI序列下,肿瘤边缘有着更为清晰的图像表现,可更好地呈现脑胶质瘤异质性,血管屏障受损是其重要因素[11-12]。
综上所述,SWI序列能够较清晰地呈现肿瘤内微出血及小血管生长情况,与脑胶质瘤病理分级密切相关,可作为MRI常规序列的重要补充,对脑胶质瘤术前分级有着重要应用价值。

