宫颈癌18F-FDG PET与MR体积测量一致性探讨的PET/MR研究
鲁玥玥,孙洪赞,马全美,辛 军
(中国医科大学附属盛京医院放射科,辽宁 沈阳 110004)
宫颈癌在世界上是女性患者中第二常见的恶性肿瘤,在发展中国家是引起女性死亡的第三常见原因[1]。我国宫颈癌发病率和死亡率在世界各国中一直处于偏高水平[2]。放射治疗是进展期宫颈癌患者的主要治疗手段。放疗前准确勾画宫颈癌生物靶体积(Biological target volume,BTV)的范围是决定放疗成败的关键。但由于PET空间分辨率低,肿瘤边缘显示不清,在PET生物靶区的勾画中,不少研究者应用标准摄取值(Standardized uptake value,SUV)来进行半定量的分析,但目前对于PET勾画生物靶区的方法仍没有统一。对于宫颈癌患者,在勾画PET生物靶体积的边界中,目前并没有一个统一的SUVmax阈值,研究的准确性是否可信都有待验证。
MRI由于高度的软组织分辨率,可以作为评价不能手术的进展期宫颈癌体积的最准确的影像学检查方法[3]。PET/MR作为一种先进的影像学技术,将PET的生物学功能与MR的高精度的解剖结构融为一体,不需要患者更换扫描床,能够减少因为患者位置移动在图像融合中的误差。本文以MR T2WI上宫颈癌肿瘤的体积作为宫颈癌体积的金标准[4]。我们试图在宫颈癌大体体积的测量中,通过评估PET/MR上不同SUVmax上PET的体积与MR体积的相关性,来得到一个使PET上肿瘤体积和MR体积最一致的SUVmax阈值。
1 材料和方法
1.1 临床资料
本文前瞻性的收集了从2012年6—12月确诊宫颈癌并且正在进行规律放疗的26例女性患者。纳入标准为:组织病理学证实为宫颈癌,FIGO分期为进展期(ⅡB期或以上)的患者。排除标准为:任何接受过手术或其他治疗的患者;体内有节育环或其他金属置入物的患者;有幽闭恐惧症的患者;图像无法融合或因伪影显示不清的患者。其中1例患者为宫颈原位癌,1例患者行手术治疗,1例患者图像无法融合,3例PET图像显示不清而被排除。
纳入研究的患者共有20例。平均年龄51岁(中位年龄52岁,范围31~67岁)。在这个分析中,所有入选的20例患者中,14例(70%)为ⅡB期,6例(30%)为ⅢB期。所有的患者都需要签订知情同意书。这项研究经过了中国医科大学附属盛京医院评审委员会的批准。
1.2 PET/MR 检查方法
研究采用Philips公司的Ingenuity TF PET/MR仪,采用改进的Gemini TOF PET和3T Achieva MR组合。Ingenuity TF PET/MR仪的性能与单独PET/CT和MR在本质上性能是一致的。采用GE公司的MINItraceⅡ回旋加速器生产18F-FDG。
患者禁食4~6 h,根据患者不同的体质量,静脉注射18F-FDG(放化纯度>95%)250~350 MBq不等,暗室内静卧(60±12)min。患者被要求扫描之前排空膀胱。所有患者均行盆腔PET、MR扫描及全身PET扫描。盆腔扫描包括一个快速3D T1加权梯度回波MR序列(atMR),用于MRmap的计算,盆腔PET发射采集(一个床位,4 min)和一个诊断性MR序列(大概30 min)。全身PET扫描包括atMR和全身PET发射采集(10~12个床位,每个2 min)。扫描范围为从阴道水平至髂骨水平。Q-body线圈用于atMR图像的获得,Torsol XL盆腔线圈用于诊断性盆腔MR的扫描。盆腔MR,T2WI上参数如下:横断位T2加权turbo快速自旋回波(TSE)TR/TE 2 583/90 ms,voxel size 0.36/0.36/5.00,层 厚 /间 隔 5.0/1.0 mm,NSA 2。冠状位 T2加权 turbo快速自旋回波(TSE)TR/TE 1 587/100 ms,voxel size 0.83/0.84/5.00,层厚/间隔 5.0/1.0 mm,NSA 2。矢状位 T2加权turbo 快速自旋回波(TSE)TR/TE 3 408/60 ms,voxel size 0.49/0.49/5.00,层厚/间隔 5.0/1.0 mm,NSA 2。
在整个扫描过程中,患者仰卧于扫描床上保持不动,扫描床自动在MR和PET仪器之间移动。扫描过程中所有患者保持自主呼吸。
1.3 图像的分析
PET体积的计算:PET图像均使用的衰减加权亚序列最大期待值法(Ordered-subsets expectation maximization,OSEM)进行图像重建。我们在采集MR图像的过程中所用到的Q-body线圈是一种梯度回波扫描,其产生了PET衰减校正所需的衰减图[5]。在PET图像上,我们选取20%~60%(间隔5%)的SUVmax,PET处理系统自动勾画生成肿瘤体积(图1)。记录FDG-PET在不同百分比的SUVmax值上肿瘤的平均体积和中位体积。
MR T2WI上体积的计算:宫颈癌在T2WI上为高信号。宫颈癌的体积包括宫颈和宫旁组织能见到的大体肿块的体积。T2WI上肿块的体积由两名有经验的放射科医师共同测量(图1)。绘制T2WI MR矢状图像上每一层上肿块的轮廓,通过计算每一层的面积乘以(层厚+间隔)得到的MR上肿块的体积(层厚 5.00 mm,间隔 1.00 mm)。

图1 女,47岁,宫颈癌ⅢB期。图1a:MRI矢状位T2加权上肿块的轮廓。图 1b~1f分别为 20%、30%、40%、50%、60%SUVmax时,PET上的自动生成的体积与MR的融合图像。Figure 1. A 47-year-old woman with stage ⅢB disease.Figure 1a:The mass contour at MRI T2-weighted sagittal.Figure 1b~1f:The fused image of the PET automatic volume at 20%,30%,40%,50%,and 60%SUVmax,respectively with MR.
1.4 统计学处理
用Pearson相关系数分析20%~60%(间隔5%)百分阈值上自动生成的PET的体积和MR上肿瘤体积的相关性。计算和比较MRI体积和不同百分比SUVmax时PET体积之差的平均值。用T检验,检验MRI体积和不同百分比SUVmax时PET体积差异有无统计学意义。全部资料采用SPSS 17.0软件处理。P<0.05为差异有统计学意义。
2 结果
2.1 患者信息
纳入研究的患者共有20例。患者31~67岁,中位年龄52岁。其中14例(60%)为ⅡB期,6例(30%)为ⅢB 期。MRI上的平均体积为 35.6 cm3。在PET 上,原发肿瘤平均 SUVmax 值为 12.9±4.9。
2.2 不同百分比SUVmax时PET体积和MRI体积的相关性
随着SUVmax阈值百分比的增加,FDG PET自动绘制的体积减小。平均MRI体积与35%SUVmax值时 PET 体积有显著的相关性(P<0.001),Pearson相关系数和绝对系数分别为0.888和0.789。在35%的 SUVmax时,FDG PET上的平均体积为(32.5±17.6) cm3,见表 1。
2.3 MRI体积和不同百分比SUVmax时PET体积之差的平均值
随着百分阈值的增加,PET体积逐渐减小(表2),MRI和35%SUVmax PET体积最相关时,二者体积之差最小(图2),意味着在35%SUVmax时MRI与PET体积一致性最好。而且,根据T检验(表2)35%SUVmax 阈值时,P=0.061,MR 体积与 PET 体积之间差异没有统计学意义。

Table 1 Correlation between PET volumes at different percentages of SUVmax and MRI volumes
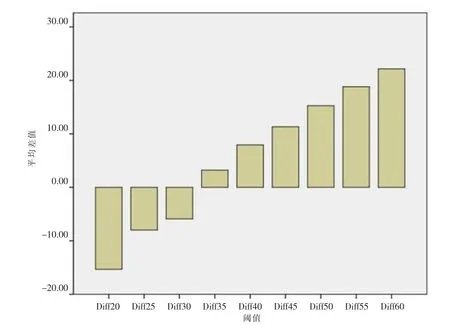
图2 MRI体积(cm3)与不同百分比SUVmax上PET体积(cm3)之差的平均值。Figure 2. The average values of the volume differences(cm3)between MRI volume with PET volume(cm3)at different percentages of SUVmax.

Table 2 t-test analyses of volume differences between MRI with PET volume at different percentages of SUVmax
3 讨论
放射治疗是进展期宫颈癌的最主要治疗方式。立体适形放疗(Conformal radiationtherapy,CRT)、调强放疗(Intensity modulated radiationtherapy,IMRT)等精确放疗技术可使放疗高剂量区的分布在三维方向上与靶体积外形一致、并可使靶体积边缘剂量梯度的锐减,从而提高靶体积剂量、降低周围正常组织的损伤。放疗前准确勾画肿瘤靶体积(Gross tumor volume elinieal taget volume,GTV)至关重要,然而CT、MR等传统的勾画靶体积的方法不能有效地反映肿瘤的生物和代谢活性以及靶体积内不同区域放疗敏感性的差异,可能会导致过度治疗。近年来,随着功能影像学的发展,运用解剖、功能等不同信息的显像模式来绘制肿瘤的轮廓和制定放疗计划已经应用于放疗实践中[6-10]。通过功能影像学技术显示具有放疗敏感性不同的生物学靶区,利用物理调强的照射技术给予不同的生物学靶区不同的照射剂量,从而最大限度的杀灭肿瘤组织并保护正常组织。PET成像的优势在于它能很好地提供肿瘤的分子生物信息,识别肿瘤的生物学过程,显示具有放射敏感性不同的生物学靶区,近年来,运用PET辅助宫颈癌放疗计划也取得了肯定价值。Kruser等[11]在不同肿瘤的研究中,当PET用于放疗常规中,至少有68%的患者肿瘤大体体积、治疗模式或局部剂量发生了改变。Dolezelova等[12]研究报道51例局部晚期宫颈癌患者(ⅡB~ⅢB),放疗计划前对比CT和PET/CT融合图像,结果19例(37%)病人改变了病变范围,9例(17.5%)病人改变了治疗区域。Ciernik等[13]对比研究放疗前CT和PET/CT勾画的靶体积,结果8例宫颈癌患者中,CT勾画的GTV中有2例不同于PET/CT影像下勾画的GTV,体积大约改变了25%。Fleming等[14]用PET/CT与MR对63例进展期宫颈癌患者进行对比分析,其中76%的患者治疗方案和放疗计划都发生了改变。
由于PET的成像原理比较特殊,图像分辨率低,如何在PET图像上准确地勾画出肿瘤的边缘是确定生物靶区的关键。然而,迄今为止,在PET图像上勾画肿瘤的边界的方法并没有达到一致性。目前有许多针对在PET/CT图像上勾画GTV靶区的研究[15],最简单的方法是在PET/CT融合图像上完全凭视觉勾画出代谢增高的区域,但这种方法受操作者水平影响较大[16]。固定阈值法是利用某一固定的标准摄取值的截点值(SUV阈值)来描绘与肿瘤大体体积相当的FDG热区的方法,不少学者选择了SUV值2.5为阈值勾画GTV的边界,SUV随本底的高低而改变,而且受部分容积效应影响较大[17],当SUVmax较低时,不适合应用于临床靶区边界勾画。还有学者提出一种特殊的“Halo”晕环勾画法[18],但这种方法只在特定的软件上可行。还有一些研究者在寻找某种系统特异性的公式,用来计算靶区边界阈值,如与靶区内平均SUV相关的公式法[19],还有一些包含最大SUV、平均SUV、本底SUV等更多参数的公式[20],但这些方法比较复杂,其可行性及准确性也并没有得到证实。现在越来越多的研究倾向于用百分数阈值法来确定靶体积,即用靶区最高摄取值的某个等百分数阈值线作为病灶的边界。不少学者在非小细胞肺癌的研究中,通过模型实验得出了40%[21],42%[22],50%[23]的边界阈值。对于宫颈癌患者,Grigsby等通过比较PET与CT的体积,得到一个40%的SUVmax阈值,另有学者得到30%到35%的SUVmax阈值[24-25]。我们的研究采用SUVmax百分数阈值法来确定靶体积,减少了本底SUV对病灶的影响,操作更简单,临床应用更广泛。
目前,对于局部进展期宫颈癌的相关研究,基本上都是以CT上肿块的体积作为参照标准的,而CT并不能真实的代表宫颈癌肿块的体积。本研究以PET/MR同体机上MRI T2WI上宫颈癌肿瘤的体积作为宫颈癌体积的金标准。与CT相比,MR上测得的肿瘤体积与肿瘤大体标本体积最相关,能够准确勾画出肿瘤的真实体积[26]。本实验采用通过绘制每一层轮廓的边界来计算MRI上肿瘤体积的方法,准确性优于之前的研究中根据直径测体积的方法[27]。
我们的研究结果表明随着百分阈值的增加,PET上绘制的病变体积逐渐减小。在35%SUVmax值时PET体积与MRI体积相关性较大。而且在35%SUVmax阈值时,二者体积之差的平均值最小。T检验分析不同SUVmax百分阈值时MRI和PET体积差异,在35%SUVmax阈值时二者之间差异没有统计学意义,因此35%SUVmax阈值时,宫颈癌在PET上的体积与MR体积最相关。而且我们在影像学上可以看到采取35%SUVmax阈值勾画的PET图像与MR的融合图像匹配良好(图3)。有研究用PET/CT与MR分体机分析了宫颈癌肿瘤在PET上的体积和在MR上体积的相关性,得到30%~35%SUVmax阈值相关性最大,这与我们的研究结果基本一致[25]。
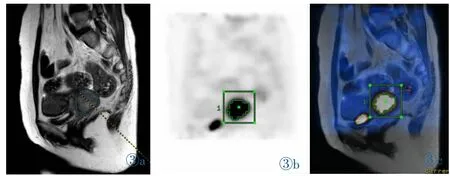
图3 女,47岁,宫颈癌ⅢB期。MRI上肿块的体积为29.4 cm3,采取35%SUVmax阈值勾画的PET图像准确,PET/MR的融合图像匹配良好。Figure 3.A 47-year-old woman with stageⅢB cervical cancer.Tumor volume on MRI was29.4 cm3,PET images were outlined accurately,and thefusionimagesofPET andMR were well matched.
PET/MR融合技术的产生,使功能成像技术又进入了一个新的台阶。PET图像与MR图像同机融合的PET/MR一体机,将功能影像和解剖影像完美结合,同一扫描床免除了多次扫描的不便利,不需要改变患者体位即可获得MRI和PET图像,缩短了采集时间,减少了分体机因为患者位置改变而造成的图像配准的误差,使代谢图像与解剖位置的配准更简单、更精确。PET/MR能清楚地显示出肿瘤的代谢状态,将高度的软组织分辨率、高敏感性、低辐射等优势融为一体,实现了对病变的准确定位和定性。PET和MR图像融合并不是简单的PET和MR图像重叠,而是提供了在高分辨率解剖结构基础显示细胞代谢的信息。
扫描过程中影响因素有:①图像采集的时间,病灶的SUV随时间的变化而改变,通常恶性病灶的SUV在注射后90 min上升到一个较高的水平。因此,18F-FDG注射后图像采集时间必须统一。②肿瘤的大小,受到PET的分辨率的影响,部分容积效应会影响肿瘤SUV的测定,当肿块大小只有分辨率的1.5倍大小时,所测量的SUV明显小于实际值[28]。③图像重建的方法,重建方法也会影响SUV,其中滤波反投影法重建的图像会低估真实放射性计数约20%,其低估程度远大于叠代重建法;OSEM重建的图像,其叠代次数也显著影响SUV。同时,如18FFDG注射时漏于皮下、系统的空间分辨率、不正确的扫描探测器准直校正和剂量校准、肿瘤本身的异质性等因素都影响到所测SUV的准确性,也就会影响肿瘤边界的选择。另外,对于一些比较大的肿瘤,膀胱内浓聚的放射性物质对PET成像产生伪影(图4),如果宫颈肿瘤位置与膀胱相邻,可能会影响PET上宫颈癌肿瘤勾画的准确性。目前我们已经通过尽量统一采集时间、统一重建方式、扫描前排空膀胱来减少膀胱内浓聚的放射性对肿瘤靶区勾画的影响。我们还可以通过插入导尿管,口服大量水稀释FDG浓度,口服利尿药物来加速FDG的排泄来减少误差。
由于本研究是一项前瞻性研究,目前仍存在一些不足。由于研究的病例有限,本实验并没有针对肿瘤的分期、各个病理类型进行比较。进展期宫颈癌不能手术治疗,无法得到与病理学体积上的对比。然而病理大体体积也有一定的局限性,肿瘤标本从在体状态到手术切除后这一过程中因为韧带的牵拉和标本内血液流失所造成体积和形状的改变,是不可避免的因素[25]。
PET/MR目前已开始应用于临床[29-32],在宫颈癌中已有初步应用[31-32],但目前并没有数据比较PET/MR扫描中PET的体积和MRI上靶体积的相关性。我们的研究是在PET/MR上以比较PET/MR绘制的PET上肿块的体积和MRI的体积来获得一个SUVmax阈值为目的研究。我们研究的结果表明,在PET/MR同体机上,当取35%SUVmax值时PET体积与MRI体积有显著的相关性,对于PET生物靶体积的勾画提供了一个准确的参照标准,对于进展期宫颈癌放疗前靶体积的勾画、放疗计划的制定提供了有力的依据。

图4 女,53岁,宫颈癌ⅡB。MRI上肿块的体积为 46.0 cm3。图 4a:MR T2加权矢状位上宫颈癌的轮廓。图4b:35%SUVmax值时PET上自动勾画的肿块的轮廓。图4c:PET/MR融合图像,对于体积较大的肿块,受邻近膀胱内浓聚的放射性的影响,在PET上绘制靶体积受到一定影响。Figure 4.A 53-year-old woman with stageⅡB cervical cancer.Tumor volume on MRI was 46.0 cm3.Figure 4a:Outline of cervical tumor on MR T2-weighted sagittal image.Figure 4b:The tumor contour was generated automatically on PET at 35%SUVmax values.Figure 4c:The fusion image of PET/MR.For larger tumors near the bladder,the PET target volume can be affected by the uptake of radioactive substances in the bladder.

