成骨不全的研究进展
潘婷婷 综述 冯正平 审校
重庆医科大学附属第一医院内分泌科,重庆 400016
成骨不全(Osteogenesis imperfecta,OI)是一种主要侵犯骨骼系统的罕见的先天性结缔组织疾病,也可累及眼、耳、皮肤等,其特征为易骨折、关节松弛、牙质发育不全、蓝巩膜、耳聋。相比骨质疏松,本病具有家族性和遗传性,但也有少数为散发病例[1]。本文就近年来OI研究进展作一综述。
1 成骨不全分型
目前临床应用最广的为Sillence 分型:Ⅰ型:最为轻微,无肢体变形;Ⅱ型为围产期致死型;Ⅲ型存在严重长骨畸形;Ⅳ型介于Ⅰ和Ⅲ之间,严重程度不等,临床表现差距甚大[2],Glorieux 等人根据独特的巨大骨痂形成以及尺桡骨融合与桡骨头脱位等表型特征、骨矿化缺陷病理特征、骻内翻、近端肢体短小等特征将Ⅳ型中扩充至Ⅴ~Ⅶ型[3,4]。其后,Ⅷ~ⅩⅤ型 随着新致病基因的发现顺序而先后被命名。近来又发现新的致病基因[5,6]。 Marini等人提出可以通过遗传检测、代谢机制与诊治方法相结合作为新的分类形式[7]。
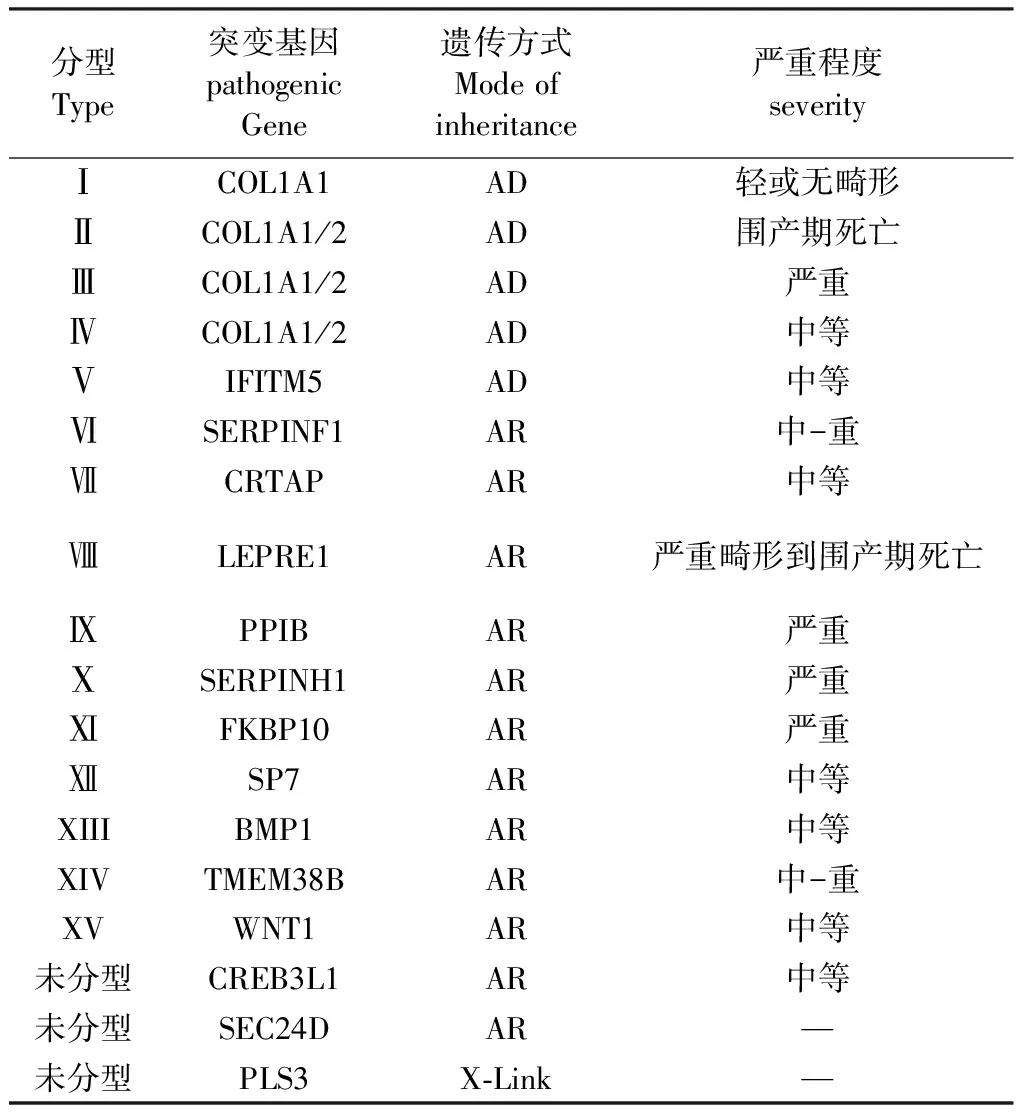
表1 成骨不全分型Table 1 The type of osteogenesis imperfecta
注:AD:为常染色体显性遗传;AR:常染色体隐形遗传;X-Link:X染色体遗传。
Note: AD: autosomal dominant inheritance; AR: autosomal recessive inheritance; X - Link: X chromosome inheritance.
2 成骨不全发病机制
目前大多数OI患者系常染色体显性遗传,因COL1A1/2、IFITM5基因突变导致 mRNA 的合成减少,翻译的Ⅰ型胶原蛋白数量减少,而Ⅰ型胶原的存在对三螺旋的形成至关重要[8,9]。COL1A1 和 COL1A2 基因的错义突变导致甘氨酸被替换,前胶原α链不能正确合成,Ⅰ型胶原分子的结构异常,引起Ⅰ型胶原三级螺旋结构不稳定,因被替换的氨基酸不同而表现出表型的多样性[10-12]。IFITM5基因的错义突变,编码干扰素诱导的跨膜蛋白5,也称为骨限制性IFITM样蛋白(Bril),仅在骨组织中表达,导致异常基质矿化,骨内膜钙化[13,14]。
常染色体隐形遗传机制较为复杂,基因表型多样化,致病基因分别为 SERPINF1、 CRTAP、 LEPRE1、 PPIB、 SERPINH1、 FKBP10、 SP7、 BMP1、TMEM38B、WNT1,扩充了成骨不全的Ⅵ~ⅩⅤ型。SERPINH1、 FKBP10基因的蛋白产物HSP47、FKBP65优先向前胶原三重螺旋的N端,并协助穿梭的胶原蛋白正确折叠入高尔基体,从而使胶原蛋白折叠稳定[15]。因BMP1和C-前肽裂解位点中的突变,C-前肽从I型前胶原中切割受阻,前肽区剪切的延迟,可能会削弱其剪切加工赖氨酰氧化酶 LOX 酶原的作用,影响胶原纤维分子间以及分子内的交联反应[16]。TMEM38B基因编码三聚体细胞内阳离子通道B(TRIC-B),充当K+通道,作用于维持不可兴奋细胞中的细胞内钙释放,涉及胶原代谢中的多种蛋白质是钙依赖性的,TMEM38B突变可以改变胶原蛋白的翻译后修饰,因为它可以调节钙网蛋白与亲环蛋白B和蛋白质二硫键异构酶的相互作用,由TMEM38B突变引起的钙释放减少会通过Ca2 +依赖性酶/磷酸酶信号使Ca2 +依赖性激酶使失活,因此,抑制多能间充质细胞转化成成骨细胞;异常Ca2 +可能导致ER膜的快速重组并激活解折叠蛋白反应,导致ER应激,可导致细胞毒性,诱导成骨细胞凋亡并影响骨基质的分泌;故细胞内或细胞外代谢途径的几个改变可能与TMEM38B突变诱导的OI发病机制有关[17]。部分常染色体隐性遗传致病基因突变并引起前胶原α 链的翻译后修饰、前胶原蛋白的分泌、加工等,导致前胶原蛋白的合成代谢异常,从而参与疾病的发生[18]。
WNT1基因编码Wnt1蛋白,而Wnt信号通路在骨细胞发育和骨内稳态中起关键作用,可进一步分为典型和非典型途径。在经典的Wnt-β-catenin通路中,Wnt1作用于Frizzled受体和辅助受体,即LRP5(脂蛋白受体相关蛋白5)和LRP6(脂蛋白受体相关蛋白6),Wnt1和LRP5的结合通过抑制泛素介导的蛋白水解降低了β-catenin的降解。多余的β-catenin积聚在细胞核中,结合转录因子4或淋巴增强子结合因子4,并将诱导下游基因表达,促进间充质干细胞向成骨细胞分化[19,20]。在非典型途径的上下文中,Wnt1作用于Fzds和Dv1以触发下游级联,并参与细胞骨架组织和成骨细胞分化的调节[21]。WNT1 基因突变降低成骨细胞活性,骨架结构失稳,骨强度降低,使OI患者即在轻微创伤下表现出骨量减少和骨折。
3 成骨不全的诊断
有阳性家族史基础,伴有脆性骨折、蓝巩膜典型临床特征的患者不难诊断,在轻度骨骼改变但没有OI骨骼外部特征的儿童中,很难在临床上建立诊断。Ⅵ型临床严重程度为中到重度,但有“鱼鳞”状骨板的特征,VI型OI患者中血清色素上皮衍生因子(PEDF)含量下降[22],可针对出生患儿提供诊断思路。OI患者无根治方法,故产前诊断预防患儿出生尤为重要。产前超声检查尤其是22-26周的四维系统B超可以较准确观察到胎儿骨骼系统的畸形。而对于有家族史或者产前超声异常的高风险人群,可通过PCR扩增及DNA测序、高通量基因测序、高分辨溶解曲线分析检测致病基因,提高阳性诊断。
有研究者在一项74例高危胎儿产前基因诊断得出,携带OI致病突变胎儿的检出率可达54%(40/74);胎儿及其父母和(或)先证者的基因型分析表明:夫妇一方为OI患者时,OI阳性胎儿的检出率为68.9%(40/58);夫妻基因基因型正常时,所生胎儿OI阳性检出率为0。由此可见,OI患者的后代具有较高的OI发病风险;相反,当先证者为散发病例时,其父母再次生育患儿的风险较小。因而,OI患者必须在完成自身基因诊断的基础上进行产前基因诊断,有效预防新生患儿的产生[23]。
4 成骨不全治疗
OI的治疗是需要多学科共同协作。OI患者常反复或自发性骨折,畸形愈合多见,肢体常弯曲或成角,对于畸形严重者可采取措施矫正畸形,改善负重力线。髓内伸缩棒的应用可以减少骨折次数及维持长骨功能[24]。矫正器的使用有益于患者日常活动。在药物降低骨折风险同时配合手术矫正,可提高患儿生活质量。
双膦酸盐是治疗OI最主要的药物,已经被证明可以减少骨痛,改善肌力,提高骨密度,降低骨折风险。静脉注射帕米膦酸钠治疗成骨不全的标准给药方案为1 mg/(kg·d),每次注射时间为3-4 h,连续注射3天,间隔周期2-4个月,药物累计剂量为每年9 mg/kg[25]。最近,有学者提出双膦酸盐对成长中的儿童长期影响和安全性仍有一些担忧,长期使用双膦酸盐与青少年的非典型股骨骨折相关[26,27],主要影响机制被认为是双膦酸盐对骨重塑抑制作用,导致非愈合性微裂纹,最终致全骨折。 Shane E等人在一项93例OI儿童患者予以双膦酸盐基础治疗、持续治疗和中断3组的回顾性队列研究,发现三组的骨折模式相似,骨折最常见的位置是中轴骨或远端骨,其次是转子间和远端骨折;几乎所有骨折均为横向或倾斜,即用双膦酸盐治疗的OI患儿股骨骨折模式无任何改变[28],仍可继续应用。
特立帕肽(teriparatide)为PTH的N端1~34片段,其作用机制主要为促进骨骼形成,目前主要用于骨质疏松症的治疗。在一项为期24月的临床试验,3名具有WNT1错义突变,3名具有PLS3剪接突变的OI患者,每日接受20 μg特立帕肽治疗,所有患者在3-6个月骨转换指标如P1NP、骨钙素和CTx增加;5例患者腰椎BMD从5.2%升至7.9%,4名患者股骨颈BMD自2.6%增至7.8%[29],基于BMD显著提高为治疗OI提供证据。
OI类型不同,治疗方法略有差别。OI的VI型多由SERPINF1突变所致,其可通过RANK/ RANKL通路激活破骨细胞,此类型患者对双膦酸盐治疗反应不佳,其机制可能是由于患者类骨质矿化不良所致[30]。denosumab是人源性RANKL的单克隆抗体,能抑制RANKL和RANK结合,通过抑制破骨细胞活性,抑制骨吸收、增加骨密度、降低骨折风险[31]。4名成骨不全VI患者每间隔12周予以1 mg / kg剂量的denosumab治疗,2年后表现出BMD的增加,骨畸形改善,骨折风险降低和肌肉增强[32]。
OI的Ⅶ小鼠体内大量分泌TGF-β,其由成骨细胞分泌,在骨吸收时被释放、活化,能与蛋白多糖结合参与胶原纤维形成。在鼠模型中抗TGF-β抗体可以修复骨表型,因此TGF-β骨细胞信号通路的药物可能是对OI Ⅶ有希望的疗法[33]。
有研究发现对WNT1突变OI患者予以双膦酸盐治疗,BMD有增加,但骨折风险未明显降低。BPS804一种中和性抗硬化蛋白抗体,通过Wnt信号通路刺激成骨细胞,有利于改善骨骼质量和减少长骨脆性,促进骨形成,减少骨吸收并增加OI患者的腰椎BMD,达到增加骨密度同时减低骨折风险[34,35]。
药物治疗可以改善OI的症状,根治则需依靠基因治疗,目前基因治疗主要用于COL1A1和COL1A2基因,通过RNA干扰使致病基因沉默,siRNA特异性抑制异常mRNA表达,将突变基因封锁成无效等位基因[36]。已报道的COL1A1和COL1A2基因突变的位点超过八百个,部分等位基因的区别仅限于一个核酸的不同,利用靶向杂交体的siRNA理论上增加等位基因的特异性,提高治疗基因OI的可能性。有研究发现将有标记基因的重组泡沫病毒载体注射到兔子的股骨骨髓腔,有效的改善骨矿物质密度和微结构,且采取髓内输注可能是干细胞治疗OI的有效细胞递送途径,优于全身给药,骨髓间质干细胞移植有望用于OI的治疗[37,38]。
5 结论
OI多由I型胶原蛋白的基因突变所致,随着分子遗传学的进展多个隐性基因表型逐渐发现,其致病机制逐渐明确。目前双膦酸盐是有效治疗OI的方法之一,其可提高骨密度,缓解骨痛,降低骨折风险,甲状旁腺素氨基端片段、抗硬化蛋白抗体等药物,有望增加骨密度、改善骨骼微结构且降低骨折风险。而基因治疗、骨髓间质干细胞移植新型治疗手段渐进入视野,应用于临床还需要经一步研究。

