农药类化合物对大型溞的毒性作用模式:与基线毒性化合物比较研究
闫俐辰,王晓红,赵元慧
东北师范大学环境学院,长春130117
随着工业的迅猛发展,越来越多的有机化合物被合成并释放到环境中。这些化学品进入环境后,对环境造成一定程度的污染,并且对人类和环境中的生物造成极大的毒害作用。因此,世界各国对有机污染物的生态风险评价都极为关注[1]。近年来,农业生产越来越受到重视,而农药在农业生产中担任着无比重要的角色,根据农药的作用不同可将农药分为除草剂、杀虫剂、杀菌剂等。尽管在农业生产中施用农药可以提高农作物的产量,但是不合理的农药施用会造成农药在环境中的残留。农药经漂移和径流等途径进入到环境水体中,会对水生生物产生一定的毒害作用。研究表明二嗪农和敌草隆对斑马鱼早期生命阶段均具有中等毒性,96 h-LC50值分别为6.5 mg L-1和4 mg L-1[2]。杀虫剂马拉硫磷对蓝绿藻的生长具有一定的抑制效应,在浓度为200 mg L-1时能够长期抑制其生长[3]。呋喃丹和敌敌畏均能够抑制月牙藻细胞生长并改变其细胞形态[4]。许多农药对许多水生生物均具有较大的毒性效应。
在水生生态风险评价中,研究有机污染物对水生生物的毒性作用模式至关重要[5]。Verhaar等[6]将有机污染物对水生生物的毒性作用模式分为麻醉型和反应型2种类型。其中,麻醉型化合物包括基线化合物和弱惰性化合物;反应型化合物包括非特殊反应型化合物和特殊反应型化合物。麻醉型化合物在整个毒性作用过程中不与有机体的各个靶位发生生物化学反应。这类化合物通过与细胞膜的非特异性作用,改变细胞膜的结构和功能,其毒性取决于其透过生物膜的能力,因此麻醉型化合物的毒性与辛醇/水分配系数logKow具有很好的相关性[7-10]。弱惰性化合物普遍包含氢键供体,能够与生物分子发生氢键作用,因此它们的毒性略高于基线化合物的毒性[11]。非特殊反应型化合物具有特殊的结构和性质,能够与普遍存在于生物大分子的某些结构发生反应,这类化合物的毒性效应较大。特殊反应型化合物能与某些受体分子特异性结合,毒性通常较大,并且作用机制非常复杂。反应型化合物的毒性通常明显高于麻醉型化合物的毒性。研究表明,麻醉型化合物在鱼体内的临界浓度在一个较窄的范围内变化,接近于常数,并且与毒性暴露方式无关;而反应型化合物能够与生物大分子发生化学反应,从而导致其体内临界浓度较低。尽管目前已有大量水生环境暴露的生物毒性数据,但是有机化合物在水中的浓度通常具有可变性,而在有机体靶位上的浓度是非常稳定的,可以反映有机化合物在生物体内的固有浓度[12]。因此,分析化合物在水生生物体内的临界浓度将有助于判断化合物对水生生物的毒性作用机理。
大型溞是水环境中无脊椎浮游动物的代表性生物,其以藻类为食,同时又是脊椎动物的饵料。因此,大型溞在水生生态系统的物质循环和能量流动中占据着重要的地位[13]。大型溞对多数毒性物质很敏感,且繁殖周期短,分布广泛,易于培养,因此普遍被应用于化合物的毒性测试[14]。本文通过实验测定了25种基线化合物对大型溞的急性毒性数据,并收集了57种农药类化合物对大型溞的急性毒性数据,其中包括除草剂、杀虫剂和杀菌剂。一方面,计算这25种基线化合物和57种农药类化合物在大型溞体内的临界浓度,将除草剂、杀菌剂和杀虫剂在大型溞体内的临界浓度与基线化合物进行比较;另一方面,应用各类农药化合物对大型溞的急性毒性数据和化合物分子描述符建立QSAR模型,并研究典型农药类化合物对大型溞的毒性作用机理。
1 材料与方法(Materials and methods)
1.1 基线化合物和农药类化合物对大型溞的急性毒性数据
本文通过实验获取了25种基线化合物对大型溞的急性毒性数据log1/EC50。受试生物大型溞(Daphniamagna)购自中国科学院水生生物研究所。大型溞置于(22 ± 2) ℃,并保持每天14 h:10 h亮暗比培养。我们选取出生6~24 h后的大型溞进行毒性测试。实验中每种基线化合物设置5个浓度梯度,每个浓度设置3个平行实验。化合物暴露48 h后检查大型溞是否停止活动,并根据化合物剂量效应关系计算出化合物对大型溞的急性毒性值。25种基线化合物对大型溞的毒性数据log1/EC50、化合物CAS号、名称、辛醇水分配系数、生物富集因子logBCF以及体内临界浓度log1/CBR列于表1。
另外,从文献和数据库中收集了共计57种农药类化合物对大型溞(Daphniamagna)的毒性数据[15-19],这些数据均通过相同的实验方法获取,具有良好的可靠性和有效性,且部分化合物来自不同实验室的毒性数据具有较高的重现性。毒性数据表示为LC50(48 h半数致死浓度,单位为mol·L-1)或EC50(48 h半数活动抑制浓度,单位为mol·L-1)。研究表明,化合物导致大型溞死亡和停止活动的浓度十分接近[20],因此本文将以大型溞死亡和停止运动为测试终点的毒性数据整理为同一数据集。57种农药类化合物对大型溞的毒性数据log1/EC50(log1/LC50)、化合物CAS号、名称、辛醇水分配系数、生物富集因子logBCF以及体内临界浓度log1/CBR列于表1。
1.2 体内临界浓度的计算
体内临界浓度CBR是指在一定时间内能够引起50%生物死亡时化合物在生物体内的浓度[21]。因此,如果在毒性实验中有机化合物在水相和生物相中达到平衡状态时,体内临界浓度可以表示为公式(1)[22-24]。
CBR = LC50×BCF
(1)
式(1)中,BCF为生物富集因子,本文中生物富集因子通过文献中报导的化合物在大型溞体内的生物富集因子logBCF值与辛醇-水分配系数logKow的线性关系进行计算[25]。LC50值应用实测值或文献中获得的毒性数据。
1.3 分子描述符和统计分析
本文计算了20种分子结构描述符,其中包括疏水性参数logKow,Abraham参数(A,B,E,S,V),氢键供体、受体数量(NHD、NHA)以及量子化学参数最高占据分子轨道能量(EHOMO)、最低未占据分子轨道能量(ELUMO)等。我们应用EPI Suite软件计算化合物的辛醇水分配系数logKow;应用Algorithm Builder软件计算化合物的Abraham参数,氢键供体、受体数量等参数;应用MOPAC软件计算化合物的量子化学参数。20种分子描述符的名称及其含义列于表2。
使用Minitab软件对各农药的毒性数据和各分子描述符进行多元线性回归分析,每个公式给出化合物数量N、标准偏差S、相关系数R2以及Fisher检验F值,以此评价公式的拟合程度和显著性水平。
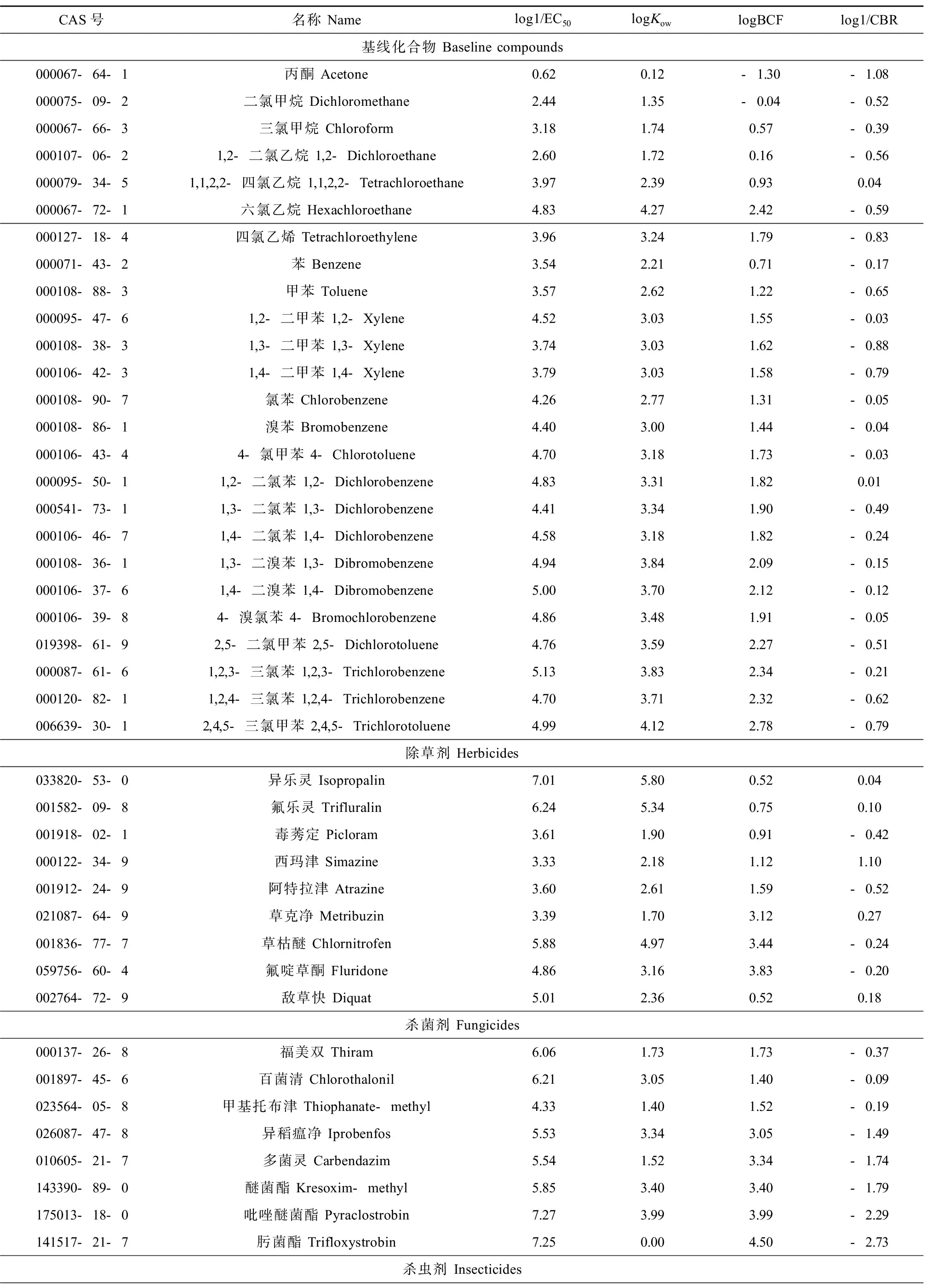
表1 基线化合物和农药类化合物对大型溞的急性毒性、生物富集因子和体内临界浓度值Table 1 Toxicities of baseline and agricultural compounds to Daphnia magna, and their logBCF, logCBR values

表2 分子结构描述符Table 2 Molecular descriptors
2 结果与讨论(Results and discussion)
2.1 基线化合物对大型溞的毒性与辛醇/水分配系数的关系
本文通过实验测定了25种基线化合物对大型溞的急性毒性。这些基线化合物包含烷烃类、酮类、醚类、苯及其卤代衍生物。通过将基线化合物的毒性与化合物分子描述符进行逐步回归分析,我们发现基线化合物的毒性与辛醇水分配系数logKow具有较好的线性关系,相关公式如(2)所示:
log1/EC50= 1.30 + 0.918 logKow
(2)
N= 25S= 0.33R2= 0.90F= 212
通过比较公式的斜率和截距可以发现,该公式与文献中报道的基线化合物对大型溞的急性毒性与logKow之间的线性关系十分接近(log1/EC50= 1.09 + 0.934logKow)[20]。这说明本公式具有良好的可靠性,基线化合物对大型溞的急性毒性与logKow的关系见图1。
2.2 农药类化合物对大型溞的毒性与化合物分子描述符的关系
根据公式(2)可知基线化合物对大型溞的毒性与logKow呈正比关系。然而,我们通过研究农药类化合物对大型溞的急性毒性与logKow的关系发现,农药类化合物的毒性与logKow具有较差的相关性(图1)。逐步回归分析表明,由于农药类化合物的结构复杂,应用本文所计算的分子描述符未能建立拟合程度较高的QSAR模型。这表明农药类化合物对大型溞的毒性具有不同的毒性作用机理。我们将农药按照功能分为除草剂、杀菌剂和杀虫剂,应用多元线性回归分析分别建立了各类农药对大型溞的急性毒性与化合物分子描述符之间的关系(公式3~5)。这些分子描述符反映了化合物的多种性质,如疏水性、电离性、亲电性以及能否形成氢键等性质。
除草剂:log1/EC50= 1.30 + 0.934 logKow+ 1.20F+(3)
N= 34S= 0.34R2= 0.92F= 173
杀菌剂:log1/EC50=1.37+0.814 logKow+0.000011Hf+0.0147 TPSA
(4)
N= 33S= 0.59R2= 0.82F= 43
杀虫剂:log1/EC50= 1.63 + 0.596 logKow- 0.426S+ 0.348V+ 1.93B+ 0.00663 CV
(5)
N= 65S= 0.91R2= 0.80F= 48
2.3 基于体内临界浓度比较基线和农药类化合物对大型溞的毒性作用机理
基线化合物与logKow的关系(公式2)可以通过体内临界浓度的概念来解释。众所周知,LC50是导致大型溞半数死亡时有机污染物在水相中的暴露浓度,其是体外浓度。目前普遍认为描述有机污染物对生物真实毒性效应的指标应该用体内临界浓度(CBR)。在理论上,如果实验中有机物在生物体内能达到吸附平衡,体内临界浓度(CBR)与体外浓度(LC50)的关系可以通过生物富集因子(BCF)关联起来[26]。
BCF = CBR/LC50
(6)
log1/LC50= log1/CBR + logBCF
(7)
研究表明,大型溞的logBCF与logKow间具有很好的线性关系[25],即:
logBCF = 0.850 logKow- 1.100
(8)
将该公式带入公式(7)中,即可得到有机化合物对大型溞的急性毒性与logKow之间的关系,如公式(9)所示:
log1/LC50= log 1/CBR + 0.850 logKow- 1.100
(9)

图1 基线化合物和不同类型农药对大型溞的急性毒性与辛醇水分配系数logKow的关系Fig. 1 Relationships between log Kow and toxicities to Daphnia magna for baselines and pesticides
很多研究表明,基线化合物对水生生物是通过麻醉作用发挥毒性效应,其在生物体内的临界浓度CBR值在一个很窄的范围内变化,即接近于一个常数[20, 27]。我们通过公式(8)计算了25种基线化合物的logBCF值,然后通过公式(6)或(7)计算了这些基线化合物的CBR值。结果表明,除了丙酮外(CBR = 11.91 mmol·kg-1),其他基线化合物在大型溞体内的临界浓度范围为0.92~7.59 mmol·kg-1(图2)。该范围和文献报导中的基线化合物在鱼体内的临界浓度范围极为相近(2~8 mmol·kg-1)[28],这说明基线化合物对大型溞的毒性机理和对鱼的毒性机理相同,大型溞的体内临界浓度CBR值同样接近于一个常数,同时也说明了为什么基线化合物对大型溞的毒性与logKow呈现正比关系(公式9)。
表1展示了根据公式(7)和(8)计算的25种基线化合物和57种农药类化合物对大型溞的生物富集因子logBCF值和体内临界浓度log1/CBR值。计算结果表明,除草剂在大型溞体内的临界浓度CBR值范围为0.08~3.30 mmol·kg-1;杀菌剂在大型溞体内的临界浓度CBR值范围为0~0.16 mmol·kg-1;杀虫剂在大型溞体内的临界浓度CBR值范围为0~1.10 mmol·kg-1。显而易见,农药类化合物在大型溞体内的残余量范围显著低于基线化合物在大型溞体内的残余量。因此,大部分农药类化合物对大型溞的毒性远远高于基线化合物,并且与大型溞生物分子发生化学反应。其中,除草剂对大型溞的毒性略低于杀菌剂和杀虫剂。图2表明了基线化合物和各农药类化合物在大型溞体内的临界浓度log1/CBR与logKow的关系。通过图2可以看出基线化合物在大型溞体内的临界浓度log1/CBR值在一个很窄的范围内变化,从而使得基线化合物对大型溞的毒性值与logKow具有很好的线性关系。然而,对于农药类化合物,尤其是杀虫剂和杀菌剂,它们在大型溞体内的临界浓度log1/CBR值变化范围很大,从而使得这些化合物的毒性值不仅与生物富集(logKow)有关,而且与它们在生物体作用靶位上的浓度有关。
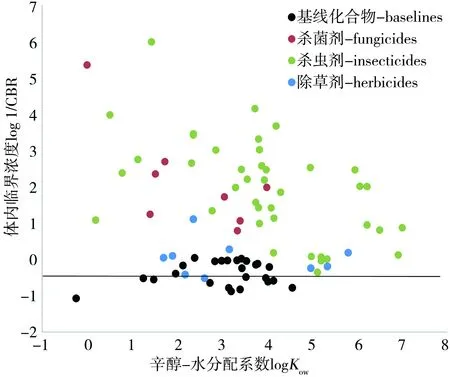
图2 基线化合物和本文所研究的农药在大型溞体内的临界浓度与辛醇水分配系数的关系Fig. 2 Relationships between logKow and log CBR of Daphnia magna for baseline compounds and the studied agricultural chemicals
2.4 农药类化合物对大型溞的毒性作用机理
上述研究表明农药类化合物的log1/CBR值不是一个常数,在公式(9)中需要引入反应性分子描述符,反映农药类化合物与生物受体间的化学反应。除草剂多通过干扰植物光合作用、植物激素以及植物生物合成等机理发挥效应,因而对大型溞的急性毒性作用机理较为简单。通过建立QSAR模型表明,除草剂对大型溞的毒性接近于基线毒性,但略高于基线毒性。公式(3)表明除草剂对大型溞的急性毒性主要取决于化合物从水相向生物相分配的能力。另外,除草剂对大型溞的急性毒性还与化合物的离子化程度有关,化合物的离子化程度越高,化合物对大型溞的急性毒性越高。离子化会引起化合物的生物富集能力降低,但是离子化合物所带正电荷易与蛋白质和核酸等生物大分子发生反应[29]。杀菌剂多通过抑制菌体内核酸或蛋白质等生物大分子合成发挥作用,其对大型溞的急性毒性效应主要与化合物的标准生成热和极性表面积有关。化合物的标准生成热和极性表面积越大,化合物对大型溞的急性毒性越大。公式(4)表明杀菌剂的稳定性越低,其对大型溞的急性毒性越大[30]。另外,化合物的极性表面积多指氧原子或氮原子,这些原子具有较强的吸电子能力,且易于生物分子发生氢键作用。杀虫剂多通过抑制生物神经系统、呼吸作用和生殖机能发挥效应[31],大型溞是水环境中无脊椎动物的代表性生物,其生理系统与植物生理系统相差较大,而与昆虫生理系统较为接近,这可能是杀虫剂对其毒性较高的原因。公式(5)表明杀虫剂对大型溞的急性毒性效应与化合物的分子极性、分子体积、氢键碱度和科斯模体积有关。化合物的分子极性越高,化合物对大型溞的急性毒性越低。尽管增加化合物的极性能够增加化合物与靶位分子的结合能力[32],但是化合物极性表面积过高能够降低其向生物相分配的能力。另外,化合物的分子体积和科斯摩体积在一定程度上与其向生物相中分配的能力和与生物分子间的范德华力有关。杀虫剂对大型溞的毒性还与其氢键碱度有关,分子碱性越强毒性越高。根据公式(5)计算结果表明,这些杀虫剂对大型溞的毒性效应与其和生物分子之间的氢键和范德华力有关。另外,尽管杀虫剂普遍对大型溞具有较高的毒性,但是仍然有一些疏水性较高的杀虫剂对大型溞的毒性接近基线毒性。一方面是由于高疏水性化合物在水中溶解度较低,从而导致其生物利用率降低;另一方面是由于高疏水性化合物对水生生物的毒性往往以麻醉性毒性为主,反应性毒性为辅。
综上所述:本文将农药类化合物和基线化合物对大型溞的毒性作用机理进行比较研究,发现多数农药类化合物对大型溞为反应性毒性作用模式,不同类别的农药对大型溞的毒性作用机理不同。其中,除草剂的毒性显著低于杀菌剂和杀虫剂的毒性。我国是农业大国,农药在农业生产中的使用必不可少,其在生产和使用过程中能够对人类及环境中的生物产生毒害作用。因此,研究农药类化合物对水生生物的毒性作用机理对于今后农药的生产和使用具有一定的参考价值。未来我们会通过测定农药在生物体内的浓度变化进行典型农药类化合物在生物体内的毒代动力学研究。

