猕猴桃果酒专用酵母的筛选与鉴定
蒋 成 魏妙宏 刘 路 赵雅芹 赵江林 侯晓燕 陈安均
(四川农业大学食品学院,四川 雅安 625014)
猕猴桃(ActinidiachinensisPlanch)原产地为中国,被称为“水果之王”,属于猕猴桃科(Actin-idiaceae)猕猴桃属(Actinidia)的植物果实[1]。近年,猕猴桃栽培面积飞速增长,猕猴桃精深加工越发重要。采用葡萄酒商业酵母酿造猕猴桃果酒典型性不强、果香不突出、风味偏单薄,其原因是多方面的,其中缺乏猕猴桃酒专用酿酒酵母是其主要因素之一[10]7-8[11]。有研究者希望通过筛选酿制猕猴桃酒专用酵母来提高猕猴桃酒的品质,如周一琴等[12]从猕猴桃表面筛选出1株酿制猕猴桃酒的产香菌株,但该菌株耐受二氧化硫能力不强;罗安伟[10]107-108构建出1株嗜杀生香的猕猴桃酒酿酒酵母,但并没对菌株发酵猕猴桃酒中甲醇含量进行报道;左勇等[13]筛选出1株酿制野生猕猴桃果酒的酵母菌,但没有对菌株的酒精和SO2耐受情况进行报道。
本试验拟从猕猴桃果实表面获得3株菌株,通过试验希望筛选出1株发酵性能够满足猕猴桃酒工业生产的要求,同时VC保留率高、低产甲醇生香的猕猴桃酒专用优良酵母。
1 材料与方法
1.1 试验材料
1.1.1 材料与试剂
秦美猕猴桃:雅安农贸市场;
乙醇:色谱纯,成都市科隆化学品有限公司;
甲醇:色谱纯,东莞康润实验科技有限公司;
4-甲基-2戊醇标准品:色谱纯,梯希爱(上海)化成工业发展有限公司;
蛋白胨、酵母粉、琼脂:国产生化试剂;
PCR扩增试剂盒:生工生物工程上海股份有限公司;
引物ITS1/ITS4:北京擎科新业生物技术有限公司;
其它试剂均为国产分析纯;
菌种Q1、Q2、Q3:由四川农业大学食品学院从猕猴桃果实表皮筛选获得。
1.1.2 培养基
YEPD培养基:酵母粉10 g、蛋白胨20 g、葡萄糖20 g、蒸馏水1 000 mL、pH 6.0、115 ℃灭菌20 min;
猕猴桃清汁培养基:猕猴桃破碎后榨汁,加入60 mg/L果胶酶,0.7 g/L硅藻土40 ℃恒温保护4.5 h,虹吸上清液得清汁,加入SO2并调整其浓度为80 mg/L,然后加入蔗糖,调整猕猴桃清汁糖度为20 Brix,置于4 ℃冰箱备用[10]21-22。
1.1.3 主要仪器设备
气浴恒温振荡器:ZD-85型,金坛市科析仪器有限公司;
生物安全柜:HR40-IIA2型,南京温诺仪器设备有限公司;
生化培养箱:SPX-250型,上海申贤恒温设备厂;
气相色谱仪:7890B型,美国Agilent Technologies公司;
分析天平:京制00000249型,北京赛多利斯仪器系统有限公司;
电热恒温水浴锅:DZKW-D-4型,北京市永光明医疗仪器厂;
双目光源生物显微镜:CX21型,奥林巴斯有限公司;
手动进样手柄:SPME型,上海安普科学仪器有限公司;
固相微萃取头:PDMS/DVB/CAR 50/30 μm,北京康林科技有限责任公司;
1 μL微量进样器:W-3型,上海安亭微量进样器厂;
气相色谱/质谱联用仪:7890A/59750型,美国Agilent Technologies公司。
1.2 试验方法
1.2.1 菌种的活化 在生物安全柜中分别取一环保藏在试管斜面上的菌株Q1、Q2、Q3,于YEPD固体培养基上活化2次。对活化好的菌株进行菌落形态的观察和镜检。同时取2环活化好的菌株分别于装有10 mL猕猴汁的试管中,在25 ℃、150 r/min恒温振荡培养36 h。将2支试管的菌液接入装有250 mL猕猴桃汁的三角瓶中,在25 ℃、150 r/min 恒温振荡培养30 h,用无菌生理盐水将三角瓶中扩大培养液的菌数调至1×107CFU/mL备用[14]。
1.2.2 3株菌株的分子生物学鉴定 3株菌的总DNA提取参考文献[15~16]。将提取的总DNA送往成都擎科梓熙生物技术有限公司进行基因扩增、克隆测序。对测得的结果除杂处理后进行拼接,将拼接后的序列导入NCBI进行Blast比对,筛选相似度较高的18S rDNA序列,使用Clustal X软件进行序列比对,采用MEGA5.1绘制发育树[15-16]。
1.2.3 3株菌发酵力的测定 取猕猴桃汁150 g于三角瓶中,将菌株Q1、Q2、Q3的扩大培养液按5%的接种量接入三角瓶中,在28 ℃条件下恒温培养,每天对其进行称重,计算CO2的生成量,比较3株菌株的发酵力和起酵速度[10]20-21。
1.2.4 3株菌耐受试验
(1) 酒精耐受试验:配制酒精体积分数为8%,10%,12%,14%,16%的YEPD液体培养基,取不同酒精体积分数的YEPD液体培养基10 mL分装于试管中(内置杜氏小管),取各菌株活化好的菌液2 mL接种于不同酒精梯度的试管中,在28 ℃生化培养箱中恒温培养,每隔24 h观察产气情况,比较3株菌的酒精耐受情况[17-18]。
(2) 二氧化硫耐受试验:配制SO2质量浓度为100,150,200,250,300 mg/L的YEPD液体培养基(以游离的SO2计),取不同SO2质量浓度的YEPD液体培养基10 mL分装于试管中(内置杜氏小管),取各菌株活化好的菌液2 mL接种于不同SO2质量浓度的试管中,在28 ℃生化培养箱中恒温培养,观察产气情况,比较3株菌的SO2耐受情况[17-18]。
1.2.5 猕猴桃酒的酿制 分别取猕猴桃汁800 mL于12个磨砂广口瓶中,将3株菌的扩大培养液按5%的接种量分别接入广口瓶中,每株菌接4个瓶,于23 ℃恒温生化培养箱中发酵8 d,然后进行倒罐,倒罐后在23 ℃条件下继续发酵10 d,分离酒脚得到各菌株发酵的原酒,将原酒转入玻璃罐密封,在20 ℃条件下陈酿30 d,得到猕猴桃酒[10]38-39。
1.2.6 猕猴桃酒理化指标测定 分别测定3株菌株发酵猕猴桃酒的酒精度、总酸、总糖、VC、干浸出物,测定方法按GB/T 15038—2006执行。
1.2.7 甲醇的测定
(1) 样品的预处理和溶液的配制:按GB/T 15038—2006执行。
(2)气相色谱条件:按GB/T 15038—2006执行。
(3)回收率的测定:根据文献[19~20],修改如下,向6个10 mL容量瓶中分别加处理好的样品至刻度线并加入内标物,分别向3个容量瓶中加入0.3 mL体积分数为2%的甲醇溶液,将6个样品处理后进行分析,按式(1)计算加标回收率。
(1)
式中:
c——回收率,%;
m1——加标样品中甲醇测定值,g;
m2——样品中甲醇测定值,g;
m3——加标甲醇的含量,g。
1.2.8 猕猴桃酒风味物质的测定
(1) 猕猴桃酒香气物质的萃取:取酿制的猕猴桃酒4 mL于样品瓶,向瓶中加入1 g NaCl,于40 ℃恒温水浴平衡5 min 后,将老化的萃取头插入样品瓶的上部,40 ℃条件下萃取40 min后,将萃取头拔出,GC解析5 min,进行猕猴桃酒香气物质分析[21-22]。
(2) GC条件:HP-5MS色谱柱(30 m×0.250 mm);升温程序初始温度40 ℃保持8 min,以5 ℃/min升至75 ℃,再以3.5 ℃/min升至125 ℃,再以5 ℃/min升至185 ℃保持1 min,再以10 ℃/min升至230 ℃保持20 min;载气为氦气,流速为1.2 mL/min,不分流;进样口温度为260 ℃。
(3) MS条件:电离方式EI,电离电压70 eV,灯丝流量0.25 mA,连接杆温度280 ℃,电子倍增器电压1 500 V,扫描范围30~350 AMU,离子源温度250 ℃。对检测到的香气物质在普库NIST11.L进行检索,选取匹配度在80%以上的物质确认为香气成分。并以归一化法计算各物质峰面积,作为各物质的相对含量。比较各菌株产生的酯类化合物,分析各菌株发酵的猕猴桃酒的生香性能。
1.2.9 数理统计分析 采用IBM SPSS Statistics 20软件对数据进行统计分析;采用OriginLab OriginPro 8.5软件作图。
2 结果与分析
2.1 菌株的鉴定
2.1.1 菌落形态的观察 菌株Q1、Q2、Q3的菌落形态和细胞形态见图1。
由图1(a)可知,菌株Q1、Q2、Q3具有典型的酵母菌菌落特征:菌落大而厚且为乳白色,单菌落为椭圆形、菌落表面光滑、黏稠、中央和边缘颜色均一。
由图1(b)可知,3株菌为典型的圆形酵母属,出芽生殖。
2.1.2 分子生物学鉴定 利用引物ITS1/ITS4对菌株Q1、Q2、Q3进行PCR扩增然后测序,Q1、Q2、Q3 3株菌株18S rDNA测序结果拼接后的有效序列长度分别为614,615,612 bp左右,将序列输入到NCBI进行同源比较,选取与菌株Q1、Q2、Q3序列相似的菌株序列,运用Clustalx软件进行比对,利用MAGE 5.1软件构建系统发育树,最后将序列在Gen bank上注册登录,获得登录号分别为SUB3257838、SUB3297127、SUB3297298,结果见图2。
由图2可知,菌株Q1、Q2、Q3的分支置信度为68%,同时3株菌株与菌株MeyerozymaguilliermondiiCBS 2030、MeyerozymaguilliermondiiCBS 2030、PichiaguilliermondiiATCC6 260的18S rDNA同源性为99%,分支置信度为88%,因此可以判定3株菌都属于季也蒙毕赤酵母。

图1 菌株Q1、Q2、Q3的形态特征
2.2 发酵力的测定
对菌株Q1、Q2、Q3进行发酵力测定,结果见图3。
由图3可知,3株菌在接种后能够迅速起酵,其中菌株Q2发酵速度最快在第2天到达发酵高峰期,在第4天完成主发酵,菌株Q3相对Q1发酵速度较缓在第4天达到发酵高峰期,在6~7 d完成主发酵,菌株Q1主发酵速度平缓,在6~7 d完成主发酵。通过8 d发酵菌株Q1、Q2、Q3发酵液总失重量分别为16.42,16.85,20.66 g。3株菌发酵力大小比较为:Q3>Q2>Q1。通过对3株菌的发酵力比较可以得出:3株酵母菌就发酵力和起酵速度方面能够用于猕猴桃汁的发酵。
2.3 耐受试验
2.3.1 酒精耐受试验 对菌株Q1、Q2、Q3进行酒精耐受试验,结果见表1。
由表1可知,在酒精体积分数8%和10%的条件下3株菌在48 h都能起酵。在酒精体积分数为14%条件下菌株Q1在72 h时起酵,菌株Q2在96 h起酵,Q3在48 h起酵。在酒精体积分数为16%条件下Q1、Q2不起酵,Q3在96 h起酵。说明菌株Q1、Q2能够在酒精体积分数为14%的条件下耐受,菌株Q3能够在酒精体积分数为16%的条件下耐受。通过对3株菌耐受的酒精体积分数和在相同酒精体积分数下起酵时间的对比可以得出:酒精耐受能力大小为Q3>Q1>Q2,3株菌对酒精的耐受方面能够满足猕猴桃酒的生产要求。

图2 菌株Q1、Q2、Q3系统发育
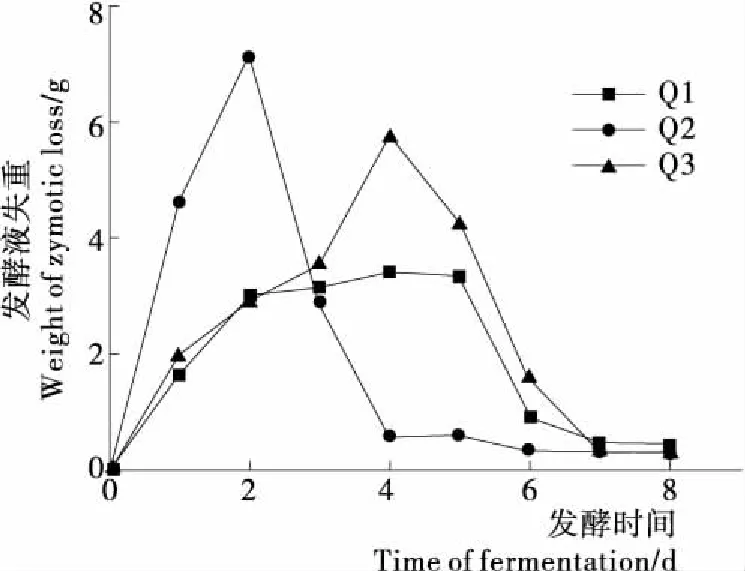
图3 各菌株发酵力曲线

菌株时间/h酒精体积分数/%810121416Q124-----48+++++++--72++++++++++-96++++++++++++++-Q224-----48+++---72+++++++++--96+++++++++++-Q324-----48+++++++++++-72+++++++++++++++-96+++++++++++++++++
† +表示气体量占杜氏小管的1/4;++++表示气体充满整个杜氏小管;-表示不产气。
2.3.2 二氧化硫耐受试验 对菌株Q1、Q2、Q3进行二氧化硫耐受试验,结果见表2。
由表2可知,在二氧化硫质量浓度为100 mg/kg的条件下,菌株Q1、Q2、Q3在18 h时均能起酵。在二氧化硫质量浓度为200 mg/kg的条件下,菌株Q2在24 h时产气量不能充满整个杜氏小管。在二氧化硫质量浓度为300 mg/kg的条件下菌株Q2不起酵,菌株Q1和Q3在48 h时产气量充满整个杜氏小管,但菌株Q3能在24 h起酵。通过对菌株Q1、Q2、Q3二氧化硫耐受试验的比较可以得出:二氧化硫耐受能力大小为Q3>Q1>Q2,3株菌对SO2的耐受能够满足猕猴桃酒工业的生产要求。

表2 二氧化硫耐受试验†
† +表示气体量占杜氏小管的1/4;++++表示气体充满整个杜氏小管;-表示不产气。
2.4 猕猴桃酒理化指标的测定
对菌株Q1、Q2、Q3发酵陈酿好的猕猴桃酒进行理化指标测定,结果见表3。
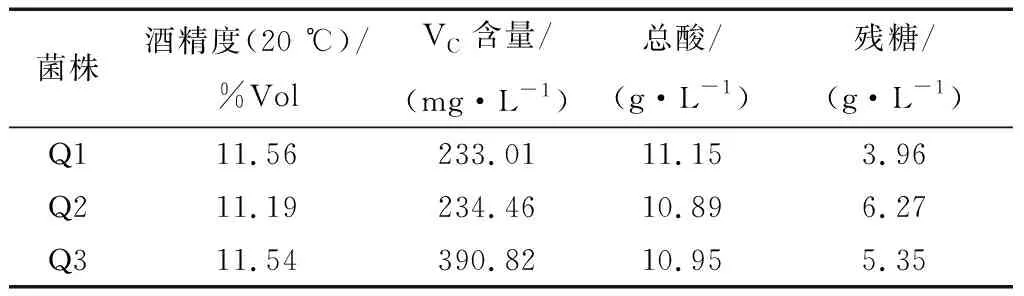
表3 猕猴桃酒理化指标测定
由表3可知,菌株Q1、Q2、Q3酿制猕猴桃酒的酒精度分别为11.56%,11.19%,11.54%Vol,总酸分别为11.15,10.89,10.95 g/L。残糖分别为3.96,6.27,5.35 g/L。其中菌株Q3发酵的猕猴桃酒Vc含量390.82 mg/L远远高于菌株Q1、Q2,是一株比较理想的菌株。
2.5 猕猴桃酒甲醇含量的测定
2.5.1 校正因子的测定 对甲醇、4-甲基-2-戊醇标准品的分离见图4,6次测定的相对校正因子见表4。

1. 甲醇 2. 乙醇 3. 4甲基-2-戊醇
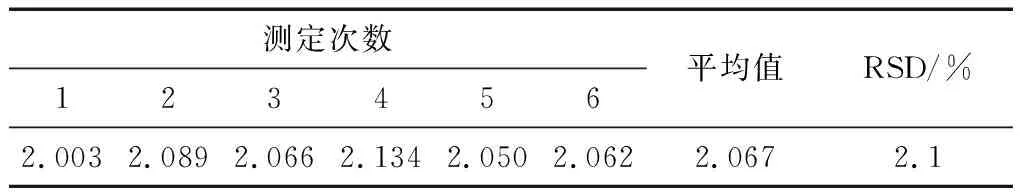
测定次数123456平均值RSD/%2.0032.0892.0662.1342.0502.0622.0672.1
由图4可知,甲醇和内标物质能够很好地分离,在本试验条件下甲醇出峰的时间在6.466 min附近,4-甲基-2-戊醇的出峰时间在15.173 min附近。由表4可知,平行测定6次时相对校正因子的相对标准偏差(RSD)为2.1%,根据以上试验数据求得校正因子为:f=2.067。
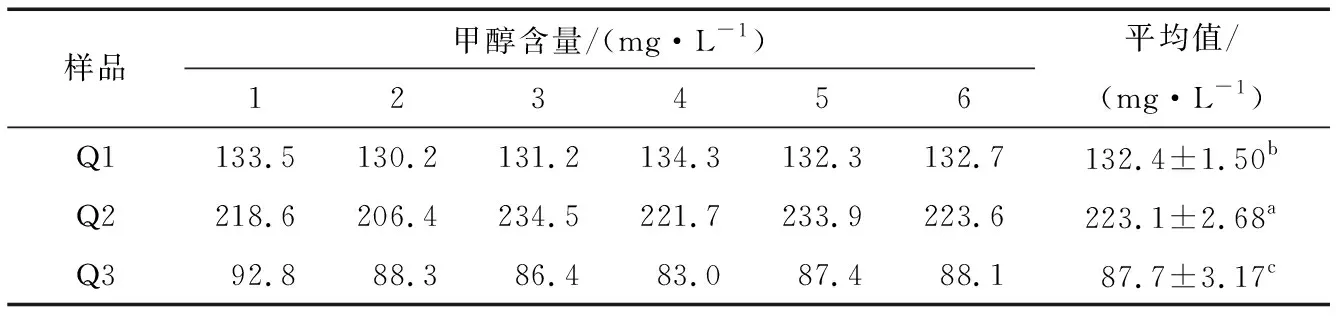
2.5.2 回收率试验和样品甲醇含量测定 加标回收率测定结果见表5,对菌株Q1、Q2、Q3发酵陈酿好的猕猴桃酒进行甲醇含量测定结果见表6。
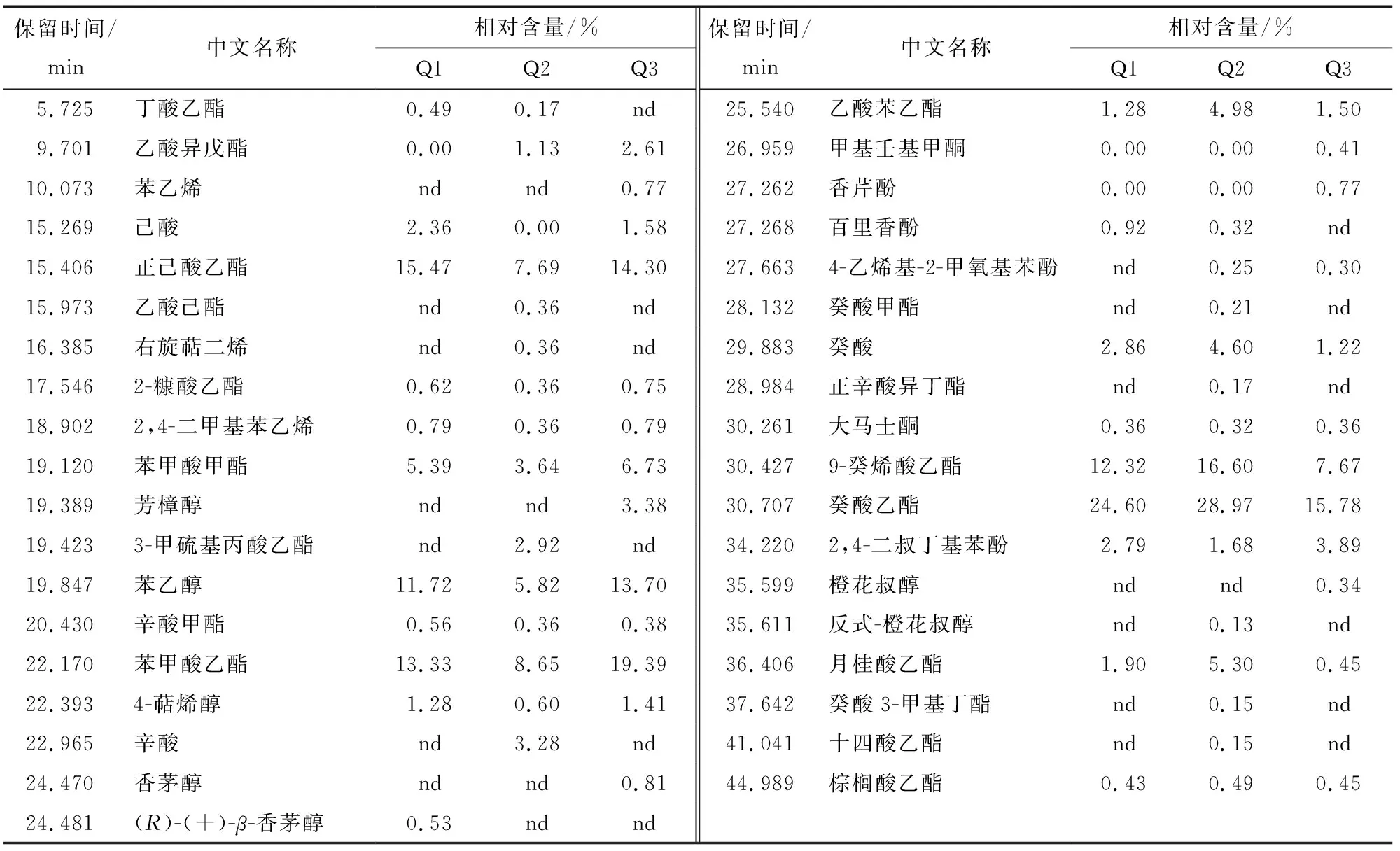
由表5可知,向Q3样品中加入474 mg甲醇后测得甲醇回收率为97.5%,RSD小于5%,说明在本试验条件下该方法能够用于猕猴桃酒中甲醇的测定。由表6可知,3株菌株发酵的猕猴桃酒中甲醇含量Q3 表5 甲醇加标回收率 表6 猕猴桃酒甲醇含量测定结果† † 不同字母表示不同处理之间差异显著,P<0.05。 将3株菌检测出的挥发性物质在普库NIST11.L进行检索,得到香气物质和相对含量分别见表7。 由表7可知,在本试验条件下对3株菌株发酵的猕猴桃酒香气物质的分析,菌株Q1发酵的猕猴桃酒鉴定出20种香气物质,Q2鉴定出29种,Q3鉴定出25种。其中菌株Q1发酵猕猴桃酒的香气成分酯类物质有11种,相对含量为总香气物质的76.39%,己酸乙酯占15.47%、苯甲酸乙酯13.33%、9-癸烯酸乙酯12.32%、癸酸乙酯24.60%,醇类3种相对含量为总香气物质的13.53%,苯乙醇11.72%、4-萜烯醇1.28%、(R)-(+)-β-香茅醇0.53%。菌株Q2发酵猕猴桃酒的香气成分酯类物质有18种,相对含量为总香气物质的82.3%,己酸乙酯7.69%、苯甲酸乙酯8.65%、9-癸烯酸乙酯16.6%、癸酸乙酯28.97%,醇类3种,苯乙醇5.82%、4-萜烯醇0.60%、反式-橙花叔醇0.13%。菌株Q3发酵猕猴桃酒的香气成分酯类物质有12种,相对含量为总香气物质的70.27%,己酸乙酯14.30%、苯甲酸乙酯19.39%、9-癸烯酸乙酯7.67%、癸酸乙酯15.78%,醇类4种,芳樟醇3.38%、苯乙醇13.70%、4-萜烯醇1.41%。酯类化合物是果酒中重要的风味物质,其中乙酯类化合物,主要呈现水果香和花果香[26],是香气的骨架成分[27],如乙酯类化合物在中国浓香型白酒中含量很高[26]。本研究筛选的株菌Q3发酵猕猴桃果酒的风味物质中乙酯类化合物相对含量很高,使得猕猴桃酒果香浓郁,赋予猕猴桃酒怡人的香气,如检测出的己酸乙酯似菠萝香蕉水果香、癸酸乙酯似葡萄香等。 本研究从猕猴桃表面分离、纯化获得3株能够发酵猕猴桃果酒的菌株,对菌株发酵力测定发现3株菌株发酵力强,发酵8 d后发酵液总失重均在16.00 g以上,其中菌株Q3的发酵液失重为20.66 g高于菌株Q1、Q2;各株菌在酒精体积分数14%、二氧化硫质量分数250 mg/L的发酵培养基中能够起酵,在酒精体积分数16%的培养基中只有Q3能够起酵;菌株Q1、Q2、Q3发酵的猕猴桃果酒甲醇含量均低于224 mg/L,菌株Q3发酵的果酒甲醇含量显著(P<0.05)低于其它菌株为87.7 mg/L;经过综合比较菌株Q3在发酵猕猴桃果酒方面优于其它2株,经过进一步驯化可考虑用于猕猴桃果酒的生产。对这3株菌株进行形态和分子生物学鉴定,3株菌均为季也蒙毕赤酵母,为今后猕猴桃果酒专用酵母的筛选提供理论支持。 表7 菌株Q1、Q2、Q3发酵猕猴桃酒的香气分析† † “nd”表示酒样中未检出到该香气成分。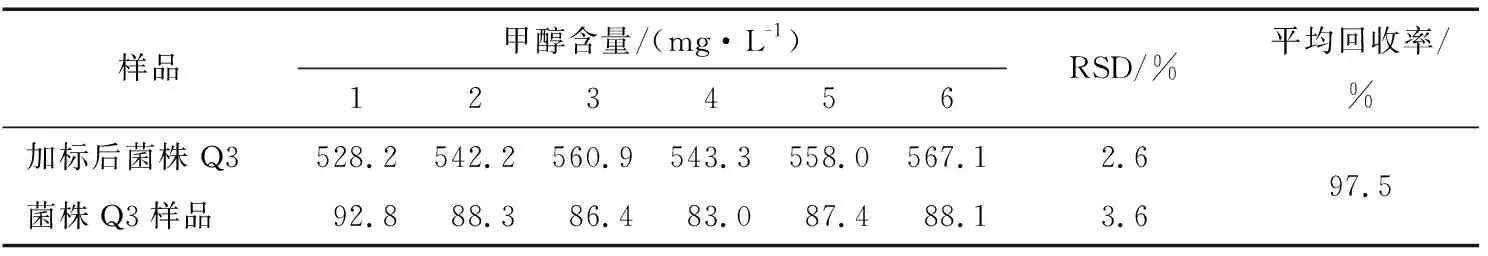
2.6 猕猴桃酒香气成分的测定
3 结论