白头翁总皂苷及其主要成分抗肿瘤药效及其构效关系的研究△
罗颖颖,严新,谢欣序,王木兰,冯育林,杨世林,李俊**
(1.江西中医药大学 国家工程研究中心,江西 南昌 330006;2.江西本草天工科技有限责任公司,江西 南昌 330006;3.江西中医药大学 第二附属医院,江西 南昌 330006)
白头翁Pulsatillachinensis(Bge.)Regel以干燥根入药,是临床常用中药,具有清热解毒、凉血止痢的作用,主要用于肠炎、热毒痢等[1]。以白头翁为主要的白头翁汤则在临床上广泛用于肠道感染及其结肠炎等病症[2-3]。近年来研究发现,白头翁具有较好的抗炎、抗肿瘤、降血糖、抗补体等多种作用[4-13]。我们前期的工作表明,白头翁总皂苷对癌有一定的抑制作用[14-15],值得进一步深入研究。我们在提取分离得到可测成分含量90%以上的白头翁总皂苷的基础上,进一步对总皂苷中主要成分进行了分离鉴定,得到白头翁皂苷B3、B7、B9、B11 4个单体成分,根据前期实验结果,选取白头翁皂苷抑制效果较好的人肝癌细胞SMMC-7721及人结肠癌细胞HT-29进行体外抗肿瘤活性观察,并采用小鼠H22肝癌模型进行4个单体皂苷成分体内抗肿瘤活性观察及其构效关系探讨,以期寻找白头翁皂苷中抗肿瘤作用的药效物质基础。
1 材料与仪器
1.1 材料
人肝癌细胞SMMC-7721(中国科学院上海生命科学研究院细胞资源中心);人结肠癌细胞HT-29和小鼠H22肝癌瘤株(中国医学科学院基础医学研究所基础医学细胞中心)。
白头翁药材,购于河北安国,产地为辽宁绥中市,经苏州大学药学院中药教研室李笑然教授鉴定为毛茛科白头翁属植物白头翁Pulsatillachinensis(Bge.)Regel的干燥根。白头翁总皂苷(批号:20110701)制备方法[16]:取干燥的白头翁药材,10倍量70%乙醇回流提取3次,每次1 h,得白头翁总皂苷。将白头翁总皂苷用1.0% NaOH水溶液碱水解反应6 h后放冷过夜,用盐酸调节pH 7.0,上D-101大孔树脂柱,依次用水,40%、75%、95%乙醇洗脱;收集75%乙醇洗脱液,减压浓缩,真空干燥即得棕褐色粉末状白头翁总皂苷。以白头翁皂苷B3为对照品,紫外测的总皂苷含量达90%。其中含白头翁皂苷B3 14.67%,白头翁皂苷BD 3.09%,白头翁皂苷B7 16.96%,白头翁皂苷B9 7.79%,白头翁皂苷B10 2.14%,白头翁皂苷B11 10.15%(HPLC)。
本实验中考察的白头翁总皂苷中有效成分有:白头翁皂苷B3(anemoside B3,化学名:3-O-α-L-吡喃鼠李糖-(1→2)[β-D-吡喃葡萄糖-(1→4)]-α-L-吡喃阿拉伯糖-常春藤皂苷,B3)、白头翁皂苷B7(anemoside B7,化学名:3-O-α-L-吡喃鼠李糖-(1→2)[β-D-吡喃葡萄糖-(1→4)]-α-L-吡喃阿拉伯糖-齐墩果酸皂苷,B7)、白头翁皂苷B9(anemoside B9,化学名:3-O-β-D-吡喃葡萄糖基-(1→4)-β-D-吡喃葡萄糖基-(1→3)-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖-齐墩果酸皂苷,B9)、白头翁皂苷B11(anemoside B11,化学名:3-O-α-L-吡喃鼠李糖基-(1→2)-α-L-吡喃阿拉伯糖-齐墩果酸皂苷,B11),由江西本草天工科技有限责任公司提供,其中各单体成分的纯度大于98%;环磷酰胺(CTX,江苏豪森药业股份有限公司,批号:101001)。
RPMI 1640培养基(批号:20110509)、DMEM-H培养基(批号:20110329)均购自北京Solaris公司。Ham’s F12培养基(美国GIBCO公司,批号:030M8309)。D/F12培养基:先将Ham’s F12培养基配制后,与DMEM-H以1∶1混匀,4 ℃备用;MTT(Sigma)工作液:使用时用PBS配制成5 mg·mL-1溶液,0.22 μm过滤,分装,-20 ℃备用。
1.2 仪器
超净工作台(日本SANYO);CO2培养箱(日本SANYO),倒置显微镜(德国OLYMPUS),低速离心机(上海飞鸽),酶标仪(ThermoMultiskan MK3)。
1.3 动物
SPF级KM小鼠,雄性,18~22 g,购自湖南斯莱克景达实验动物有限公司,合格证号:SCXK(湘)2009-0004。
2 方法
2.1 白头翁总皂苷及其化学成分体外抗肿瘤活性观察
细胞购进后,用含10%胎牛血清的相应培养基在37 ℃、5% CO2条件下培养,其中人肝癌细胞SMMC-7721培养于RPMI 1640培养基;人结肠癌HT29培养于D/F12培养基。取对数生长期细胞,调整密度为8×104个·mL-1,接种于96孔板中,每孔100 μL,24 h后加入不同浓度含药培养基100 μL,使药物终质量浓度为3.125、6.25、12.5、25、50 μg·mL-1,每个浓度设3个平行孔,对照组每孔只加培养基100 μL,另设空白对照组,不加细胞只加培养基的作为对照凋零组。将96孔板置37 ℃、5% CO2培养箱培养48 h,每孔加入5 g·L-1MTT 20 μL,继续培养4 h后,弃上清液,加入DMSO 150 μL,振荡溶解10 min,酶标仪于490 nm处测定吸光度(A)值。弃上清液,每孔加DMSO 150 μL,振荡混匀后用酶标仪在检测波长为490 nm条件下测A值,按公式(1)计算细胞抑制率,采用改良的寇氏法计算半数有效抑制浓度(IC50)[17]。
(1)
2.2 白头翁总皂苷及其化学成分体内抗肿瘤活性观察
取传代H22瘤株且生长良好的小鼠腹水,用0.9%氯化钠溶液将腹水瘤细胞稀释成2.5×106个·mL-1,每鼠0.2 mL接种于小鼠右侧腋窝皮下,建立荷瘤小鼠模型。接种24 h后,将成功接种的KM小鼠随机分为模型组,白头翁总皂苷高、低剂量组(300、150 mg·kg-1),B3、B7、B9、B11高、低剂量组(200、100 mg·kg-1),环磷酰胺组(40 mg·kg-1),共12组,模型组16只,其余每组12只,白头翁总皂苷及其有效成分组每日按体质量灌胃给药,给药体积0.2 mL·(10 g)-1,模型组每日给予等量0.9%氯化钠溶液,环磷酰胺隔日腹腔注射0.1 mL·(10 g)-1,连续14 d。末次给药24 h后,将小鼠引颈处死,剥离肿瘤,分析天平称质量,记录瘤质量,按公式(2)计算抑瘤率(%)。取胸腺、脾脏,分析天平称质量,记录脏器质量,按公式(3)计算脏器指数。

(2)
脏器指数=脏器质量(mg)/体质量(10 g)
(3)
2.3 数据分析

3 结果
3.1 白头翁总皂苷及其化学成分体外抗肿瘤作用研究
本研究主要观察比较了白头翁总皂苷及其主要活性成分B3、B7、B9、B11。这些主要成分都是由齐墩果酸皂苷为母核加上不同的糖组成(见图1)。
实验结果表明,白头翁总皂苷、B3、B7、B9、B11均能较强地抑制体外人肿瘤细胞增殖,抑制率可高达100%,见表1、2。从半数有效抑制浓度(IC50)值来看,白头翁总皂苷、B3、B7、B9、B11对SMMC-7721的IC50依次为(4.08±0.12)、(4.52±0.19)、(2.64±0.04)、(4.05±0.12)、(7.30±0.52)μg·mL-1,对HT-29的IC50依次为(3.22±0.06)、(4.28±0.16)、(2.57±0.10)、(3.29±0.11)、(5.39±0.26)μg·mL-1,均具有较好的体外抗肿瘤作用(见表3),其中以B7对两种细胞系均表现出较强的抑制作用(2.64、2.57 μg·mL-1)(F15,4=147.6,P<0.05)。比较B3和B7可见,23位的羟基化并不能提高相应的抑瘤活性。
3.2 白头翁总皂苷及其化学成分体内抗肿瘤作用研究
为了进一步确证白头翁总皂苷主要活性成分的抑瘤效应,我们又进行了小鼠荷瘤实验。结果表明,白头翁总皂苷的高、低剂量组,以及其他各活性成分的高剂量组瘤质量均明显减小,与模型组相比,具有统计学差异(P<0.05,P<0.01)。各活性成分中,B7(62.1%)抑瘤活性仍然最强。其次为B3(57.7%)、B9(55.9%)和B11(49.2%)。白头翁总皂苷表现出较好的抑瘤效应,高、低剂量组的抑瘤率分别为71.3%和61.8%。各组动物给药后,体质量、胸腺指数及脾脏指数都有所下降,但各组间无统计学差异(见表4、5)。

图1 白头翁4种齐墩果酸皂苷成分结构

表1 白头翁总皂苷及其化学成分对不同人肝癌SMMC-7721细胞的增殖影响

表2 白头翁总皂苷及其化学成分对不同人结肠癌HT-29细胞的增殖的影响

表3 白头翁总皂苷及各成分对SMMC-7721、HT-29细胞的

表4 白头翁总皂苷及其化学成分对肝癌H22荷瘤小鼠瘤质量的影响及各组抑瘤率
注:与模型组比较,*P<0.05,**P<0.01;下同。
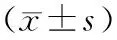
表5 白头翁总皂苷及其化学成分对肝癌H22荷瘤小鼠瘤质量的影响及各组抑瘤率
4 讨论
本研究对白头翁总皂苷及其4种主要成分进行了体内外抑瘤实验观察,结果表明,白头翁总皂苷及其化学成分B3、B7、B9、B11对体内外瘤细胞均具有一定的抑制作用。体外抗肿瘤实验中,对人肝癌SMMC-7721及人结肠癌HT-29的IC50值在5 μg·mL-1左右,4种单体成分与白头翁总皂苷作用相当。体内对小鼠H22肝癌移植瘤模型的药效实验表明,B3、B7、B9、B11大剂量组(200 mg·kg-1)对小鼠H22肝癌均表现出明确的抑制作用,白头翁总皂苷高(300 mg·kg-1)低(150 mg·kg-1)剂量均表现出明确的抑瘤作用。本实验结果与文献报道的基本一致[18-20],因此,白头翁皂苷的抗肿瘤作用是肯定的。
有研究表明,白头翁皂苷中齐墩果酸皂苷对瘤细胞抑制作用强于罗烷型皂苷[21]。我们的实验结果也表明了齐墩果酸皂苷对瘤细胞的抑制作用。白头翁的4个主要成分均是以齐墩果酸皂苷为母核的衍生物。其中B3和B7所连接的糖一致,只是在碳23位有羟甲基的不同,B7在碳23位是甲基,B3在碳23位是羟甲基。B9和B11的母核基本同B7,只是在所连接的糖的排列顺序及其数量不同。从实验结果来看,B7在体内外抑瘤实验中均表现出较强的抑瘤活性,提示这种抑瘤活性与所连接的糖的顺序和数量有关,与碳23位的羟基化无明显关系。B9由4个糖连接,比B11多2个糖,但是B9的抑瘤活性强于B11和B3,提示糖的数量对其抑瘤活性有一定的影响。体内抑瘤实验结果与体外趋势基本一致,最强的是B7,最弱的是B11。
值得注意的是,总皂苷的活性在整体动物实验中表现出更强的抑瘤作用,其药效强于各单一成分,但是在体外抑瘤实验中,总皂苷并未表现出最强的活性。提示除了此4个成分外,总皂苷中可能还有其他的协同效应成分。同时也表明荷瘤小鼠的内环境对于药物药效的总体产生起到一定的促进作用,一些体外未表现出明显活性的成分在体内微环境下可能会产生协同的效应[22-23],如此尚有待于进一步研究。另外,本研究也提示白头翁总皂苷作为一个复合物,其有效物质并不是某一成分,而是不同成分作用于不同靶点,产生协同或相加作用,体现了中药多成分、多途径、多靶点的作用特点[24]。中药药效物质基础的研究是中药现代化的主要内容之一,只有在药效物质基础明确的基础上,才能有效地进行相关中药有效部位的研究开发以及有效单体成分的研究开发,才能为研究高效低毒、成分明确、质量稳定的高水平中药新药奠定良好的基础。本工作对于进一步深入认识白头翁皂苷及其相关产品开发提供了实验依据。
致谢:感谢清华大学生命科学学院杜力军教授对本文提出的宝贵建议。

