内镜下全层切除十二指肠黏膜下肿瘤的临床疗效分析
范文阶, 姜 飞, 王 晖, 陆品相, 郭 琦, 钟芸诗
1. 上海市徐汇区中心医院普通外科,上海 200031 2. 复旦大学附属中山医院内镜中心,上海 200032
十二指肠黏膜下肿瘤(SMT)较少见,大多数患者没有明显临床症状[1-2]。虽然内镜下治疗胃肠道肿瘤应用越来越多[3-4],但十二指肠病变部位特殊,内镜下切除尤其内镜下全层切除术(EFR)治疗十二指肠SMT的应用并不多。
因此,本研究回顾性分析我院12例十二指肠SMT行EFR术的临床经验,为后续进一步的临床实践提供参考。
1 资料与方法
1.1 一般资料 徐汇区中心医院内镜中心2015年4月至2017年12月行内镜下切除十二指肠黏膜下病变(SMT)45例,其中26.67%(12/45)行内镜下十二指肠EFR,其余33例患者接受内镜黏膜下剥离术(ESD)治疗(表1)。12例患者中男性8例,女性4例,年龄22~67岁,平均(44.8±24.4)岁。病变最大径1.0~7.0 cm,平均最大径(3.38±0.4)cm;病变位于球部8例,降部3例,球降部交界处1例。所有患者均行CT检查以了解病变生长方式和与腔外器官的关系。其中4例CT提示向腔外生长。术前均经超声内镜检查,术中判断肿瘤层次后行EFR。所有患者均知情同意并签署知情同意书,本研究经医院伦理委员会审核批准。
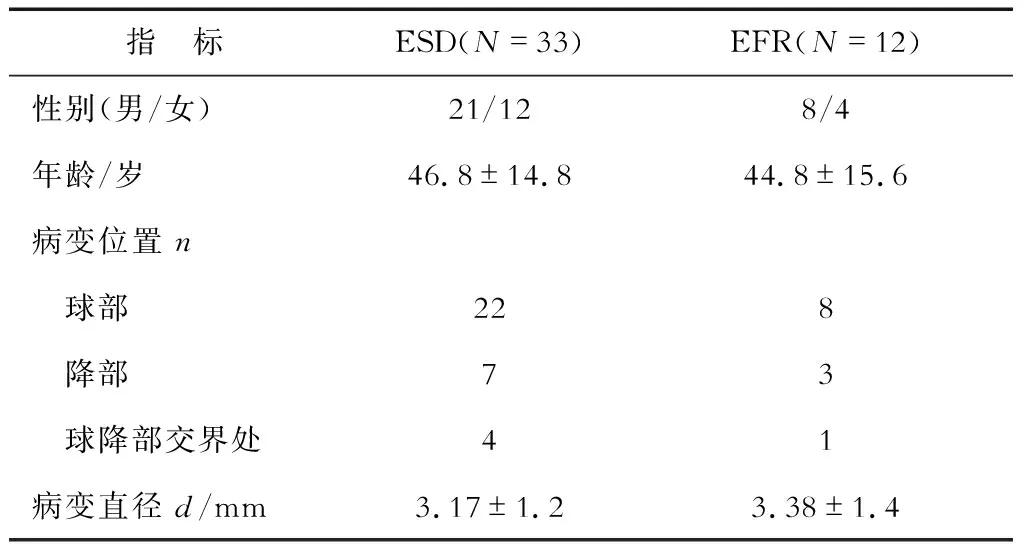
表1 患者一般临床资料
1.2 内镜下全层十二指肠切除术治疗SMT
1.2.1 主要器械 ERBE公司海博刀,IGG-200高频电切装置和APC300氩离子凝固器;Olympus公司GIF Q260Z胃镜,GIF-2T240双钳道胃镜,EU-M 30 内镜超声系统,微超声探头采用UM-2R和UM-3R,频率分别为12 MHz、20 MHz。D-201.11802透明帽,KD-620LR HooK刀,NM-4L-1注射针,FG-8U-1异物钳,SD-230U.20圈套器,FD-410LR热活检钳,HX-600-135止血夹,CO2气泵。
1.2.2 超声内镜检查 胃镜检查发现十二指肠SMT病灶后,采用脱水充盈法对病灶进行超声扫描,观察病变大小、外形、边界、内部回声强度及起源于十二指肠壁层次。
1.2.3 EFR切除十二指肠SMT 术前空腹,采用气管插管全身麻醉。EFR步骤如下(图1),标记:应用氩气刀于黏膜隆起病灶边缘进行电凝标记。注射:于标记点外侧黏膜下多点注射靛胭脂和含肾上腺素的0.9%氯化钠溶液。切开病变外侧黏膜:用海博刀和IT刀沿标记环切开十二指肠黏膜。切除病灶:用IT刀沿病灶边缘进行黏膜下剥离,判断病灶位置深,同固有肌层关系密切时,决定全层切除,用IT刀沿病灶边缘全层切除病灶。创面处理:应用氩离子凝固术(APC)或热活检钳处理创面出血点和可见的小血管,必要时金属止血夹钳夹处理出血点,止血完全后改用双钳道治疗镜,使用金属钛夹和尼龙绳“荷包缝合”缝合创面。

图1 EFR全层切除十二指肠SMT
A:十二指肠黏膜下肿块;B:标记后切开;C:ERBE公司海博刀全层切除;D:尼龙绳缝合创面;E:缝合后;F:完整切除标本
1.3 术后处理及随访 EFR术后于内镜下常规放置胃管,置于十二指肠创面下5 cm,术后患者半卧位,予禁食、十二指肠引流,预防感染,抑制胃酸分泌,补液等处理。观察有无迟发性出血,腹腔感染等。术后第1天均行上腹部CT检查了解腹腔内渗出情况。一般于术后第5天拔除胃管,逐步进食流质、半流质饮食。1个月后随访内镜,观察创面愈合情况,术后3、6、12个月各复查1次,之后建议患者每年复查。
2 结 果
2.1 手术情况 结果(表2)表明:12例十二指肠SMT均一次性行EFR完整切除,病灶起源于固有肌层。术前超声检查结果与术中评估对照,病灶起源层次基本一致,为11/12(91.67%),内镜治疗耗时28~55 min,中位时间40.5 min,住院时间6~12 d,中位住院时间8 d。术后病理:胃肠道间质瘤(GIST)6例,Brunner腺瘤2例,脂肪瘤1例,类癌1例,异位胰腺1例,囊肿1例。
2.2 术后随访及并发症处理 术中出血:术中活动性出血予氩气电浆凝固术(APC)和(或)热活检钳处理;2例术中因出血量大(约250 mL),上述方法止血效果不佳,予快速切除病灶,冲洗创面,充分显露出血点后,热活检钳电凝止血加金属夹钳夹处理后成功止血。术后迟发性出血:2例术后第3天胃管内有间断性鲜红血,出现迟发性出血,1例经保守治疗后出血停止,1例经再次内镜下止血成功。术后疼痛:术后4例患者出现中上腹部较剧烈持续性疼痛,多次腹部CT检查提示手术区域有少量渗液,经保守治疗2 d后疼痛缓解。12例患者无1例因出血或无法缝合创面而中转外科手术或死亡。12例患者接受了2~31个月随访,无进食习惯改变及腹部不适、无狭窄。随访1个月时内镜检查创面基本愈合。
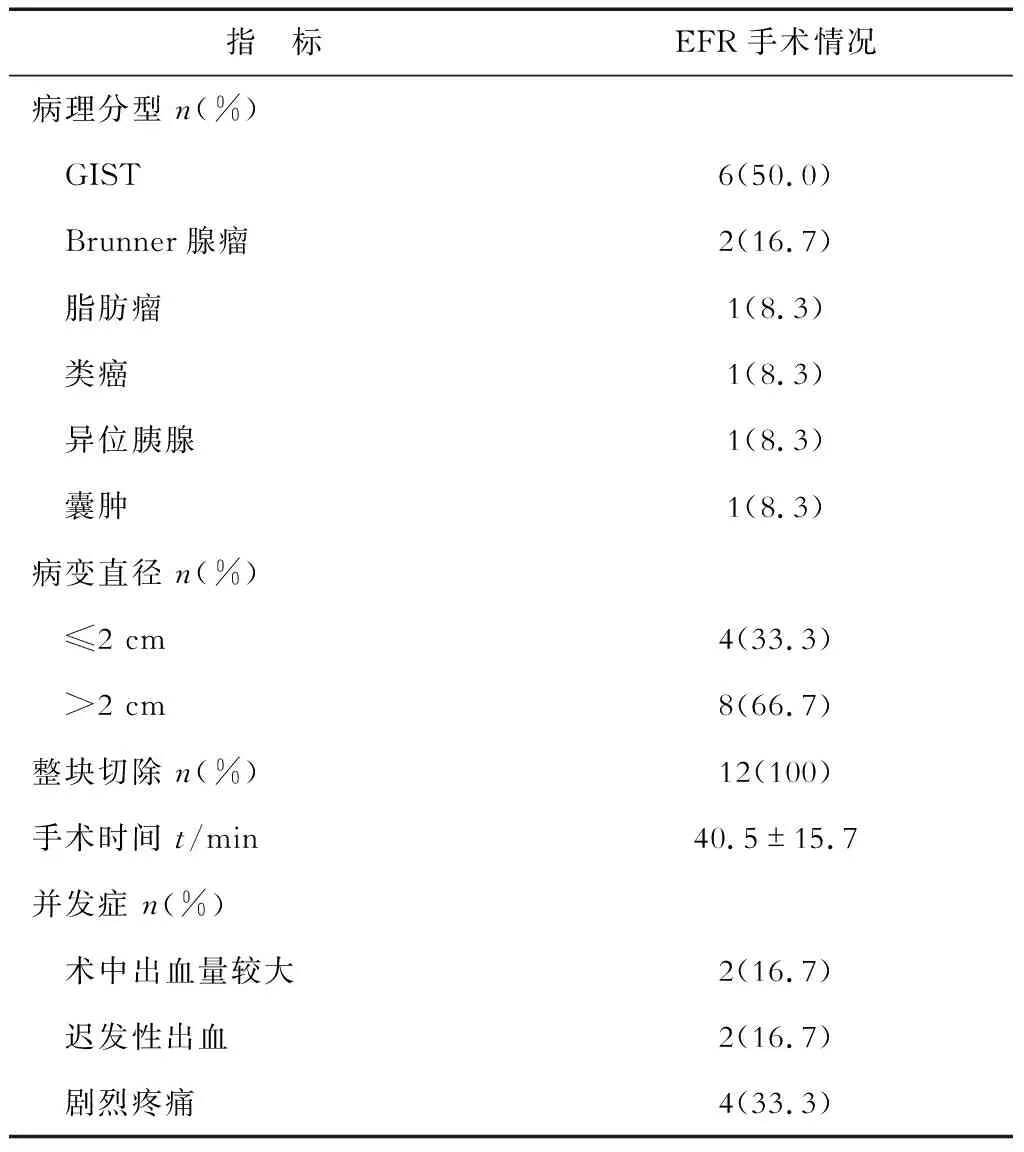
表2 十二指肠SMT行EFR手术情况分析
GIST:胃肠道间质瘤
3 讨 论
原发性十二指肠肿瘤发病率低(0.02%~0.59%),该部位SMT的发病率更低[1]。十二指肠SMT的临床表现与肿瘤的大小和部位有关,主要表现为恶心、呕吐、上腹部疼痛等。由于SMT症状不典型,诊断常较困难。其内镜下形态多样,多表现为黏膜下隆起,而黏膜表面完整。内镜超声目前是术前诊断消化道黏膜隆起性病变尤其是SMT的最好方法[2]。十二指肠SMT病理类型多样,包括Brunner腺瘤、异位胰腺、炎症、脂肪瘤、GIST及囊肿等,尤以前两者多见。本研究病理资料显示,GIST 6例,Brunner腺瘤 2例,以GIST最多见,可能与纳入研究的病例起源于肌层有关。
十二指肠SMT尚无明确的治疗指南,GIST、类癌均有恶性潜质[5],异位胰腺、Brunner腺瘤则有恶变可能[2,6]。十二指肠SMT首选治疗方法为外科手术切除,包括胰十二指肠切除术、十二指肠节段切除、十二指肠肿瘤局部切除等。十二指肠位置特殊,与胰腺关系密切,手术创伤大,易造成严重术后并发症,因此患者常难以接受。近年来随着超声内镜和内镜黏膜下剥离术(ESD)的广泛开展,对于绝大多数十二指肠SMT均能通过内镜手术切除,但对于瘤体较大、瘤体与浆膜层紧密连接,特别是向腔外生长的间质瘤,ESD术往往对瘤体切除不完整,手术操作时间长,出血量大,术中穿孔等并发症发生率高,甚至需要中转开腹。随着ESD技术的提高,出现了对部分消化道黏膜下病变进行全层切除的技术,即EFR。
近3年来,本院共施行了45例十二指肠SMT内镜下切除术,其中12例因瘤体大,与固有肌层紧密连接或肿瘤向腔外生长,施行了内镜下EFR术。术前充分准备,在手术室做好腔镜联合或开腹手术准备。具体操作:沿病灶标记,环形切开正常黏膜剥离显露病灶,证实病灶来源于固有肌层,与固有肌层联系紧密或向腔外生长;使用IT刀沿病灶边缘环形全层切除(IT刀由于刀前缘绝缘,不易损伤十二指肠腔外脏器);术中避免切除病灶掉入腹腔,可用牙线将病灶固定于十二指肠黏膜上,通过圈套器取出病灶;改用双钳道,对创面用金属钛夹和尼龙绳进行荷包缝合。12例SMT行内镜下EFR手术,均顺利完整切除病灶,手术耗时较ESD时间短,切除病灶需约20 min,整个手术中位耗时约40 min。
由于十二指肠解剖位置特殊,肠腔弯曲,操作空间狭小,且与胆管胰管毗邻,手术难度大,需要具有丰富内镜手术经验的医师才能胜任。EFR的并发症主要包括术中出血、术后迟发性出血、创面缝合不严密外渗、术后十二指肠狭窄梗阻。术中出血影响内镜下手术视野,可导致手术失败而中转手术,因此术中即刻出血预防和处理显得至关重要[7-8]。术中边缘动脉出血,出血量大,巧用玻璃帽压迫,冲洗显露出血点,热活检钳电凝止血。本组2例术中出血量较大,约250 mL,其中1例冲洗显露创面边缘出血点,热活检钳电凝止血成功;另1例电凝止血失败,快速切除病变,冲洗显露边缘出血点,金属钛夹夹闭止血成功。由于创面暴露在十二指肠液胰液和胆汁中,术后迟发性出血和渗漏是严重的并发症。为预防术后迟发性出血,病灶完整切除后,创面边缘仔细搜寻渗血情况和出血,予以APC处理和热活检钳电凝止血。术中胃镜直视下将胃管置于十二指肠创面下方。术后禁食、抗炎、抑制胃酸分泌、生长抑素抑制胰酶分泌。胃管及时引流十二指肠液,减少胃液、十二指肠液对创面刺激及外渗。严密观察引流液颜色和腹部体征。术后24 h行腹部CT检查,了解创面周围和腹腔渗出情况。本组12例患者均予以十二指肠引流和术后第1天常规腹部CT检查。2例术后第3天出现胃管内鲜红血液,考虑为迟发性出血。1例经保守对症处理出血停止;另1例经再次胃镜检查发现创面有活动性出血,予以热活检钳电凝止血后出血停止。4例出现中上腹部持续较剧烈腹痛,CT提示创面周围和后腹膜有少量渗出,经胃管引流和对症处理,第2天腹痛明显缓解。复查CT创面周围渗出缓解。12例无1例中转手术或术后外科手术处理。平均住院8 d后出院。12例患者随访1个月时创面基本愈合,无狭窄梗阻。
综上所述,内镜下EFR是一种一次性整块完整切除病灶的微创治疗方法,安全有效,较外科手术治疗创伤小,代表了内镜治疗发展方向。Sakon等[9]认为,对于胃镜、超声内镜及CT提示病变体积较大(最大径>3 cm),与固有肌层密不可分,尤其向腔外生长为主的十二指肠SMT,可行腹腔镜联合内镜技术(LECS)。该类患者经严密术前准确评估和准备,术后积极十二指肠引流及抗炎、抑酸、抑酶治疗处理,内镜下EFR术后可恢复快。因此,内镜下EFR可作为十二指肠SMT,特别是向腔外生长病变内镜微创治疗的选择之一。

