多体素氢质子磁共振波谱与胶质瘤病理指标的相关性分析
沈 晓, 王尔松
复旦大学附属金山医院神经外科,上海 201508
多体素氢质子磁共振波谱(proton magnetic resonance spectroscopy,1H-MRS)是一项无创性获取活体组织细胞代谢及生化信息的技术,通过测定脑组织及肿瘤内代谢物浓度及比值的变化可实现对病变的定性与定量诊断。本研究分析了脑胶质瘤1H-MRS代谢参数与病理金标准的相关性,为临床利用1H-MRS确定胶质瘤级别、了解胶质瘤的代谢情况及指导最大安全范围全切除胶质瘤提供参考[1-2]。
1 资料与方法
1.1 一般资料 选择2012年1月至2014年10月入住复旦大学附属金山医院的胶质瘤患者18例,所有患者未接受过开颅手术或放、化疗。其中,男性12例,女性6例;年龄21~69岁,平均(40.3±15.3)岁。肿瘤主体位于额叶11例,颞叶2例,顶叶2例,岛叶、基底节及丘脑各1例,肿瘤体积24.0~62.3 cm3。临床表现:肢体乏力11例,言语功能障碍6例,嗜睡、头痛4例。最终手术全切除11例,次全切除5例,仅行活检2例。
1.2 常规磁共振成像及波谱检查 术前1~2 d采用3.0 T磁共振(Siemens Magnetom Verio),8通道头部线圈。对比剂为钆喷酸葡胺(0.1 mmol/kg,GE Healthcare,Ireland)。常规磁共振扫描参数和序列:矢状为T1W-FLAIR(TR/TE/TI 2 000/9/860 ms),横断面TSE(TR/TE 6 000~7 540/95~98 ms),横断面T1W-FLAIR(TR/TE/TI 2 000/9/860 ms),横断面T2W-FLAIR(TR/TE/TI 8 500/94/2 440 ms),横断面GRE序列(TR/TE 2 000/9 ms)。根据胶质瘤是否强化,导航采用MPRAGE(TR/TE/TI 1 900/2.94 /900 ms,FOV 250 mm×250 mm,层厚1 mm,176层)或TSE(TR/TE 3 200/332 ms , FOV 250 mm×250 mm,层厚2.0 mm,64层)。1H-MRS采用多体素点分辨波谱成像序列(pointed-resolved spectroscopy sequence, PRESS),参数如下:TR/TE 1 700/135 ms,层厚15 mm,PES 16×16 , FOV 120 mm×120 mm。在PRESS序列激发前,应用CHESS序列抑制水峰。波谱检查用T2W显示胶质瘤最大径层面。感兴趣区包含胶质瘤增强区或T2W显示的异常信号区、肿瘤周围区域及对侧正常脑组织。同时避免来自头皮脂肪及颅骨脂质的污染,应用饱和带减少化学位移产生的伪影,体素大小为7.5×7.5×15 mm3。波谱信号采集约需9 min,原始数据及解剖参考图导入Syngo MultiModality工作站。
1.3 图像与数据分析 各体素的1H-MRS参数数值在工作站由磁共振自带软件Spectroscopy计算获得。通过拟合曲线获取感兴趣区代谢物的空间分布,在单个体素基础上评估体素参数(高度、宽度、面积)。在解剖图上叠加网格可以显示每个体素的解剖部位。网格由256 (16×16)个体素组成,每个体素按序分配1个编号。
1.4 选择与标记穿刺靶点 术前采集MRS原始数据和导航数据后均导入MAC Pro计算机中,根据MRS参数特征及常规磁共振图像,分别在肿瘤核心区及肿瘤周边区域连续选取5个左右穿刺靶点。靶点尽可能位于一直线上,且尽量避开功能区、传导束及较大脑血管;由于高级别胶质瘤中心严重坏死或被破坏,对于波谱定量影响较大,亦酌情予以避开。完成设计穿刺轨迹后,记录每个活检靶点的编号,并在导航影像中标记备用。其中,肿瘤核心区界定为胶质瘤的强化区或T2高信号区,与肿瘤核心区1个体素距离的范围界定为近瘤周,其余均定义为远瘤周。
1.5 组织活检 将标记好靶点的导航数据传至导航系统工作站,根据手术计划在导航系统软件上将其与其他影像序列进行融合。所有穿刺操作由同一名高年资神经外科主治医师完成。所有病例均在开颅手术前行导航下穿刺取材,以使所选取的体素与实际留取的组织标本精确匹配。穿刺术中应尽量使取材组织的解剖位置及体积与相应体素吻合,组织样本可在靶点4个方向上抽吸获取,抽吸后保留穿刺针3~5 min,确保穿刺后无活动性出血。
1.6 标本处理 18例患者术中平均穿刺5个活检靶点,最终获取89个标本。所有活检标本经4%甲醛溶液固定后进行石蜡包埋、切片、苏木精-伊红(H-E)染色。应用EnVision法进行免疫组织化学染色,所用一抗如下:CD34(Dako, 单克隆;1∶200), 神经胶质纤维酸性蛋白(GFAP,Dako, 克隆6F2, 单克隆;1∶200),单克隆抗体(MIB-1,Dako, 克隆MIB-1, 单克隆;1∶200)。H-E和免疫组织化学染色结果由2位神经病理专科医师根据2007年第4版《WHO中枢神经系统肿瘤》分类标准独立进行诊断,对于形态和分级有争论的病例经讨论后达成一致意见。
1.7 免疫组织化学染色分析 (1)细胞密度:对苏木精衬染细胞核的切片随机取5个(×200)。GFAP阳性的细胞标记为肿瘤细胞,同一视野内的肿瘤细胞和胶质细胞计为总细胞,计算肿瘤细胞占总细胞的百分比。(2)CD34:先用低倍镜(×40)找出肿瘤微血管密集区,然后在高倍镜(×200)下找出CD34抗原染色阳性的内皮细胞,只要与临近组织有明显区别便计为1个血管,每个标本观察5个高倍视野并取平均值作为该病例的微血管密度值。(3)MIB-1指数:对MIB-1免疫组化标记切片随机取5个高倍镜(×200)视野,计算肿瘤细胞占总细胞的百分比平均值。
1.8 统计学处理 采用SPSS 16.0软件进行分析,分别将MRS代谢物比值胆碱(Cho)/N-乙酰天冬酰胺(NAA)、NAA/肌酸(Cr)、Cho/Cr与上述3个病理指标进行Pearson线性相关分析。检验水准(α)为0.05。
2 结 果
2.1 病理情况 结果(表1)表明:18例患者中,Ⅱ级胶质瘤6例,Ⅲ级胶质瘤5例,Ⅳ级胶质瘤7例。共采集89个病理活检标本,高级别(Ⅲ级及以上)胶质瘤都含有2种或以上级别胶质瘤成分。
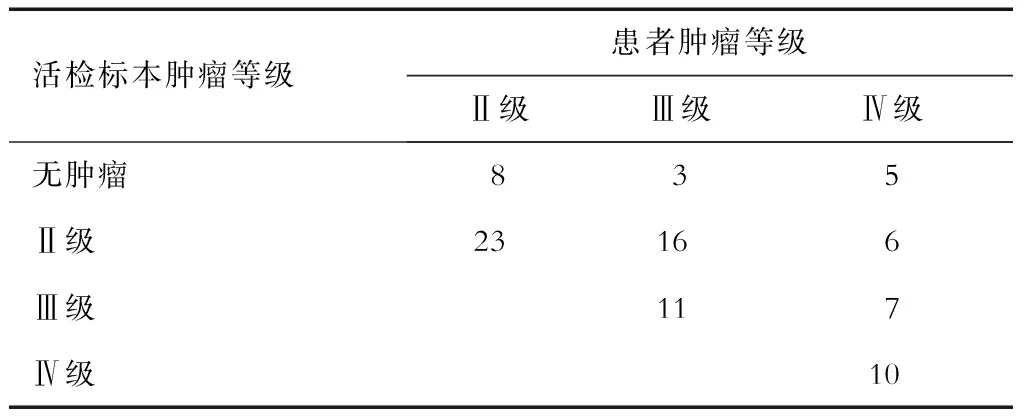
表1 活检标本及患者的病理分级
2.21H-MRS与病理指标的相关性 结果(表2)表明:Cho/NAA比值与细胞密度、CD34及MIB-1指数均正相关;NAA/Cr比值与细胞密度、CD34及MIB-1指数负相关;Cho/Cr比值与细胞密度正相关,与CD34及MIB-1指数之间无相关性。图1为1例典型病例的1H-MRS及对应的病理检查结果。
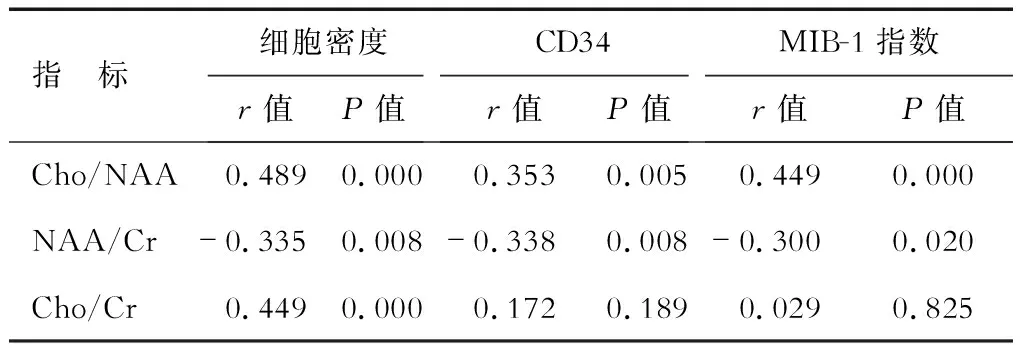
表2 MRS参数与病理指标间的关系
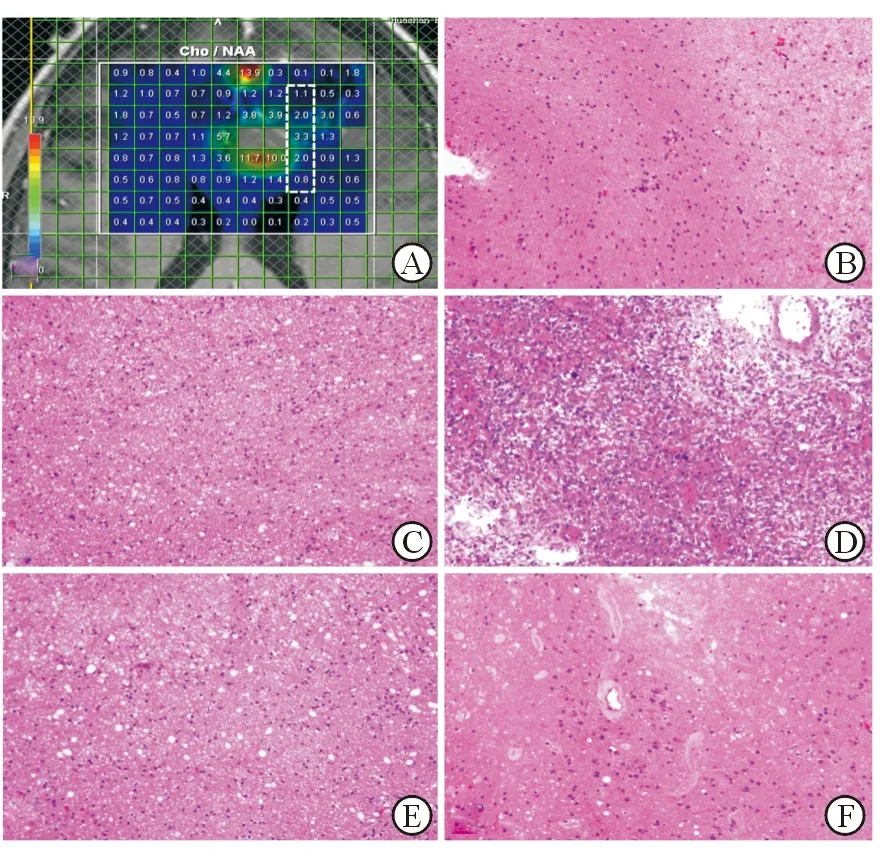
图1 1H-MRS及病理检查典型结果
患者男性,56岁,病理诊断为胶质母细胞瘤. A:白色实线框内为感兴趣区,所有体素上标有Cho/NAA比值,白色虚线框内是穿刺靶点对应的5个体素,由浅入深定义为第1~5号靶点. B,C,D,E,F分别对应第1~5号靶点. B:Cho/NAA比值为1.1;C:Cho/NAA比值为2.0;D:靠近肿瘤核心,Cho/NAA比值为3.3,病理显示肿瘤细胞重度浸润;E:Cho/NAA比值为2.0,肿瘤浸润程度与C基本相似;F:Cho/NAA比值为0.8, 受肿瘤浸润程度较B轻
3 讨 论
脑胶质瘤是常见的中枢神经系统肿瘤之一,我国发病率为3.13/10万。该病因侵袭性强、致死率高、易复发而引起人们的关注。目前临床常规MRI可以显示胶质瘤形态学边界[3],但不能提供肿瘤内微脉管系统血管生成、代谢物改变或细胞构成等方面的信息。MRS能通过测定脑组织及肿瘤内某些代谢物的浓度及比值变化,实现对病变的定性与定量诊断,从而弥补常规MRI成像的不足。谱线是MRS主要的表现形式,代谢物的浓度用波谱图特定频率范围内的波谱峰下的面积来表示[4]。本研究采用相对定量的方法表示代谢物浓度,采用3个参数,即Cho/NAA、NAA/Cr及Cho/Cr;用于对照的病理学指标为胶质瘤细胞密度、CD34及MIB-1标记指数。
细胞密度是指肿瘤细胞数与总细胞数的百分比。McKnight等[5]报道,Cho/NAA、Cho/Cr与胶质瘤细胞密度呈正相关;Croteau等[6]用成层法分析发现,上述代谢产物与胶质瘤级别也有很好的相关性;Ganslandt等[7]研究显示,胶质瘤中心区域Cho/NAA比值较瘤周更高。本研究结果与上述研究结论基本一致。NAA含量多少与神经元及轴突数量有关;Cho反映了细胞膜的运转功能,细胞膜前体及胆碱类代谢物的降解产物增加导致Cho升高[8-10]。本研究发现,Cho/NAA、NAA/Cr及Cho/Cr均与细胞密度之间存在相关性,其中Cho/NAA、Cho/Cr与细胞密度正相关,NAA/Cr与细胞密度负相关。其原因在于:胶质瘤细胞快速增殖使细胞膜代谢异常增高,导致Cho增高,而神经元的破坏及轴突数量减少导致NAA下降。McKnight等[5]还认为,Cho/NAA是识别胶质瘤变化及胶质瘤细胞浸润程度的敏感指标。本研究显示,该指标与细胞密度的相关指数高于NAA/Cr及Cho/Cr,可能原因在于Cho/NAA比值能反映肿瘤区的化合物含量的整体变化;随着肿瘤恶性程度的升高,该比值进一步升高[11-12]。
血管生成是胶质瘤的一个重要特征。CD34作为常用的血管内皮标志物,可以反应新生血管的生长代谢状况。Toyooka等[1]报道,Cho总含量与肿瘤血管容量有很好的相关性。本研究结果显示,Cho/NAA比值与CD34正相关,NAA/Cr与CD34负相关,与研究[1]结果相似。然而,本研究显示,Cho/Cr与CD34无相关性,原因可能在于本研究基于相对定量,且Cr与肿瘤浸润程度相关性差[13]。Cho/Cr虽然不能直接反应肿瘤微血管生成情况,但是高Cho浓度往往提示肿瘤细胞增殖活跃,肿瘤细胞密集区局部缺氧刺激血管内皮生长因子释放,导致新生血管密集生成。而肿瘤代谢活跃的区域同时伴有神经元的破坏,导致NAA下降。因此,推测Cho/Cr及NAA/Cr可以间接反映胶质瘤新生血管的生长情况。
Ki-67是一种与细胞增殖密切相关的核抗原。MIB-1抗体可与Ki-67结合,用于预测脑肿瘤级别、生长代谢及预后。目前,关于MIB-1指数与胶质瘤MRS参数及预后关系的研究[5-6]较多。Nafe等[14]研究显示,Cho/NAA与MIB-1指数不相关;Tamiya等[8]认为,Cho/NAA、Cho/Cr与MIB-1指数正相关;Shimizu等[15]研究结果认为,Cho浓度与MIB-1正相关,而与Cho/NAA、Cho/Cr值的线性相关性较弱。造成上述研究结果差异的原因可能在于其多采用单体素,同一胶质瘤内只留取1个组织样本。由于单体素波谱体素范围过大,容易受脑脊液、坏死成分等影响,坏死成分较多的体素内代谢物浓度被稀释,导致相对定量比值偏倚,从而干扰研究结果。另外,体素的大小往往大于病理活检获取的组织,通过穿刺活检获取的组织样本不能反映整个体素内的组织代谢信息。即使进行开颅手术活检,由于术中脑移位,导航下取样部位也往往不能与MRS采样体素精确匹配。本研究为避免以上不足,所有病例均采用多体素,术前利用自主设计软件Biopsy NAV将靶点体素标记于导航影像中,并在开颅术前穿刺获取组织,以避免脑移位,较以往研究更为精确。本研究发现,Cho/NAA与MIB-1指数正相关,NAA/Cr与MIB-1指数负相关,与研究[8,15]相似;而Cho/Cr在本次研究中与MIB-1指数没有相关性,可能与本研究样本中胶质母细胞瘤所占比例偏高,Cr减少较为明显[16]有关。
本研究发现,MRS相对定量参数与胶质瘤细胞的密度、CD34及MIB-1指数密切相关,而以上病理指标与肿瘤的恶性程度及浸润程度正相关[12-13,16]。这提示可以通过MRS识别胶质瘤及周边区域的代谢变化,对胶质瘤在术前进行分级、鉴别诊断及评价疗效等,并依据MRS参数的变化识别胶质瘤的浸润范围,为指导临床最大安全范围切除肿瘤提供参考。本研究中连续选取活检靶点,这样的连续性与胶质瘤向周边浸润的生物学行为相一致。病理结果显示:高级别胶质瘤中均含有2种或2种以上病理级别胶质瘤成分,低级别的成分大多位于肿瘤周边(图1)。这种分布既说明胶质瘤具有异质性,也证实了胶质瘤向周边逐步浸润生长的特点。此外,MRS参数的变化说明胶质瘤不是等距离浸润周边。图1C和D组织同样位于近瘤周,但其Cho/NAA比值不同,受肿瘤浸润的程度也有明显差异。C和E组织的Cho/NAA比值均为2.0,虽然距肿瘤核心区域的距离不等,但病理结果显示两者肿瘤浸润情况基本相似。而图1B相比于F组织虽然远离肿瘤核心区域,但其Cho/NAA比值大于F,病理显示B肿瘤浸润的程度较F更严重。由此可见,胶质瘤病理与MRS参数相一致,这进一步证实了MRS准确性,说明与传统MRI影像相比,MRS可能在判断胶质瘤浸润程度及范围界定上更加精确。
活检标本和体素之间精确配准是本研究的另一个优势。本研究利用自行开发的标记软件Biopsy NAV,在术前将穿刺靶点对应的体素标记在导航序列中,并在开颅手术前进行导航下穿刺获取组织样本,避免了目测误差及脑移位等对穿刺精度的影响。因此获取的MRS参数可以更准确反映活检标本的代谢物改变。
综上所述,本研究结果显示,Cho/NAA、NAA/Cr及Cho/Cr和胶质瘤细胞密度、CD34及MIB-1指数之间存在密切关系,说明MRS可反映胶质瘤的代谢变化,进而为临床提高肿瘤全切除率及制定有效的综合治疗方案提供依据。

