酶法催化甲醛合成木酮糖
崔博,卓炳照,逯晓云,王文,肖冬光,江会锋
酶法催化甲醛合成木酮糖
崔博1,2,卓炳照3,逯晓云2,王文3,肖冬光1,江会锋2
1 天津科技大学 生物工程学院,天津 300457 2 中国科学院天津工业生物技术研究所,天津 300308 3 西北工业大学,陕西 西安 710072

金城. 2018酶工程专刊序言. 生物工程学报, 2018, 34(7): 1021−1023.Jin C. Preface for special issue on enzyme engineering (2018). Chin J Biotech, 2018, 34(7): 1021−1023.
木酮糖是生物体内的代谢中间产物,是多种稀有糖合成的前体物质,因其独特的生物活性在膳食、保健、医药等领域发挥着重要作用。本研究旨在从最基本有机原料之一的甲醛出发,利用生物酶法催化甲醛合成木酮糖。通过来源于恶臭假单胞菌的苯甲酸脱羧酶 (Benzoylformate decarboxylase) 突变体BFD-M3催化甲醛聚合生成羟基乙醛和1,3-二羟基丙酮 (DHA)。通过来源于大肠杆菌的转醛醇酶 (Transaldolase)突变体TalB-F178Y进一步催化羟基乙醛和DHA聚合生成木酮糖,最终实现甲醛到木酮糖的酶法转化,转化率为0.4%。此外,经过优化甲醛底物浓度,木酮糖转化率达到4.6%,比优化前提高了11.5倍。为了进一步提高木酮糖的转化率,采用Scaffold多酶组装技术固定BFD-M3、TalB-F178Y蛋白,使木酮糖转化率达到14.02%,较未用Scaffold技术前提高3倍,为生物法合成稀有糖提供了一种新方案。
木酮糖,甲醛,酶法催化,Scaffold多酶组装技术
木酮糖 (Xylulose) 是一种戊酮糖,在自然界中存在但含量极少,属于稀有糖。木酮糖存在L、D两种构型且在生物体内可以相互转换[1-3],涉及到多种生物学、生理学功能。例如,木酮糖是合成多种稀有糖的前体物质[4-6],是实现稀有糖转化的重要桥梁;在医学上,木酮糖能抑制肠道蔗糖酶和麦芽糖酶活性从而抑制餐后血糖升高,成为降血糖食品的理想活性成分[7];木酮糖还可以与ATP反应生成D-木酮糖-5-磷酸进入磷酸戊糖途径,参与细胞中心代谢途径[8-9]。
目前木酮糖的合成主要通过化学法和生物法转化糖醇来实现。其中化学法合成木酮糖是利用山梨糖醇作为原料,通过多步催化氧化完成。由于化学法生产工艺复杂且副产物多,木酮糖得率低,因而不利于规模化生产[10]。生物法主要通过木酮糖还原酶 (EC 1.1.1.10或EC 1.1.1.9) 转化木糖醇生产L-木酮糖或D-木酮糖[11-13],其具有反应条件温和、生产步骤简单、产品纯度高等特点,但生产成本较大。因此,以廉价的原料通过生物转化法生产木酮糖已成为生物工程重要研究方向之一。
一碳 (C1) 化合物包括无机CO2和CO,有机甲醇、甲醛等,具有来源广泛、价格低廉等特点[14],在工业生物技术中具有广泛的应用前景[15-17]。其中甲醛是其他一碳化合物转化为生物利用的中间物质[18]。华盛顿大学David Baker教授构建了一条以CO2为原料途经甲醛合成羟基乙醛以及1,3-二羟基丙酮 (DHA) 的代谢通路,为以甲醛为原料合成大宗化学品提出了一个良好的开端[19]。同时,笔者实验室也在从事以甲醛为原料形成羟基乙醛的相关课题。自然界中不存在催化甲醛合成羟基乙醛或DHA的酶,实验室通过对来源于恶臭假单胞菌的苯甲酸脱羧酶 (Benzoylformate decarboxylase,BFD) 进行定点饱和突变,最终筛选获得了一个可以高效聚合甲醛分子产生羟基乙醛和DHA化合物的突变体BFD-W86R-N87T-L109G-L110E-A460M (BFD- M3)[20]。此外,相关研究显示来源于大肠杆菌的转酮酶 (Transaldolase,TalB) 突变体TalB-F178Y能够催化非磷酸化底物DHA作为反应供体进行醛缩反应,如催化DHA与甘油醛、羟基乙醛等缩合合成果糖和木酮糖等[21]。
本研究从甲醛出发,设计了一条酶法催化甲醛合成木酮糖的生物途径,利用BFD-M3和TalB-F178Y一锅酶法直接催化甲醛合成木酮糖,并对复合酶反应体系进行优化。以甲醛为原料合成木酮糖,为稀有糖生产技术发展提供了新思路,同时为一碳资源的利用奠定一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
本研究所用菌株及质粒见表1。
1.1.2 实验试剂
酵母粉和胰蛋白胨购自英国Oxoid公司;NaCl、硫酸卡那霉素 (Kanamycin,Kan+)、氨苄青霉素 (Ampicillin,Ampr)、异丙基-β-D-硫代半乳糖苷 (IPTG)、羟基乙醛、DHA购自北京索莱宝科技有限公司;纤维素 (RAC)、D-木酮糖购自上海源叶生物科技有限公司。

表1 本文所用的菌株及质粒
LB培养基:酵母粉5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,用于质粒的构建、扩增、种子液的培养。发酵培养基 (2YT):胰蛋白胨16 g/L,酵母粉10 g/L,NaCl 5 g/L,用于蛋白质的过表达。
蛋白缓冲液A:50 mmol/L K3PO4,5 mmol/L MgSO4,0.5 mmol/L TPP,pH 7.4。
蛋白缓冲液B:50 mmol/L K3PO4,5 mmol/L MgSO4,0.5 mmol/L TPP,1 mol/L咪唑,pH 7.4。
1.2 方法
1.2.1 酶表达纯化
pET28a--M3和pET28a--F178Y质粒为本实验室保存。分别将库存质粒pET28a--M3和pET28a--F178Y转入BL21 (DE3) 感受态细胞,挑取单克隆接种于含 5 mL LB液体培养基的小试管中,37 ℃、220 r/min过夜培养,作为种子液。将种子液按 1% (/) 接种量转入 800 mL 2YT液体培养基中,37 ℃、220 r/min摇床培养至600为0.6–0.8。加入IPTG至终浓度0.5 mmol/L,16 ℃诱导表达16–18 h。5 000 r/min离心10 min后弃上清,30 mL蛋白缓冲液A重悬菌体。
重悬细胞液利用高压低温匀质破碎仪破碎,(1 200 bar,3次)。15 000 r/min、4 ℃离心50 min去除细胞碎片。取上清液采用镍亲和层析方法纯化目的蛋白,不同咪唑浓度洗脱的样品用10% SDS-PAGE检测。将收集到的电泳均一性较好的目的蛋白用15 mL Amicon超滤管 (10 kDa,Millipore公司) 离心浓缩 (4 ℃、3 600 r/min),30 mL蛋白缓冲液A换液确保除去蛋白中的咪唑,得到纯化蛋白。采用Pierce BCA Protein Assay Kit (Thermo Fisher Scientific) 测定蛋白浓度,纯化蛋白于–80 ℃保存备用。
在上述培养和转化过程中,视菌株所带质粒情况添加相应的抗生素。硫酸卡那霉素和氨苄青霉素的工作浓度为 100 μg/mL。
1.2.2 酶催化反应
一锅酶法催化甲醛合成木酮糖。样品 (200 μL):1 mg/mL BFD-M3,1 mg/mL TalB-F178Y,5 g/L甲醛,50 mmol/L K3PO4,5 mmol/L MgSO4,0.5 mmol/L TPP,pH 7.4;对照 (200 μL):5 g/L甲醛,50 mmol/LK3PO4,5 mmol/L MgSO4,0.5 mmol/L TPP,pH 7.4。上述反应于振荡反应器中 300 r/min、37 ℃反应 24 h。
1.2.3 多酶组装技术
该技术[22]的原理是通过人工合成的支架固定催化反应中的酶,缩短酶与酶的空间距离,在底物通道效应的基础上提高了底物与酶的反应效率。Scaffold蛋白支架上带有若干个相邻的受体结合位点,可以与带标签的不同蛋白结合。同时,蛋白支架上还有一个CBM蛋白,可以与RAC结合。与RAC结合后的蛋白经过高速离心,即可快速得到酶复合体,Scaffold多酶组装原理如图1所示。
1.2.4 重组质粒构建
以构建pET28a--M3-ctdoc重组质粒为例。设计对应引物,分别以pET28a--M3、pET20b--ctdoc为模板,PCR扩增获得线性pET28a--M3和ctdoc片段,将PCR产物消化、纯化后采用Gibson连接方法[23]连接,产物转入DH5α感受态细胞,在含有Kan+的LB平板上过夜培养。挑选单克隆,进行菌落PCR验证,验证正确的克隆提取质粒测序,将测序正确的质粒置于–20 ℃冰箱保存备用。
1.2.5 复合酶组装
在BL21 (DE3) 中分别过表达BFD-M3- CtDoc、TalB-F178Y-CcsDoc、CBM-Scaffold蛋白 (方法1.2.1),各取100 mL培养液,5 000 r/min离心10 min收集细胞。分别用10 mL蛋白缓冲液A重悬细胞,细胞悬液等体积混合,利用高压低温匀质破碎仪破碎。细胞破碎液15 000 r/min离心30 min,收集上清液,即获得粗酶液。30 mL粗酶液和50 mg RAC纤维素凝胶混合,室温静置5 min,使其充分结合后离心弃上清,蛋白缓冲液A洗2次后重悬于10 mL蛋白缓冲液A。利用Pierce BCA Protein Assay Kit测定复合酶浓度。
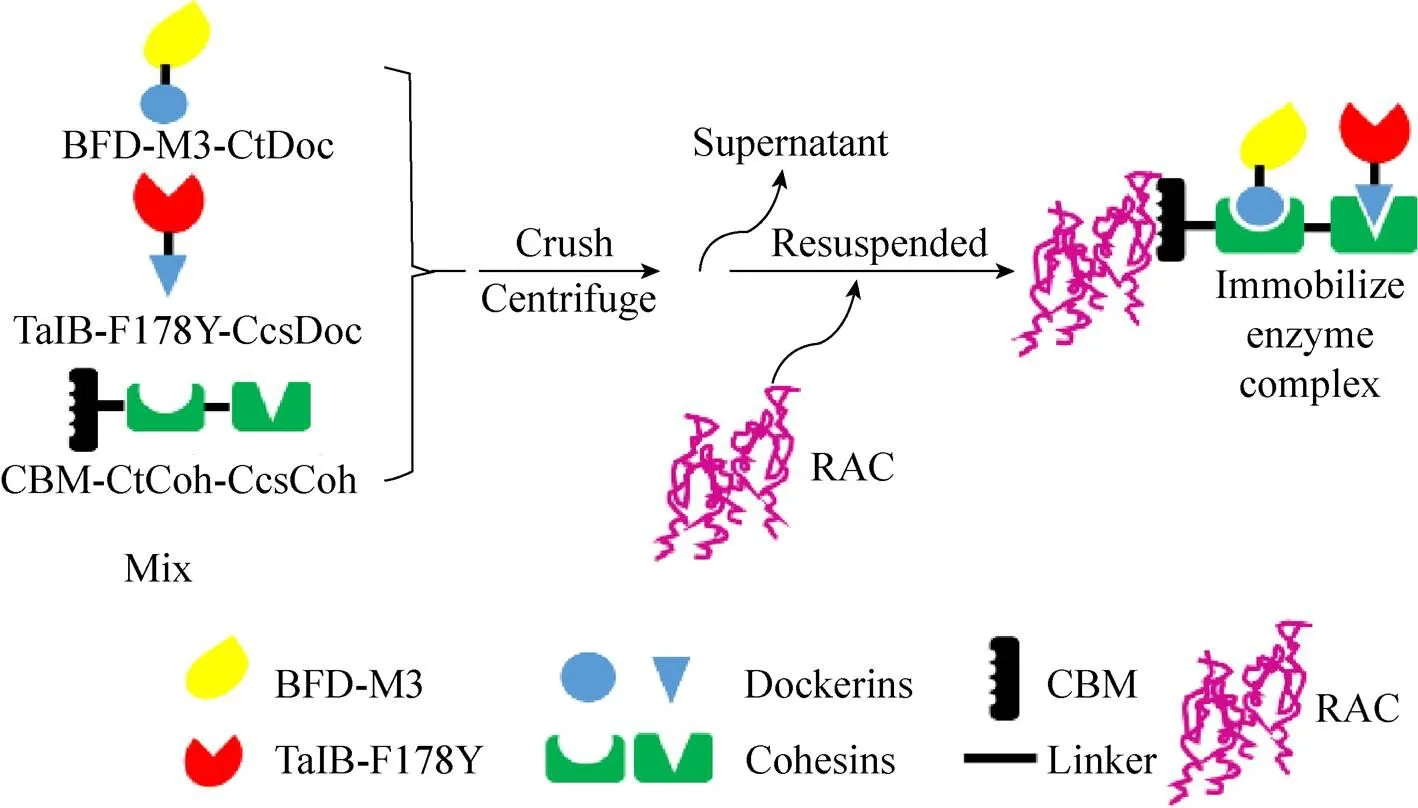
图1 Scaffold多酶组装原理图[22]
1.2.6 酶组装催化反应
酶复合体催化甲醛合成木酮糖。样品 (500 μL):复合酶浓度为2 mg/mL,6–16 g/L梯度甲醛浓度,50 mmol/L K3PO4,5 mmol/L MgSO4,0.5 mmol/L TPP,pH 7.4。反应在振荡反应器进行,300 r/min, 37 ℃反应24 h。
1.2.7 目标产物木酮糖检测
木酮糖检测采用高效液相色谱法 (HPLC)。取200 μL反应液12 000 r/min离心2 min,所得上清液用0.22 μm滤器过滤后,进行HPLC检测。
HPLC检测条件:检测器为Agilent Technologies 1260 RID (Refractive index detector),色谱柱为Bio-Rad Aminex HPX-87H Column (300 mm× 7.8 mm),进样量20 μL,流动相为5 mmol/L H2SO4,柱温35 ℃,流速 0.6 mL/min。
2 结果与分析
2.1 甲醛合成木酮糖催化途径的设计
糖类是含醛基或酮基的多羟基化合物及其衍生物的总称。从简单醛酮类化合物出发合成重要糖类及其衍生物,一直以来受到人们的高度关注。如以羟基乙醛和甲醛为原料合成葡萄糖、木糖和艾杜糖[24];以甲酸为原料途经甲醛合成糖异生的中间产物磷酸二羟丙酮[19];以DHA和甘油醛或羟基乙醛为原料合成果糖、木酮糖[25]等。本研究基于已有研究基础,设计了一条以最简单醛类化合物甲醛为原料合成木酮糖的生物途径。首先BFD-M3聚合2分子甲醛形成1分子羟基乙醛,羟基乙醛继续结合1分子甲醛形成DHA,TalB-F178Y进一步催化羟基乙醛和DHA合成木酮糖 (图2)。为了评价途径的可行性,利用热力学分析工具eQuilibrator (http://equilibrator. weizmann.ac.il/) 对途径中各反应吉布斯自由能变ΔGm进行计算 (表2),ΔGm依次为–27.9、–17.7、15.9 kJ/mol。而最终5分子甲醛生成1分子木酮糖总反应的ΔGm为–57.6 kJ/mol (<0),说明在热力学上该反应路线是可行的。
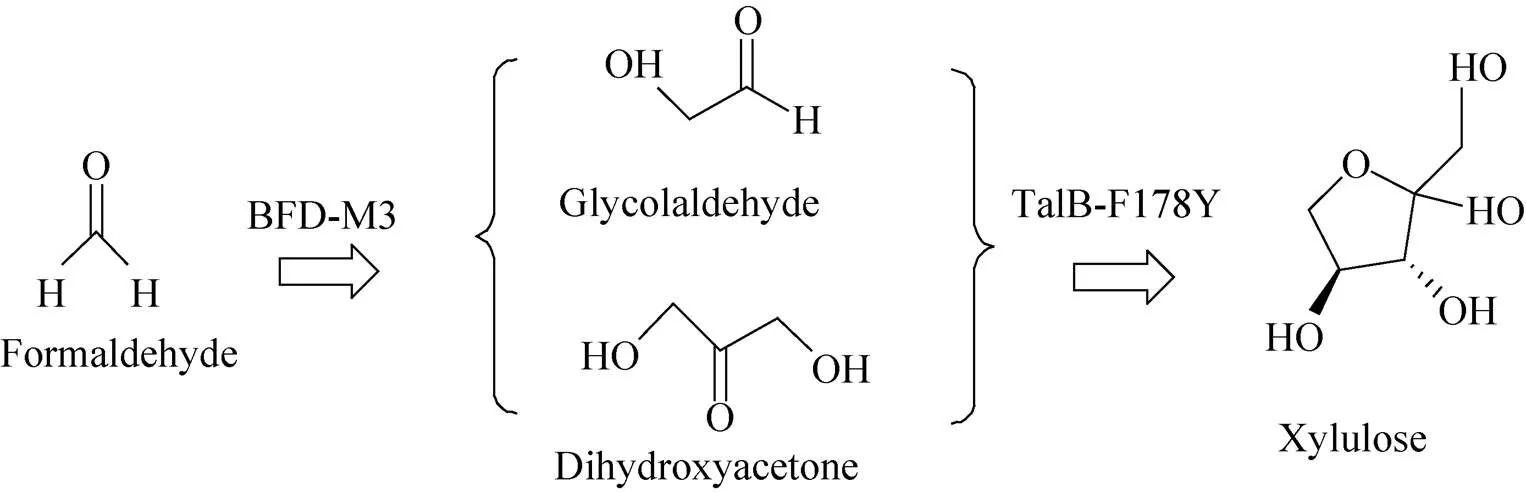
图2 甲醛到木酮糖催化途径示意图

表2 途径各步反应吉布斯自由能变
2.2 甲醛合成木酮糖催化途径的构建
为了能够实现甲醛到木酮糖的途径,首先将本实验室库存质粒pET28a--M3与pET28a--F178Y分别转入BL21 (DE3) 感受态细胞,在大肠杆菌中表达并纯化蛋白 (方法1.2.1)。SDS- PAGE检测结果 (图3) 表明,BFD-M3、TalB-F178Y蛋白的分子量与理论大小一致,且纯度较高,电泳专一性达95%以上,因此可用于催化反应。
其次我们采用一锅酶法实现甲醛直接合成木酮糖的生物途径 (甲醛到木酮糖合成途径涉及的单步催化反应均可实现[20-21])。HPLC结果显示,实验组与对照组相比检测到有新峰出现,且新峰出峰位置与目标产物木酮糖出峰位置一致,表明BFD-M3和TalB-F178Y两酶可以催化甲醛合成木酮糖。虽然可以成功检测到目标产物木酮糖的生成,但是产量并不高。在5 g/L甲醛浓度下,只有20 mg/L木酮糖生成,转化率为0.4%。文献调研发现,已报道的TalB-F178Y催化D,L-甘油醛和DHA生成D-果糖时m>120 mmol/L[21],推测TalB-F178Y对DHA较低的亲和力是限制甲醛合成木酮糖的主要原因。
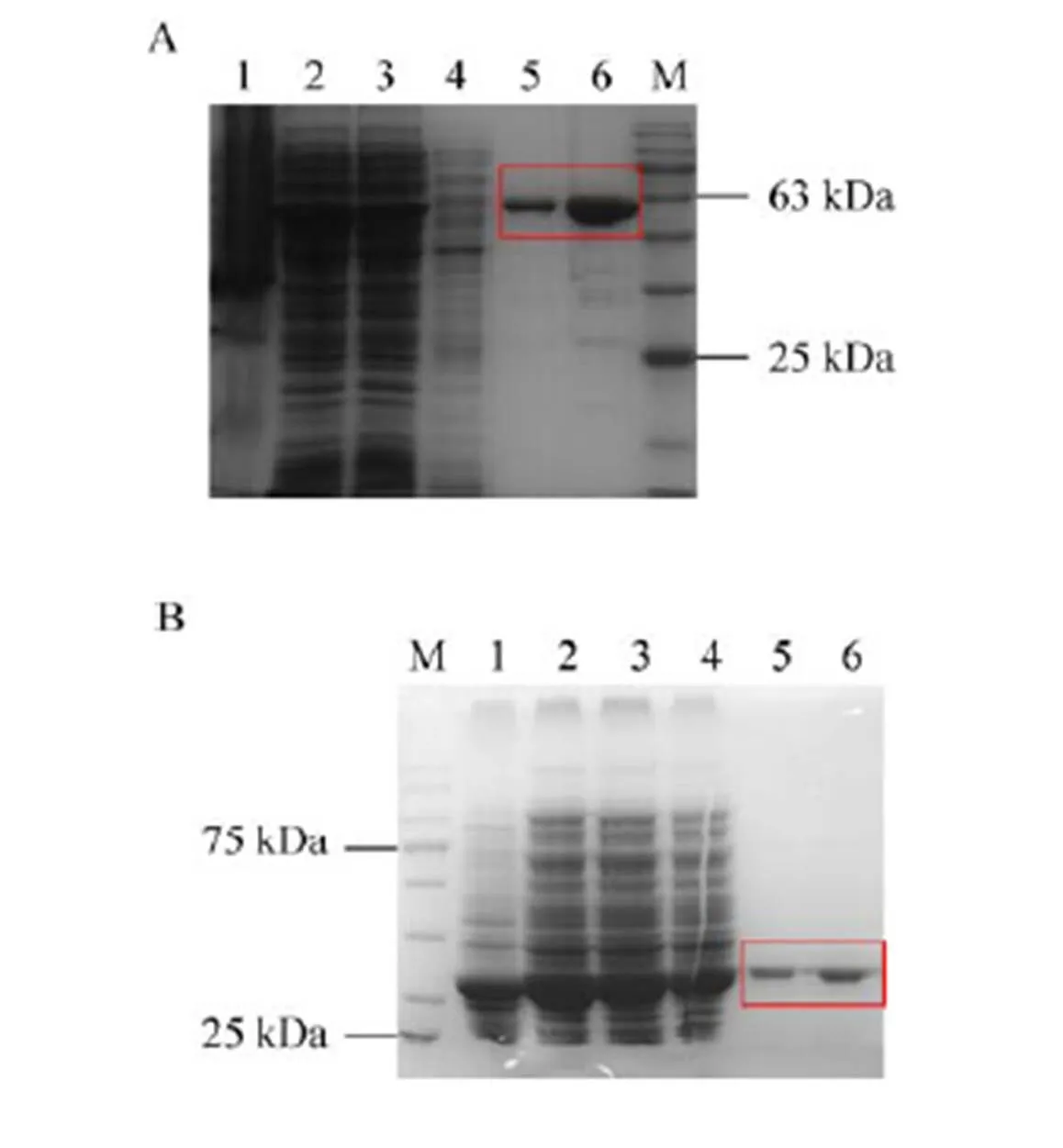
图3 镍亲和层析纯化BFD-M3和TalB-F178Y
2.3 木酮糖合成途径底物浓度的优化
为了检测甲醛底物浓度对反应的影响并提高催化效率,后续的实验中设置了12个甲醛浓度梯度进行测试。HPLC检测结果如图4所示:随着甲醛底物浓度的升高,木酮糖转化率整体呈上升趋势;当甲醛浓度为20 g/L时,木酮糖转化率达到4.6%,比5 g/L甲醛浓度的转化率提高11.5倍。实验结果与预期分析一致,高浓度甲醛在BFD-M3催化下生成浓度较高的羟基乙醛和DHA,从而促进后续反应的进行。但甲醛浓度增加到25 g/L时,转化率有所下降,分析原因可能是更高浓度甲醛抑制途径酶活性,从而影响反应速率。另外,由于甲醛对酶的毒性,催化反应选择20 g/L以内甲醛底物浓度较为合适。
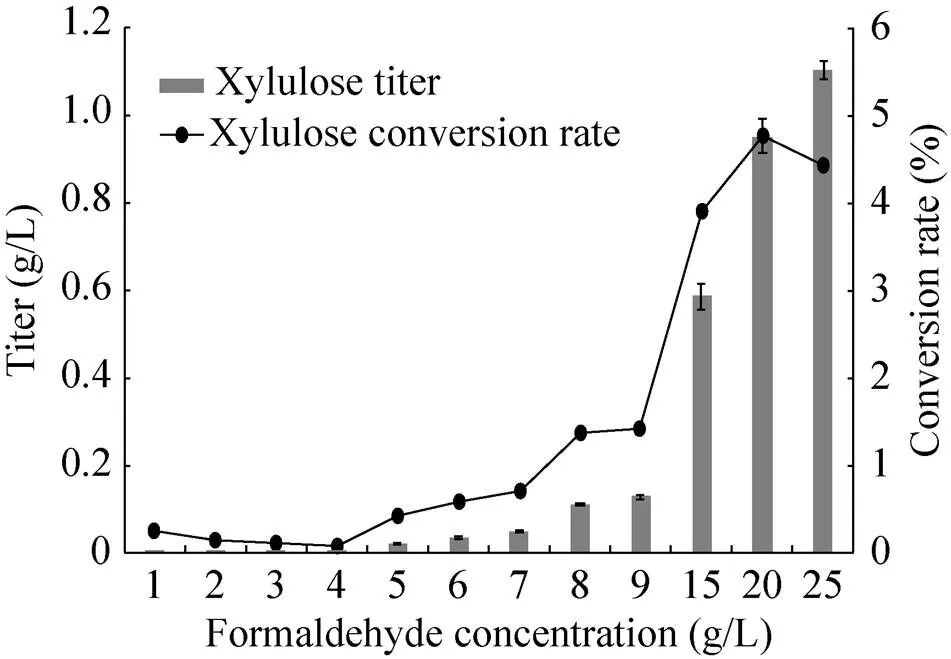
图4 一锅酶法在不同的甲醛浓度下合成木酮糖
2.4 结合多酶组装技术合成木酮糖
为进一步提高木酮糖的产量,本研究结合Scaffold多酶组装技术,利用Scaffold蛋白支架固定BFD-M3、TalB-F178Y蛋白,得到反应复合酶体系。Scaffold多酶组装技术的使用,理论上可以提高复合酶体系催化中心局部羟基乙醛和DHA浓度,进而提高木酮糖转化率。首先,分别在BFD-M3、TalB-F178Y蛋白C端添加Scaffold配体,所构建重组质粒pET28a--M3-ctdoc、pET28a--F178Y-ccsdoc、pET20b--见图5,然后利用复合酶组装技术获得复合酶反应液 (方法1.2.5)。利用等同浓度的复合酶催化6–16 g/L梯度浓度的甲醛,进行HPLC检测,结果如图6所示。随着甲醛浓度的升高,木酮糖产量逐渐提高;当甲醛浓度为16 g/L时,木酮糖产量达到2.20 g/L,木酮糖转化率为13.75%;当甲醛浓度为14 g/L时,甲醛到木酮糖的产量为1.96 g/L,低于16 g/L甲醛浓度的产量,但此时转化率却达到最高,是未固定化前最高转化率的3倍,达到14.02%。酶的特性是影响途径反应速率的核心因素,本研究通过将酶组装固定间接提高催化中心局部底物浓度的策略,使得反应效率明显提高。因此要获得更高的木酮糖产量,需进一步对关键酶进行改造,提高对底物亲和性。
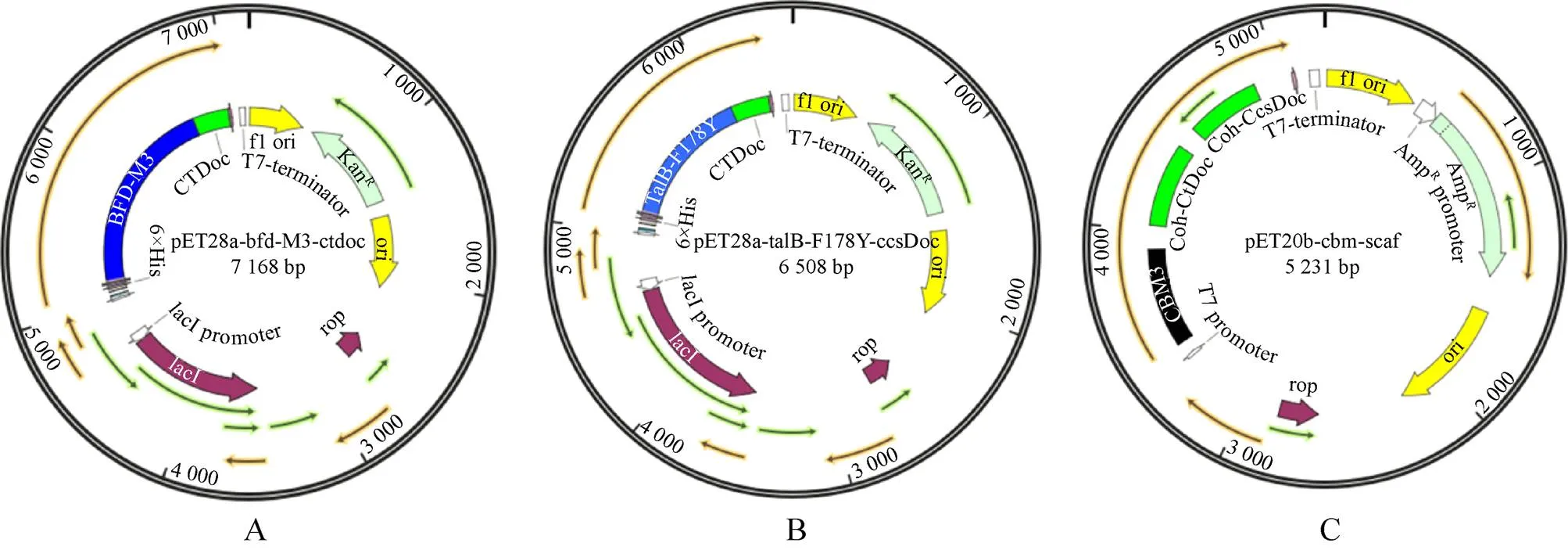
图5 重组质粒图谱(Scaffold配体)
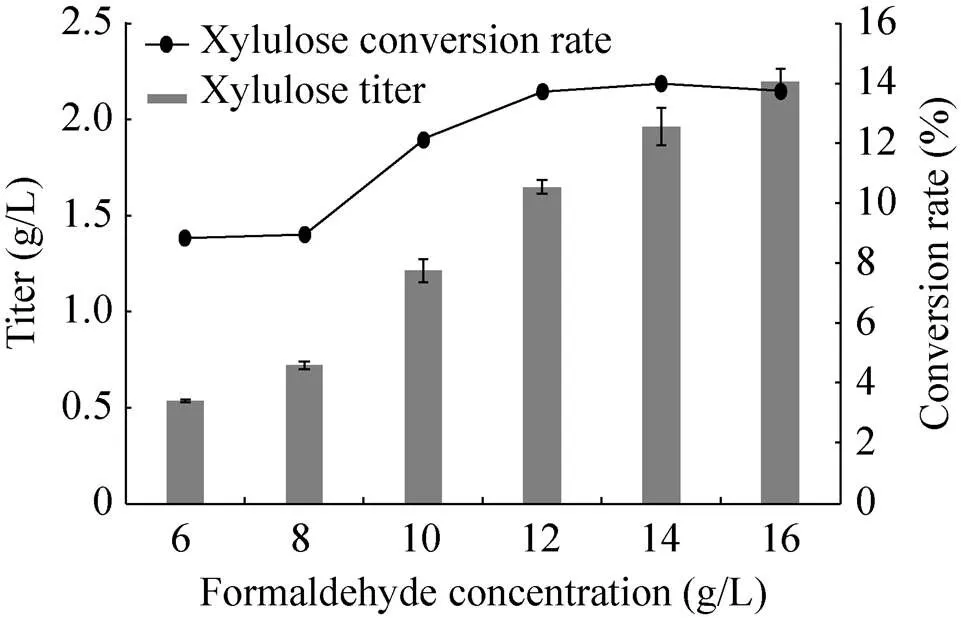
图6 多酶组装技术在不同的甲醛浓度下合成木酮糖
3 结论
一碳化合物作为很有应用前景的绿色能源物质,从一碳化合物出发合成多碳有机分子得到越来越多的关注。甲醛作为最基本有机原料之一,来源广泛且容易获得。木酮糖是生物体中间代谢产物,其独特的生物活性在不同领域发挥着重要作用。鉴于此,以甲醛为底物设计一条新的甲醛-木酮糖生物合成途径具有重要的意义。本研究设计的甲醛到木酮糖的新途径通过两酶催化底物实现:首先BFD-M3催化甲醛生成羟基乙醛和DHA,TalB-F178Y再将羟基乙醛和DHA聚合形成木酮糖。通过在大肠杆菌中过表达BFD-M3和TalB-F178Y两个蛋白,采用一锅酶法催化甲醛生成木酮糖,但转化率只有0.4%左右。经过对甲醛底物浓度进行优化,木酮糖转化率提高了11.5倍,达到4.6%。为进一步提高木酮糖转化率,采用Scaffold多酶组装技术将两个蛋白BFD-M3、TalB-F178Y组装固定后进行催化反应。当甲醛浓度为14 g/L时,木酮糖转化率达14.02%,较固定化之前最高转化率提高3倍。前期研究表明TalB-F178Y与底物DHA亲和力很低 (约120 mmol/L)[21],可能是限制木酮糖转化的主要原因之一。为了进一步提高木酮糖转化率,在后续的研究中,可以通过酶定向进化的方法,提高酶对底物亲和性。
本研究中的合成木酮糖新途径,较已有的合成方法更加简单、方便,节约成本和时间,为其他稀有糖的合成提供新思路。途径设计以甲醛为底物,为一碳资源的利用和新途径的设计奠定一定的理论基础,同时也为生物制造原料来源提供一种新的可能,为解决生物化工与煤化工 (甲醛生产) 产业衔接问题提供新思路,对于突破现有生物技术发展瓶颈具有重要意义。
[1] Metz B, Mojzita D, Herold S, et al. A novel L-xylulose reductase essential for L-arabinose catabolism in. Biochemistry, 2013, 52(14): 2453–2460.
[2] Carius Y, Christian H, Faust A, et al. Structural insight into substrate differentiation of the sugar-metabolizing enzyme galactitol dehydro-genase fromD. J Biol Chem, 2010, 285(26): 20006–20014.
[3] Cheng HR, Li ZL, Jiang N, et al. Clonig, purification and characterization of an NAD-dependent D-arabitol dehydrogenase from acetic acid bancterium,Protein J, 2009, 28(6): 263–272.
[4] Granström TB, Takata G, Morimoto K, et al. L-xylose and L-lyxose production from xylitol using701B strain and immobilized L-rhamnose isomerase enzyme. Enzyme Microb Technol, 2005, 36(7): 976–981.
[5] Park CS, Yeom SJ, Lim YR, et al. Substrate specificity of a recombinant ribose-5-phosphate isomerase fromand its application in the production of L-lyxose and L-tagatose. World J Microbiol Biotechnol, 2011, 27(4): 743–750.
[6] Granström TB, Takata G, Tokuda M, et al. Izumoring: a novel and complete strategy for bioproduction of rare sugars. J Biosci Bioeng, 2004, 97(2): 89–94.
[7] Meng Q, Zhang T, Jiang B, et al. Advances in applications, metabolism, and biotechnological production of L-xylulose. Appl Microbiol Biotechnol, 2016, 100(2): 535–540.
[8] McCormick DB, Touster O. The conversionof xylitol to glycogen via the pentose phosphate pathway. J Biol Chem, 1957, 229(1): 451–461.
[9] Anderson RL, Wood WA. Pathway of L-xylose and L-lyxose degradation in. J Biol Chem, 1962, 237: 296–303.
[10] Larson HW, Blatherwick NR, Bradshaw PJ, et al. The metabolism of L-xylulose. J Biol Chem, 1941, 138: 353–360.
[11] St-cyr A, Légaré C, Frenette GC, et al. P26h and dicarbonyl/L-xylulose reductase are two distinct proteins present in the hamster epididymis. Mol Reprod Dev, 2004, 69(2): 137–145.
[12] El-Kabbani O, Ishikura S, Darmanin C, et al. Crystal structure of human L-xylulose reductase holoenzyme: probing the role of Asn107 with site-directed mutagenesis. Proteins: Struct Funct Bioinf, 2004, 55(3): 724–732.
[13] Weyda I, Lübeck M, Ahring BK, et al. Point mutation of the xylose reductase (XR) gene reduces xylitol accumulation and increases citric acid production inJ Ind Microbiol Biot, 2014, 41(4): 733–739.
[14] Liu CJ, Xu GH. C1 chemical products and trend of development. Chin J Chem Eng, 2003, 54(4): 524–530 (in Chinese). 刘昌俊, 许根慧. 一碳化工产品及其发展方向. 化工学报, 2003, 54(4): 524–530.
[15] Whitaker WB, Jones JA, Bennett RK, et al. Engineering the biological conversion of methanol to specialty chemicals in. Metab Eng, 2017, 39: 49–59.
[16] Müller JEN, Meyer F, Litsanov B, et al. Engineeringfor methanol conversion. Metab Engineering, 2015, 28: 190–201.
[17] Antonovsky N, Gleizer S, Noor E, et al. Sugar synthesis from CO2inCell, 2016, 166(1): 115–125.
[18] Liao JC, Mi L, Pontrelli S, et al. Fuelling the future: microbial engineering for the production of sustainable biofuels. Nat Rev Microbiol, 2016, 14(5): 288–304.
[19] Siegel JB, Smith AL, Poust S, et al. Computational protein design enables a novel one-carbon assimilation pathway. Proc Natl Acad Sci USA, 2015, 112(12): 3704–3709.
[20] Jiang HF, Liu YW, Lu XY, et al. Catalytic formaldehyde synthesis of glycolaldehyde and its application: China, 106916794, 2017-02-22 (in Chinese). 江会锋, 刘玉万, 逯晓云, 等. 催化甲醛合成羟基乙醛的酶及其应用: 中国, 106916794, 2017-02-22.
[21] Schneider S, Gutiérrez M, Sandalova T, et al. Redesigning the active site of transaldolase TalB from: new variants with improved affinity towards nonphosphorylated substrates. ChemBioChem, 2010, 11(5): 681–690.
[22] You C, Zhang YHP. Self-assembly of synthetic metabolons through synthetic protein scaffolds: one-step purification, co-immobilization, and substrate channeling. ACS Synth Biol, 2012, 2(2): 102–110.
[23] Gibson DG, Benders GA, Andrews-Pfannkoch C, et al. Complete chemical synthesis, assembly, and cloning of a Mycoplasma genitalium genome. Science, 2008, 319(5867): 1215–1220.
[24] Szekrenyi A, Garrabou X, Parella T, et al. Asymmetric assembly of aldose carbohydrates from formaldehyde and glycolaldehyde by tandem biocatalytic aldol reactions. Nat Chem, 2015, 7(9): 724–729.
[25] Schneider S, Sandalova T, Schneider G, et al. Replacement of a phenylalanine by a tyrosine in the active site confers fructose-6-phosphate aldolase activity to the transaldolase ofand human origin. J Biol Chem, 2008, 283(44): 30064–30072.
(本文责编 郝丽芳)
Enzymatic synthesis of xylulose from formaldehyde
Bo Cui1,2, Bingzhao Zhuo3, Xiaoyun Lu2,Wen Wang3, Dongguang Xiao1, and Huifeng Jiang2
1 College of Biotechnology, Tianjin University of Science & Technology, Tianjin 300457, China 2 Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China 3 Northwestern Polytechnic University, Xi′an 710072, Shaanxi, China
Xylulose as a metabolic intermediate is the precursor of rare sugars, and its unique pattern of biological activity plays an important role in the fields of food, health, medicine and so on. The aim of this study was to design a new pathway for xylulose synthesis from formaldehyde, which is one of the most simple and basic organic substrate. The pathway was comprised of 3 steps: (1) formaldehyde was converted to glycolaldehyde by benzoylformate decarboxylase mutant BFD-M3 (from); (2) formaldehyde and glycolaldehyde were converted to dihydroxyacetone by BFD-M3 as well; (3) glycolaldehyde and dihydroxyacetone were converted to xylulose by transaldolase mutant TalB-F178Y (from). By adding formaldehyde (5 g/L), BFD-M3 and TalB-F178Y in one pot, xylulose was produced at a conversion rate of 0.4%. Through optimizing the concentration of formaldehyde, the conversion rate of xylulose was increased to 4.6% (20 g/L formaldehyde), which is 11.5 folds higher than the initial value. In order to further improve the xylulose conversion rate, we employed Scaffold Self-Assembly technique to co-immobilize BFD-M3 and TalB-F178Y. Finally, the xylulose conversion rate reached 14.02%. This study provides a new scheme for the biosynthesis of rare sugars.
xylulose, formaldehyde, enzymatic catalysis, Scaffold Self-Assembly technique
November 25, 2017;
January 12, 2018
National Natural Science Foundation of China (No. 31670100), the Hundred Talents Program of the Chinese Academy of Sciences.
Huifeng Jiang. Tel/Fax: +86-22-24828732; E-mail: jiang_hf@tib.cas.cn
10.13345/j.cjb.170466
国家自然科学基金 (No. 31670100),中国科学院百人计划资助。

