复凝聚法制备药物微胶囊及细胞毒性评价
方 芳, 周 峻, 汤谷平
(浙江大学 化学实验教学中心,杭州 310058)
0 引 言
如何延长药物的释药时间和药效持续时间成为制药应用研究的关键问题[1]。而微胶囊化可以改善被包埋物质的物理性质,提高其稳定性,具有控制药物释放速度、保护芯材活性成分免受环境影响[2],改善被包埋物质的反应活性、耐久性、压敏性、热敏性和光敏性,屏蔽气味、降低物质毒性等[3]。微胶囊是指用高分子材料把分散的固态、液态或气态物质包埋成微小封闭容器,微胶囊的粒径通常在2~1 000 μm[4-5],其外形一般呈球形[6]。

本文以卡培他滨为芯材,明胶、阿拉伯胶为壁材,采用复凝聚法制备微胶囊,通过研究各工艺参数对微胶囊制备的影响,确定最佳制备条件,并通过四氮唑蓝比色实验(MTT法)比较药物和微胶囊的细胞毒性。
1 实验部分
1.1 试剂与仪器
试剂:明胶,阿拉伯胶,甲醛,醋酸,氢氧化钠,卡培他滨,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(简称MTT,5 mg/mL),二甲基亚砜(DMSO),以上试剂均为分析纯;DMEN培养液,新生小牛血清,以上试剂为生物试剂,用于细胞培养,所有试剂均为上海阿拉丁生化科技股份有限公司购置的。
仪器:ECLIPSE Ti倒置荧光显微镜(日本Nikon),UH5300紫外分光光度计(日本HITACHI),Mastersizer 2000粒径分布仪(英国Malvern),BCTB S25 BASIC磁力搅拌器(德国IKA),MIKRO22R高速离心机(德国Hetich),371型二氧化碳培养箱(美国Thermo),BIO-RAD 680酶标仪(美国Thermo,配570 nm滤光片),MS3微量振荡器(德国IKA),JB-CJ-2FXS超净工作台(苏州佳宝)。
1.2 微胶囊的制备
取一定量的阿拉伯胶水溶液(5%,重量体积比)和一定量的药物,置于恒定的水浴中,磁力搅拌1 h后加入一定量的明胶溶液(5%,重量体积比),继续搅拌1.5 h。用醋酸调pH至4.2左右,继续搅拌1.5 h。搅拌结束后,将上述溶液置于冰浴中,边搅拌边缓慢加入1 mL甲醛溶液,进行微胶囊的固化,滴加结束后继续常温搅拌1.5 h。离心分离后,沉淀即微胶囊,用蒸馏水分散后用倒置荧光显微镜观察。
1.3 微胶囊形态学鉴定
取成囊后的溶液滴于载玻片上,盖上盖玻片后在倒置荧光显微镜下观察其外部形貌。
1.4 微胶囊包封率的测定
(1) 测定波长的选择。取卡培他滨标准液,以蒸馏水作参比,用紫外分光光度计对其进行波长扫描,最终定为304 nm。
(2) 标准曲线方程的制定。准确称取卡培他滨10 mg,用蒸馏水定溶至100 mL,配成0.1 mg/mL的溶液。移取0.1 mg/mL卡培他滨溶液10 mL,定容至100 mL,作为配置标准曲线的标准液。分别移取上述溶液1.0,2.0,4.0,6.0,8.0 mL定容至50mL,以蒸馏水为参比,用紫外分光光度计测定其在304 nm处的吸光度,作标准曲线,得回归方程。
(3) 包封率的测定。将离心分离后的上清液用紫外分光光度法进行测量,确定未被包埋的卡培他滨的药量,

1.5 微胶囊粒径分布的测定
在不同的搅拌速度下制得的药物胶囊,用粒径分布仪对胶囊的粒径分布进行测量。使用去离子水将微胶囊制成悬浮液在激光粒度仪上进行测试。
1.6 细胞毒性实验
将C6细胞接种于96孔板内,每孔1×104个细胞,在37 ℃,5% CO2培养箱中孵育16 h。
配制不同浓度的含有卡培他滨母液和无血清培养液的混合溶液,总体积均700 μL,浓度梯度为12.5、25、50、100、125 μg/mL。将混合溶液加入到培养板的孔中(加之前吸去原有培养液),每孔液体的总体积在200 μL(注意每种浓度都为三复孔,另外需要0%MTT溶液三复孔)。孵育4 h后,吸去溶液,每孔加入90 μL无血清培养液和10 μL的5 mg/mL MTT溶液,37 ℃孵育2~3 h。翻板法弃去液体,每孔加入100 μLDMSO,在震荡器上震荡10 min。在酶标仪上用570 nm波长测吸光度(OD)值。细胞活力的计算式:
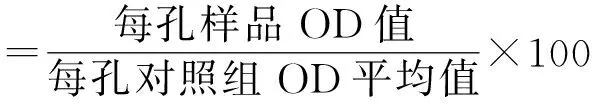
向离心后的微球加入1 mL去离子水混合均匀制成微球制剂,然后分别制成12.5、25、50、100、125 μg/mL溶液。加无血清培养液制成总体积为700 μL的制剂溶液,按上述方法进行MTT实验。
2 结果与讨论
2.1 芯壁比的确定
芯材与壁材的比例(芯壁比)能够显著影响所形成微胶囊的粒径大小和形态特征[14]。图1是不同芯壁比时制备的卡培他滨微胶囊的倒置荧光显微镜外部形貌。

(a) 芯壁比=1.0∶1.0

(b) 芯壁比=1.00∶1.25

(c) 芯壁比=1.0∶1.5
从图1可以看出,随着芯壁比的减少,微胶囊平均粒径逐渐增大。这是由于在微胶囊形成的过程中,提高壁材(阿拉伯胶和明胶)用量可以增加囊壁的厚度,导致粒径增大,同时有利于改善微胶囊对芯材的保护性和缓释性,为此确定的最佳芯壁比微1.0∶1.5。
2.2 pH值
复凝聚的pH值对微胶囊的形成有着重要的影响,本研究通过改变pH值观察微胶囊形成的现象,讨论pH值对微胶囊制备的影响。pH值为4.0时,固化后有少量微胶囊形成,离心后分层不明显;pH值为4.2时,固化后静置,有较多微胶囊形成,离心后分层明显;pH值为4.5时,固化后溶液透明,离心后不分层,基本无微胶囊形成,具体对比见图2,由此确定最佳pH值为4.2。

pH 4.0pH 4.2pH 4.5
图2 不同pH值条件下制得的微胶囊形态对比
2.3 温 度
在保持其他条件不变的情况下,研究温度对微胶囊制备的影响,具体结果见图3。由于低温下明胶和阿拉伯胶的混合溶液黏度较大,成膜的反应可能不够充分,不利于复凝聚的发生,而随着复凝聚温度的提高,明胶和阿拉伯胶的混合黏度降低,有助于提高带电荷电解质的流动性,两者之间的复凝聚反应会更充分。但温度过高,明胶蛋白质易于水解,并且产物的分子运

图3 复凝聚温度与包封率的关系
动加快,使得明胶和阿拉伯胶不能聚集在药物表面形成囊体,导致芯材包封率过低。由此可得,合理的复凝聚温度为55 ℃。
2.4 搅拌速度
在不同的搅拌速度下,制备的微胶囊粒径用粒径分布仪进行测量,结果见图4。从图中可知,当搅拌速率为800 r/min时,微胶囊的粒径d0.5为14.38 μm;搅拌速率为1 200 r/min时,微胶囊的粒径d0.5为7.38 μm;搅拌速率为1 600 r/min时,微胶囊的粒径d0.5为2.45 μm。由此可见,随着搅拌速率的增加,微胶囊的粒径随之变小。

图4 不同搅拌速率下微胶囊的粒径分布图
2.5 细胞毒性实验
图5是MTT实验结果,由实验结果可知,在与细胞作用相同时间下,药物对细胞的毒性更大,说明微胶囊对细胞具有缓释的潜能。因为微胶囊通过囊壁对囊芯物进行包裹,既可以实现有效成分的保护及缓慢释放[15],降低了药物的毒性。
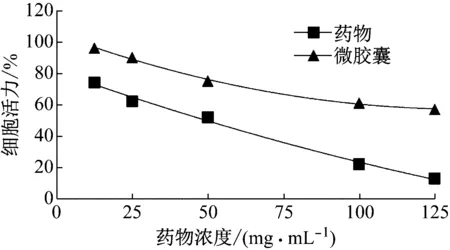
图5 药物浓度与细胞存活率关系图
3 结 语
实验采用复凝聚法制备微胶囊,以卡培他滨为芯材,明胶、阿拉伯胶为壁材,通过对不同工艺条件的研究,得出其最佳制备条件为:芯壁比1.0∶1.5,复凝聚温度为55 ℃,pH 4.2,搅拌速率为1 600 r/min。通过对比药物和微胶囊的细胞毒性实验可知,微胶囊化对药物具有缓释作用,可以提高药物的药效。该实验设备简单,操作容易,具有一定的创新性和实用性,易于锻炼学生的科研能力。

