乳腺恶性孤立性纤维性肿瘤两例
王常珺,姚 儒,师 杰,张晓辉,孙 强
中国医学科学院 北京协和医学院 北京协和医院 1乳腺外科 2病理科,北京 100730
第一、二作者对本文同等贡献(王常珺收集临床病例资料、文献复习,姚儒患者随访、文章撰写)
1 临床资料
1.1 病例1
患者女性,51岁,因“右乳肌纤维母细胞瘤术后3年,再发右乳肿物1月余”收住北京协和医院乳腺外科。
患者于2013年8月因右乳肿物于外院行右乳肿物切除术,术后病理诊断“右乳肌纤维母细胞瘤”,规律复查。2016年1月自觉原手术瘢痕下方可及肿物,直径约5 cm,质韧,边界欠清,活动度尚可,无乳腺疼痛及乳头溢液等症状;2周后,自觉肿物显著增大,直径达10 cm,遂至北京协和医院就诊。
乳腺超声检查示右乳4个象限见巨大低回声:边缘分别位于2点距乳头约3 cm、12点距乳头约5.5 cm、9点距乳头约11 cm、6点距乳头约3.6 cm、5点距乳头约1.2 cm处,前后径约4 cm,边界清蜥,内部回声不均;彩色多普勒血流显像示周边及内部有数条血流信号;双侧腋下未见明确肿大淋巴结。右乳巨大实性占位,结合病史初步考虑乳腺间质细胞来源肿瘤。乳腺钼靶检查:右乳见一巨大稍低密度肿块,大小约5.9 cm×9.5 cm,边界清晰;双腋下未见明显肿大淋巴结;考虑右乳巨大占位,间叶肿瘤复发;乳腺影像报告和数据系统4类。
患者于2016年3月行右乳肿物局部扩大切除术,术中切除肿瘤组织及肿瘤周围部分正常组织,术中未处理腋窝淋巴结,手术过程顺利,术后恢复良好。术后乳腺肿物病理免疫组化结果:AE1/AE3(-), Bcl- 2(-),CD117(-),CD34(+),Caldesmon(-),Calponin(+),Desmin(-),ER(-),Ki- 67(index 10%),MyoD1(-), PR(-), S- 100(-), Vimentin(+), beta-catenin(胞浆+),CD31(血管+),D2- 40(+),F8-R(+);结合形态学表现,肿物免疫组化上皮标志物(-)、CD34染色(+),且具有较多核分裂,病理诊断为右乳恶性梭形细胞肿瘤(图1),考虑为恶性孤立性纤维性肿瘤(solitary fibrous tumor, SFT)(核分裂20/10HPF);术后未行辅助治疗,随访至今肿瘤无复发表现。
1.2 病例2
患者男性,63岁,因“右乳肿物2年”于2013年2月收住北京协和医院乳腺外科。
患者于2011年自行触诊发现右乳肿物,直径约10 cm,无乳头溢液、乳腺疼痛等不适。乳腺超声检查示右侧乳腺外下象限可见低回声,大小约9.3 cm×7.2 cm×3.5 cm,呈分叶状,边界尚清晰, 彩色多普勒血流显像示局部可见较丰富血流;该结节外侧胸壁突起处可见混合回声,无明确边界,范围约6.3 cm×5.1 cm×2.6 cm,可见少许血流,左侧未见明确腺体结构;双侧腋下未见明显异常肿大淋巴结,考虑右乳实性结节,乳腺影像报告和数据系统4类,右胸壁混合回声包块。
于局麻下行右乳肿物切除术,术中切除肿瘤组织及周围部分正常组织,未处理腋窝淋巴结,手术过程顺利。免疫组化结果:Actin(-), CD31(+), CD34(+), CD68(+), HMB45(-), S- 100(-), SMA(-), Vimentin(+), Ki- 67(index约7%);结合免疫组化结果,病理诊断(右胸壁)SFT(低度恶性,核分裂2/10HPF,可见多形性肿瘤细胞),术后未予辅助放化疗。
2013年8月,患者再次出现右胸壁肿物,未予诊治,其后肿物逐渐增大,伴胸壁皮肤红肿,于2015年9月在外院行右乳肿物局部扩大切除术;2016年6月,患者再次出现局部复发,多发肿物,于外院行右乳腺及胸壁肿物扩大切除(包括部分胸肌及肋骨组织)。目前尚无远处转移证据。
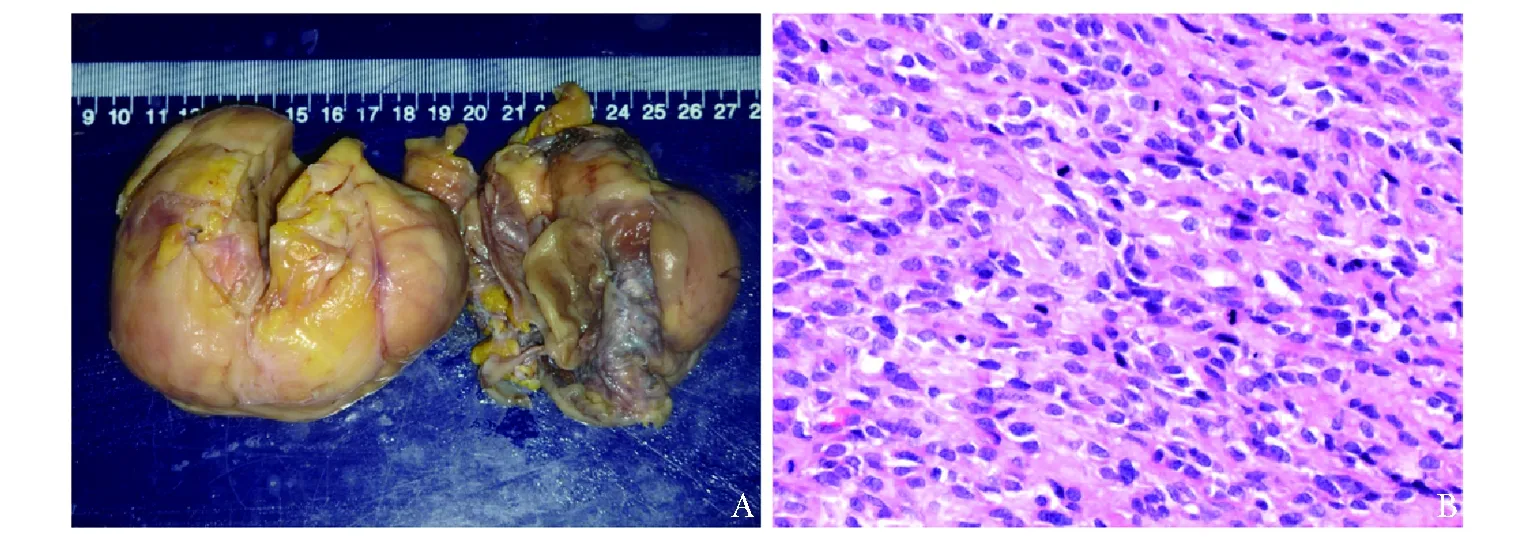
图1乳腺恶性孤立性纤维性肿瘤大体标本(A)及组织切片 (B)(HE,×400)
2 讨论
SFT是一类少见的特殊类型梭形细胞肿瘤,其发生率在各类软组织肿瘤中小于2%[1]。SFT多发于成人,高发年龄约为60岁,其发病部位以胸腔为主,其次为腹腔,中枢神经系统及其他软组织亦有报道。目前报道的乳腺原发SFT不超过10例,乳腺恶性SFT仅有1例[2]。SFT多数表现为无痛性肿物,可呈分叶状,以膨胀性生长为主。其临床表现与乳腺叶状肿瘤、纤维腺瘤及乳腺癌相似。病例2中,患者近期出现肿物显著性增大,提示病变为恶性可能,这一临床表现与继往报道的1例乳腺恶性SFT类似[2]。SFT病理多表现为大量梭形细胞,诊断需与其他类型乳腺间叶来源肿瘤,如肌纤维母细胞瘤等相鉴别。
确诊SFT需依靠病理学检查,免疫组化是与间皮瘤及其他肉瘤鉴别的重要手段,与乳腺叶状肿瘤相类似,SFT往往不具备特征性影像学表现[3]。建议行肿瘤活检以获取病理,细针穿刺活检仅能获得细胞学证据,不能明确诊断;粗针穿刺可明确诊断,但因组织量有限,可能难以准确判断SFT良恶性。SFT常见免疫组化特征为CD34,Bcl- 2及CD99多呈阳性,Actin、S- 100及上皮标记物(如上皮组织膜抗原,小分子角质蛋白)等多为阴性[4]。恶性SFT的诊断应至少满足以下标准之一:(1)核分裂相大于4个/10HPF;(2)有出血或坏死;(3)肿瘤体积大于10 cm;(4)细胞数目增多(缺乏间质胶原,细胞核增多及细胞拥挤);(5)细胞核呈多形性;(6)肿瘤组织突破假包膜形成间质浸润或侵犯血管[5]。本研究2例患者均符合SFT免疫组化特征,病例1因细胞具有多形性,病例2具有较高核分裂相(20/10HPF),符合恶性SFT诊断标准。与其他软组织肉瘤相比,SFT中约30%基因表达有差异,DNA拷贝数变异较为少见;其中表皮生长因子受体、人表皮生长因子受体- 2、成纤维细胞生长因子受体1及JAK2等肿瘤相关激酶均有高表达,且与SFT原发部位无关;此外,SFT中可检测到干细胞标志ALDH1基因高表达。
针对各类型SFT,手术完整切除是所有SFT治疗的主要手段[6]。鉴于目前乳腺恶性SFT相关报道较少,参考非胸腔来源SFT相关研究,手术完整切除为SFT治疗首选,如出现局部肿瘤复发可考虑再次行手术切除。乳腺病灶处理可选择局部扩大切除或乳腺全切术;鉴于恶性间叶组织来源肿瘤以血行播散为主要转移方式,淋巴转移较为少见,多项研究均未行区域淋巴结清扫。对于非胸腔来源SFT,目前尚无研究证实辅助放疗及化疗可使患者获益;对于不能彻底切除的病变可考虑予辅助放化疗。
约半数恶性SFT患者可通过手术彻底切除治愈。部分SFT含有未分化成分,可转化成未分化型肉瘤,并出现全身广泛转移。肿瘤大小、组织学分级、切缘阳性与否及病变部位为非胸腔来源肿瘤均为SFT复发的危险因素。鉴于文献报道部分患者可在发病后16个月出现肿瘤复发,术后需进行规律随访监测。