钝挫伤及力竭运动对大鼠骨骼肌卫星细胞激活及Pax7/CBF1/DAPT含量的影响
潘同斌 叶雷雷 马兵 李娜 仝昕炜 汪亚如
1扬州大学体育学院(扬州 225009)
2南京体育学院训练处(南京 210014)
骨骼肌卫星细胞是肌肉组织的前体细胞,位于肌纤维的肌膜与基底膜之间,它在骨骼肌的生长、发育、损伤及修复过程中起着重要的作用[1]。Notch信号系统在维持骨骼肌的形态和调节肌卫星细胞的细胞周期等方面有决定性作用[2],它可以通过调节肌卫星细胞增殖和分化从而促进受损骨骼肌的生长和修复。Pax(paired-box)转录因子Pax7是一种常用的卫星细胞的分子标记[3],Pax7的表达量能很好地反映出卫星细胞的数量,且Pax7调控着肌卫星细胞的分化,在大鼠骨骼肌损伤愈合期间的卫星细胞监测中,Pax7、MyoD呈时间依赖性表达。
转 录 因 子 CBF1(C-promoter binding factor-1,CBF1)又名RBP-JK[4],是Notch信号途径目前已知的细胞核内唯一的调控因子,被证明参与多种细胞的分化调控。研究表明γ分泌酶抑制剂DAPT(γ-secretase in⁃hibitor)作为Notch信号通路的阻断剂,能特异地阻断γ分泌酶的作用,进而阻止Notch信号通路的活化;而γ分泌酶(γ-secretase)对Notch受体在S3切割位点的水解很关键,是调节Notch信号通路的核心环节。Kuang等[5]研究结果显示,利用DAPT来抑制Notch信号通路能够使成肌调节因子MyoD(Myogenic Differentiation)阳性和Pax7阴性的卫星细胞趋向分化。
离心力竭运动引起骨骼肌微损伤已为许多报道及本研究室前期研究所证实,钝挫伤作为显著的损伤模型,其研究机制亦有相关研究涉及[6],但二者的同步比较还未见报道。本研究通过建立大鼠力竭运动、急性钝挫伤两种模型,旨在比较测定其相关因子Pax7、CBF1、DAPT,初步探索其与Notch信号通路及肌卫星细胞之间的关系及可能机制,为骨骼肌损伤修复提供理论依据,有其特定的意义。
1 材料和方法
1.1 动物分组与取材
选用7周龄清洁级SD雄性大鼠24只,均由江苏大学实验动物中心提供,许可证号:SCXK(苏)2013-0011。随机分为4组,每组6只,即:安静对照组(Con⁃trol,C组);力竭运动即刻组(Exhaustive,E0组);力竭运动后24 h组(E24组);力竭运动后48 h组(E48组)。另取18只SD大鼠,分为3组,每组6只:钝挫伤即刻组(contusion,D0组);钝挫伤后24 h组(D24组);钝挫伤后48 h组(D48组)。
安静对照组、力竭运动组、钝挫伤组分别于安静状态、力竭运动后和钝挫伤后不同时间点,进行宰杀取血,分离血清。并取下右侧腓肠肌,将腓肠肌分为两份,一份立即进行细胞培养实验,另一份和血清一起在-80℃冰箱保存,用ELISA法检测Pax7、CBF1、DAPT的含量变化。另取新生3日龄鼠3只,宰杀后同样取右侧腓肠肌进行细胞培养实验。
1.2 力竭运动模型的建立
参考郑陆的动物训练模型[7],运动组大鼠均进行一次性的力竭离心运动(即持续下坡跑),依次进行第Ⅰ级负荷(相当于53%VO2max强度):0°,8.2 m/min,15 min;第Ⅱ级负荷(相当于64%VO2max强度):-5°,15 m/min,15 min;第Ⅲ级负荷(相当于76%VO2max强度):-10°,19.3 m/min,直至力竭。力竭标准:大鼠无法跟上跑台速度总是滞留于跑台的后端,已不能使用后肢的蹬力让自己跑动而伏地,用毛刷、声、光、电刺激尾部或人为驱赶都无法刺激使大鼠继续运动,据此判定达到了力竭。
1.3 钝挫伤模型的建立
参照Kami等的方法[8],采用自制的打击装置,为金属圆柱体,质量为200 g。底面面积2.25πcm2,下降高度为36 cm,动能0.7 J。将大鼠右后肢置于伸膝、踝背屈位置,以2 s的间隔连续击打5次。经解剖发现,局部出现肿胀和轻度瘀血,证实肌肉钝挫伤模型建模的成功率为100%。
1.4 细胞培养仪器及试剂
培养基系Gibco公司产品:高糖DMEM培养基,占78%;标准马血清,占10%;胎牛血清,占10%;青/链霉素,占2%。主要仪器:采用日本OLYMPUS公司的光学倒置显微镜,日本尼康的NikonE600显微照相图像采集系统,赛默飞世尔(Thermo)科技公司的CO2恒温培养箱。
1.5 大鼠骨骼肌卫星细胞的分离和培养方法
(1)取少许肌肉样本,放入少量含2%双抗的hanks液中,使用眼科剪将组织剪成1 mm3大小的肉糜,并将hanks缓慢倒掉。(2)放入少量0.25%的胰蛋白酶,使之消化至组织沉淀,洗涤后倒掉液体,留下沉淀。(3)再加入0.25%胰蛋白酶溶液5 m l左右,震荡后移至离心管,然后放入37℃水浴箱消化50~60 min。(4)依次用200目、400目的筛网进行过滤,收集滤液离心10 min,转速2000 r/min,取沉淀,并加入适量的培养液培养。(5)每隔60 min进行一次差速贴壁,共两次。然后在第二次贴壁的培养瓶中,加入新鲜的培养液培养。每隔24 h更换培养液,用倒置显微镜进行观察,拍摄并定性分析图像。观察、分析各组第1天、第5天、第7天的卫星细胞变化情况。
1.6 骨骼肌及血清中Pax Pax7 7、CBF CBF1 1、DAPT DAPT含量的测定
采用酶联免疫吸附法(ELISA):Pax7、CBF1、DAPT的 ELISA试剂盒均购自上海博谷生物有限公司。美国ELX800型酶标仪,操作按照试剂盒说明,所有样本采用平行管测定。定氮用考马斯亮兰法。
1.7 统计学分析
用Microsoft Excel处理数据,计算平均数及标准差。数据统计用SPSS21.0软件系统,组间及各时相的差异,均采用One-way ANOVA程序进行单因素方差分析,P<0.05为显著性差异。
2 实验结果
2.1 力竭运动组、钝挫伤组及新生鼠不同时期卫星细胞的体外培养结果
2.1.1 各组培养1 1天后骨骼肌卫星细胞生长状况
当各组大鼠骨骼肌卫星细胞培养1天时,安静对照组、力竭运动组和钝挫伤组均未看到增殖和分化的肌卫星细胞,部分只有少量未被过滤的肌纤维细胞,新生鼠组可观察到有少量的梭形肌卫星细胞。
2.1.2 各组培养5 5天后骨骼肌卫星细胞生长状况
图1为各组大鼠骨骼肌卫星细胞培养5天后图片状况:安静对照组(C组)仍未看到有卫星细胞痕迹;其余各组肌卫星细胞增长趋势良好,数量上比之前几天均明显增多,钝挫伤组在增长数量上要高于力竭各组。新生鼠卫星细胞在数量上依然占据首位,已经完全覆盖培养皿,细胞大量富集,表明肌卫星细胞培养第5天各组开始大量增殖。力竭运动各组(E0、E24、E48)之间和钝挫伤各组(D0、D24、D48)之间相比较,骨骼肌卫星细胞数量随时间延长呈递增趋势。

图1各组培养5天后骨骼肌卫星细胞生长状况(n=6)
2.1.3 各组培养7 7天后骨骼肌卫星细胞生长状况
由图2可见,安静对照组(C组)依旧未出现卫星细胞,其余各组比前几天均出现不同程度的大量增殖,到第7天时均在培养皿中有较密的分布。力竭运动和钝挫伤各组骨骼肌卫星细胞增殖分化为纺锤形和星形,细胞呈集落样,并且细胞之间不同程度地出现少量交叉融合现象,折光性好且可见细胞中央的透明细胞核,少量正在趋向融合。钝挫伤各组细胞已布满培养皿,D0组和D24组肌卫星细胞增殖、迁移并逐渐规律性地沿一个方向平行排列并伴有少量相互融合现象。新生鼠(N)组培养7天后培养皿细胞已达到饱和,细胞开始由增殖分化逐渐转换为融合。
2.2 力竭运动及钝挫伤各个时期大鼠骨骼肌、血清中CBF CBF1 1含量变化
从表1可见,与安静对照组对比,力竭运动及钝挫伤各组骨骼肌和血清中CBF1的含量均上调,且均具有显著差异(P<0.05),其中D0组差异极显著(P<0.01),且明显高于其他各组(P<0.05);但力竭运动各组(E0、E24、E48)和钝挫伤D24、D48组之间差异不显著(P>0.05)。
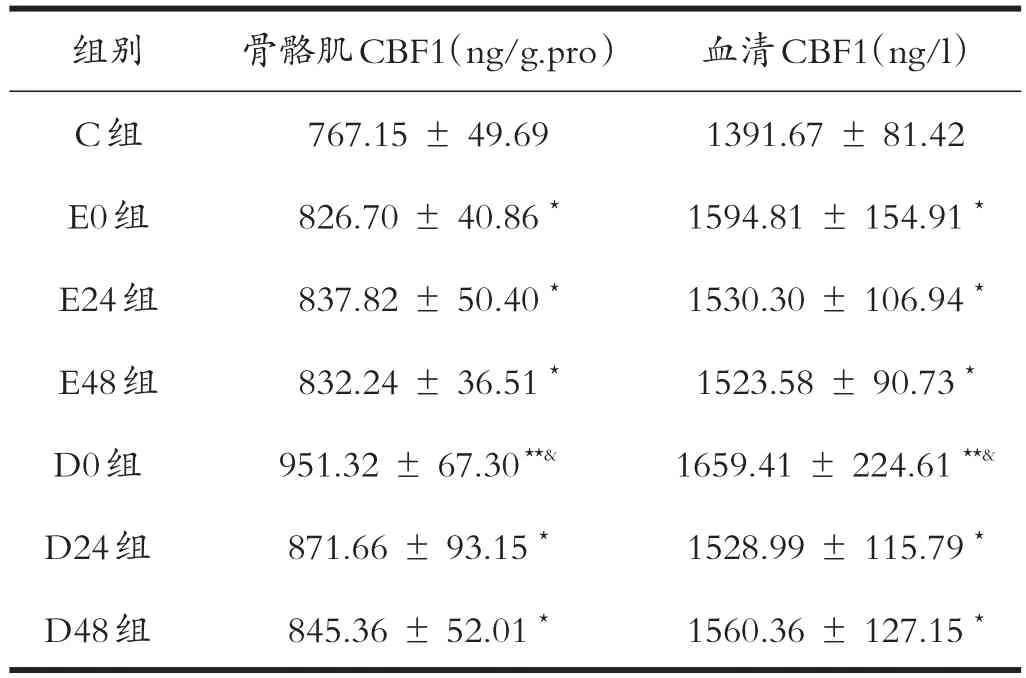
表1各组大鼠骨骼肌、血清中转录因子CBF1含量的变化(n=6)

图2各组培养7天后骨骼肌卫星细胞生长状况(n=6)
2.3 力竭运动及钝挫伤各个时期大鼠骨骼肌、血清中DAPT DAPT含量变化
表2结果显示:与安静对照组对比,力竭运动及钝挫伤各组骨骼肌和血清中DAPT的含量均下调,且均具有显著差异(P<0.05);其中D0组差异极显著(P<0.01),且明显低于其他各组(P<0.05);但力竭运动各组(E0、E24、E48)和钝挫伤D24、D48组之间差异不显著(P>0.05)。
2.4 力竭运动及钝挫伤各个时期大鼠骨骼肌、血清中Pax Pax7 7含量变化
从表3可见,与安静对照组对比,力竭运动及钝挫伤各组骨骼肌和血清中Pax7的含量均上调,且均具有显著差异(P<0.05);其中D24、D48两组差异极显著(P<0.01),且明显高于其他各组(P<0.05);但力竭运动各组(E0、E24、E48)和钝挫伤D0组之间差异不显著(P>0.05)。
3 讨论
3.1 钝挫伤、力竭运动对卫星细胞的激活及体外培养增殖分化情况对比
目前关于力竭运动、钝挫伤对卫星细胞激活的比较研究还少见报道。骨骼肌卫星细胞是一种具有一定自我更新能力及某种程度定向分化的成体组织内的干细胞[1],一般情况下保持静止状态、不分裂,但受到创伤、负重锻炼、牵拉等刺激后,肌卫星细胞从静息转向激活状态,胞质扩张。当内质网、线粒体、核糖体和高尔基体等变得清晰明显时,进入分裂、增殖期,产生肌前体细胞,并分化、融合成肌管,再形成肌细胞。如果用伽马射线进行破坏,即使再进行抗阻训练,肌肉也不会再有所增长。因此肌肉的损伤,卫星细胞的激活是肌纤维再生、修复的前提,其增殖和分化也是肌细胞肥大、数目增多及肌纤维转化的重要机制[9]。
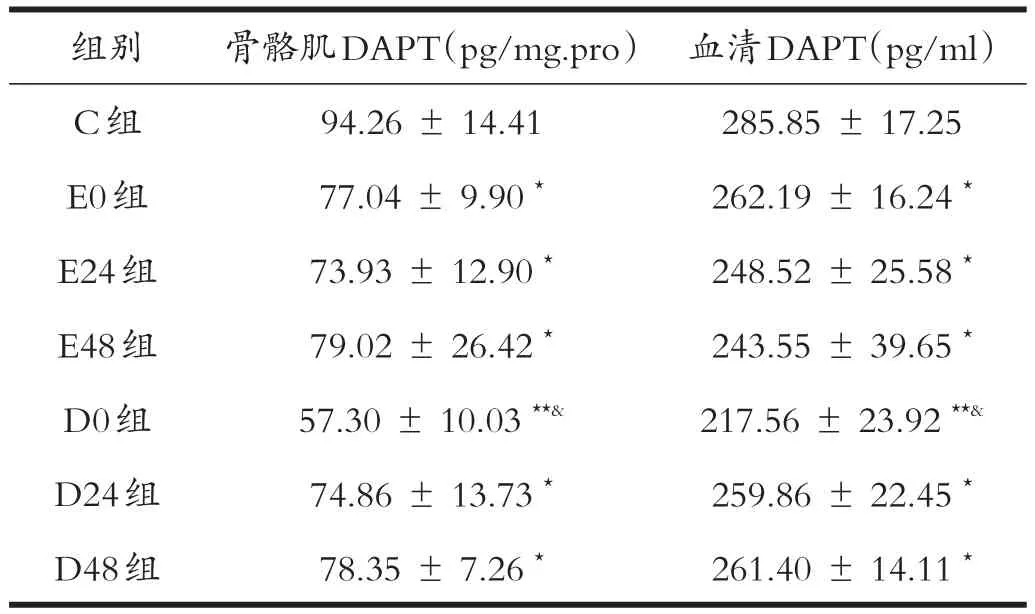
表2各组大鼠骨骼肌、血清中转录因子DAPT含量的变化(n=6)
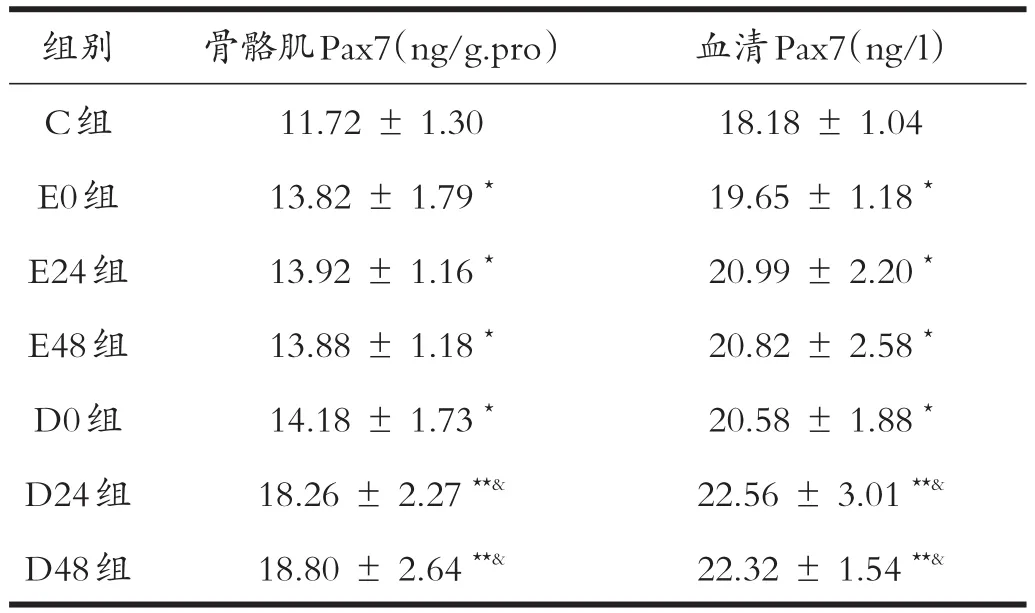
表3各组大鼠骨骼肌、血清中转录因子Pax7含量的变化(n=6)
有研究表明,当骨骼肌受到钝挫伤后,其损伤区域就会出现大量肌卫星细胞的激活和增殖。于秋华等[6]通过建立钝挫伤模型,采用免疫组化方法测定肌卫星细胞的增殖细胞核抗原(PCNA)的表达,结果在损伤后第1天,大鼠腓肠肌损伤组织中开始出现肌卫星细胞PCNA阳性核表达;到损伤后的第14天,受损组织中仍有卫星细胞PCNA阳性核呈现。将培养成功并经过荧光标记的肌卫星细胞移植到大鼠的钝挫伤部位,在钝挫伤部位修复后,可出现带有荧光的肌细胞核,且移植的大鼠比未移植大鼠的钝挫伤修复部位的肌细胞排列更加紧密,说明卫星细胞在骨骼肌钝挫伤修复中有着重要作用。Bickel等[10]选择8位不常运动的健康男性,让其进行离心踢腿运动,结果显示4天后肌卫星细胞的数目显著增加,随后又选取11名老年男性,经过14周的耐力训练,结果卫星细胞数目在股外侧肌增加了29%,这表明卫星细胞数目受运动影响较大,其数目增加可防止肌肉的萎缩,并维持老年人的肌肉体积和肌肉质量。
本实验通过对新生鼠组、力竭运动组及钝挫伤组分别进行骨骼肌卫星细胞体外培养,结果显示,不同模型刺激后的卫星细胞数量和体外增殖速度也不同。大鼠骨骼肌卫星细胞培养1天后,安静对照组未见梭形或圆形细胞,力竭组、钝挫伤组中虽未见梭形细胞,但可见少许的圆形细胞,还未明显激活;此时新生鼠组可见少量激活的梭形肌卫星细胞。当各组骨骼肌卫星细胞培养3天及5天时,除安静对照组外,均可见梭形的肌卫星细胞增殖。到第7天时均达到各自的增殖高峰期。力竭运动和钝挫伤各组骨骼肌卫星细胞增殖分化为纺锤形和星形,细胞呈集落样,并且细胞之间不同程度地出现少量交叉融合现象,折光性好且可见细胞中央的透明细胞核,少量正在趋向融合。新生鼠的肌卫星细胞数量明显多于其它各组,可见新生鼠肌卫星细胞尚未进入休眠状态,此时活性最强,增殖和分化速度最快,有利于骨骼肌的快速生长和发育。而钝挫伤组的肌卫星细胞数量明显多于力竭运动组,可能由于钝挫伤对骨骼肌造成的损伤程度较重,亦能较强地刺激卫星细胞的激活、增殖,进而促进骨骼肌的损伤修复。此外,力竭运动各组(E0、E24、E48)之间和钝挫伤各组(D0、D24、D48)之间相比较,骨骼肌卫星细胞数量随着时间延长呈递增趋势,体现了卫星细胞激活的时间效应。关于卫星细胞在体数量的变化,还有待进一步研究。
3.2 CBF CBF1 1与Notch Notch信号通路在骨骼肌损伤修复的作用
Notch信号通路是一个多因素、多步骤参与的信号转导过程,且高度保守,在细胞分化和胚胎发育中起重要作用[11]。除Notch及其配体Delta外,参与Notch信号转导的分子还包括下游效应子Hes、转录调控因子CBF1等。D'Souza等[12]报道,Ⅰ型糖尿病人和小鼠由于Notch信号的改变,会引起卫星细胞数量和功能减退。Divya等[13]报道,激活转录因子2(ATF2)作为神经前体细胞的一个因子,通过CBF1/Notch信号通路,可协同激活Notch依赖性神经前体细胞Hes-1的表达。CBF1又名RBP-Jκ,是目前已知的Notch信号途径中细胞核内唯一的调控因子,Notch/CBF1途径已被证明参与多种细胞的分化调控[4],例如其参与了小鼠骨组织的发生发育的全过程,可能也参与了成熟骨组织的代谢和改建。王胜朝[14]等在成骨前体细胞中检测发现:CBF1作为转录调控因子瞬时表达,可以促进核心结合因子Cbfa1基因启动子和骨钙素基因启动子区域Ose2元件的启动子活性,提示CBF1可能对前体细胞的骨形成分化有正向调节作用。
目前有关运动及钝挫伤对CBF1、DAPT、Pax7与Notch的影响研究少见报道,大都研究其与疾病及卫星细胞的关系。本实验模型下,与安静对照组相比,力竭运动和钝挫伤可以使大鼠骨骼肌和血清CBF1和Pax7的含量上升,但下调DAPT的含量。表明CBF1和Pax7可能在骨骼肌卫星细胞激活及骨骼肌损伤修复中起着正向调节的作用,而DAPT可能起着负向调节作用。
3.3 DAPT DAPT与Notch Notch信号通路在骨骼肌损伤修复中的作用
穆树云[15]通过对生长期小鼠进行下坡跑运动、平坡跑运动和游泳运动等3种不同方式的运动干预,研究对生长期小鼠骨密度、骨矿物质含量及骨代谢关键因子表达的影响,结果显示:跑台运动能够显著上调Notch信号通路中γ-分泌酶的表达,而DAPT可特异性地抑制γ分泌酶从而阻断Notch信号通路。该研究还显示,激活Notch通路可促进大鼠骨髓间充质干细胞(bone mesenchymal stem cells,BMSC)的增殖,但抑制Notch通路可促进BMSC成骨分化。Wang等[16]研究报道,Lingo-1 shRNA和Notch信号抑制剂DAPT可促进神经干细胞分化成神经元。Kuang等[5]研究结果显示,如果利用γ-分泌酶的抑制剂DAPT来抑制Notch信号通路,能够使成肌调节因子MyoD(myogenic differentia⁃tion)阳性和Pax7阴性的卫星细胞趋向分化。由于一部分卫星细胞的不对称分裂,导致了Numb(一个重要的细胞命运决定子)的不均匀分布。Numb能抑制Notch信号通路,其作用方式为通过结合到Notch受体胞内段(notch intracellula domain,NICD)上来抑制细胞核的易位。本实验模型下,力竭运动和钝挫伤均可下调DAPT的含量,可能通过降低DAPT对Notch信号通路的抑制作用,而在骨骼肌卫星细胞激活及骨骼肌损伤修复中起着正向调节作用。
3.4 Pax Pax7 7对卫星细胞及骨骼肌损伤修复的影响
Pax7是pax基因家族的第Ⅲ组,对中枢神经系统和骨骼肌的发育有着很重要的作用,是一种强有力的生肌性诱导物,尤其在骨骼肌受到损伤时对修复起到重要作用,且Pax7是肌再生的上游调节者[17]。当Pax7基因表达被干扰后,肌肉不能正常发育;Pax7基因可作为靶标基因来治疗肌肉萎缩或肌肉发育障碍等肌肉疾病。当缺少pax7时,由于细胞周期缺陷而导致细胞凋亡,出生后卫星细胞将会急剧丢失,故表达Pax7细胞的数量能够很好地反映出卫星细胞的数量[18]。在激活的卫星细胞中,pax7有重要的抗凋亡作用,这是pax3所不能补偿的。
王今越[19]研究发现,Pax7在衰老组(40 d D-半乳糖注射致衰老)下降,运动组(40 d D-半乳糖注射+6周跑台运动的衰老运动组)Pax7上调,提示运动后Pax7的升高明显对肌肉流失起到抑制作用。Zheng等[20]研究了Pax7,MyoD,Myf5在肌再生与分化中的甲基化特征,发现在成肌细胞的融合进程中,可见到Pax7,MyoD和Myf5基因前体和外显子1的甲基化,且具有低甲基化与高表达之间的反向变化关系。结果显示DNA的甲基化可能是细胞再生分化过程中调节Pax7和MRFs转录的重要机制。本研究结果显示,力竭运动和钝挫伤在对卫星细胞激活增强的同时,Pax7也呈现出同步增高,显示了一定的平行关系和相关性。
综上所述,在骨骼肌的生长发育和再生过程中,卫星细胞均发挥着至关重要的作用,CBF1、DAPT、Pax7与Notch信号通路是调节这一过程的重要信号通路。本研究建立大鼠力竭运动、钝挫伤两种模型,初步比较了在不同模型下的卫星细胞激活及体外培养情况,以及CBF1、DAPT、Pax7在不同程度损伤修复中的含量变化,并对相关机理进行了初步探讨,为骨骼肌卫星细胞在肌肉损伤修复中的作用及机制提供了参考依据,对于肌肉疾病的诊断、治疗和预后具有参考意义。
4 结论
(1)钝挫伤及力竭运动均可激活肌卫星细胞激活,并使其增殖分化,且钝挫伤组的骨骼肌卫星细胞增殖数量明显多于力竭运动组,可能由于钝挫伤对卫星细胞的刺激更强所致。
(2)钝挫伤和力竭运动可以使大鼠骨骼肌和血清Pax7和CBF1的含量上升,但下调DAPT的含量。Pax7和CBF1可能在骨骼肌卫星细胞激活及骨骼肌损伤修复中起着正向调节的作用,而DAPT可能起着负向调节作用。

