壳聚糖薄膜成球培养对脐带间充质干细胞迁徙趋化的影响
李华杰, 徐雄峰, 邱 波
武汉大学人民医院关节外科, 武汉 430060
间充质干细胞(mesenchymal stem cells,MSCs)是一种非造血组织的多能干细胞,具有多向分化潜能、旁分泌效应、免疫调节、迁徙趋化等特性,在软骨修复、伤口愈合、肝脏再生等领域都证实了其治疗作用,被视为组织工程中的种子细胞[1~3]。MSCs来源广泛,可以从多种组织中分离获取[4],而要达到临床移植的细胞数量级,体外扩增是不可或缺的步骤。然而,研究显示原代MSCs经常规体外培养扩增后迁徙能力迅速下降,移植生物体后,靶向组织中的MSCs检出率较低,治疗效果难以达到预期[5],而以MSCs移植为基础的治疗效应,很大程度要依赖其向组织损伤部位的靶向迁徙作用。越来越多的学者认为,微环境的改变是MSCs常规培养扩增后各种原始特性衰退的重要原因,因此亟须寻找更加成熟高效的MSCs体外培养方法,从而能够有效维持MSCs迁徙趋化等原始特性,加强MSCs治疗作用的发挥[6]。
研究发现,与传统贴壁培养相比,三维多细胞球状体可以更好地模拟真实的体内环境,三维成球培养体系可显著促进MSCs的生物活性,表现出更强的治疗潜力[7,8]。因此,球体形成方法成为干细胞研究领域的一项重要技术,现已研发了数种获得MSCs球体的三维培养方法,包括悬滴法、非黏附材料表面法、旋转瓶培养法和微流体系统等。尽管上述方法均可制备MSCs球体,但仍存在局限性,例如,使用悬滴技术可以收获较为均一的细胞球体,但由于悬滴体积的限制,球体的平均尺寸相对较小,制备的球体产量也较低;旋转瓶培养法获得的细胞球体,尺寸大小可以通过旋转速度操控,然而需要特制设备,旋转产生的层流也可能损伤细胞本身;非黏附材料表面虽可制备大量球体,球体的尺寸较难控制;通过微流体系生产的细胞球体难以收集进行后续操作[9]。近年发现将壳聚糖材料制备为培养底物,可诱导MSCs自发组装为3D球体,之前的研究证实这种成球培养对MSCs干性基因表达具有显著的促进作用[10]。本文将进一步探讨这种生物膜成球培养对MSCs迁徙趋化能力的影响,并探讨其相关机制,以期提高MSCs的移植效率。
1 材料与方法
1.1 实验材料
壳聚糖粉末购自国药集团化学试剂有限公司;胎牛血清及DMEM培养基购自美国Gibco公司;Transwell小室购自美国Corning公司;荧光定量PCR仪购自上海宏石医疗器械有限公司;SYBR GREEN PCR Master Mix(荧光定量PCR预混液)、RNA提取试剂盒及超微量分光光度计购自美国赛默飞公司;PCR引物购自武汉谷歌生物技术公司;逆转录酶试剂盒购自天根生化科技(北京)有限公司;实验所用脐带标本取自武汉大学人民医院妇产科一分娩后健康产妇,产妇及家属对脐带用于实验研究均知情同意并签署知情同意书,并经武汉大学人民医院伦理委员会批准。
1.2 CS底物制备
将1%的壳聚糖溶液(溶液含1%冰醋酸)均匀涂布于六孔培养板底部,1.2 mL/孔。置于65℃烘箱24 h烘干液体,制成CS薄膜底物。细胞实验前将六孔板在紫外线下暴露过夜,CS底物经0.5 mol/L NaOH溶液中和处理10 min,用无菌水充分洗去碱液残余,然后PBS冲洗后进行后续操作[10]。
1.3 原代脐带间充质干细胞的分离提取
用含100 U/mL青霉素、100 U/mL链霉素的PBS溶液充分洗涤脐带,用镊子从脐带的中间分开华氏胶组织,将所得组织充分剪碎至1 mm3大小,加入低糖DMEM培养液置于37℃ 5%的CO2培养箱培养,培养液中含10% 胎牛血清,培养5~7 d后,可见有部分细胞从组织块周围爬出,形态呈细小的梭形,一周后,细胞开始迅速增殖,形成大小不等的细胞集落,待细胞长满后,用0.25%胰蛋白酶消化传代,换用5%胎牛血清低糖DMED培养基继续培养。从形态学和流式细胞仪分析鉴定这些细胞为MSCs,以P1代细胞作为种子细胞进行后续实验。
1.4 实验分组及细胞培养
将获得的MSCs P1代细胞以3×105/孔接种实验组六孔板,即底部覆盖CS薄膜的六孔板;同样密度接种于普通六孔板,作为对照组。两种培养方式均使用含5% 胎牛血清的低糖DMEM培养基,置于37℃ 5%的CO2培养箱。观察细胞形态,接种72 h后收集细胞进行后续实验。
1.5 细胞划痕实验
消化并收集两组细胞种植于六孔培养板,待细胞融合度接近80%用200 μL枪头平行划线,PBS洗去散落细胞,换用无血清低糖DMEM培养基继续培养。选取5个观察点显微镜拍照记录,Image J 软件处理图片,分析48 h划痕区域愈合情况,实验重复3次。
1.6 Transwell法检测细胞迁徙
收集细胞并计数,用DMEM无血清培养基稀释细胞至2.5×105个/mL,将500 μL 10%胎牛血清DMEM培养基预先加入24孔板中,并将Transwell小室(8 μm)置于24孔板中,上室加200 μL的细胞悬液,置37℃ 5%的CO2培养箱,分别于24 h、48 h后取出小室,用10 mmol/L PBS清洗2遍,棉签擦拭上室中的细胞,95%乙醇固定30 min,0.2%结晶紫染色15 min,PBS再次清洗,显微镜选取5个视野,计数细胞,实验重复3次。
1.7 RT-PCR测定迁徙相关基因mRNA表达水平
采用Real-time PCR方法检测实验组和对照组培养MSCs迁徙相关基因(CXCR4、CXCR7、MCP-1、MMP-1、MMP-2、MMP-9、TIMP-2)的表达水平。收集培养72 h的两组细胞,提取总RNA,用逆转录酶试剂盒转录成cDNA,取2 μL cDNA作为PCR扩增模板,使用GAPDH作为内参基因。用SYBR GREEN PCR Master Mix在PCR仪定量分析。采用2-ΔΔCt法分析PCR结果,将对照组基因表达量进行归一化处理,用柱形图表示实验组mRNA相对表达倍数,RT-PCR引物序列见表1。
1.8 统计学分析
所有实验数据均采用SPSS V22.0统计学分析软件进行统计分析,计量资料以平均数±标准差表示,采用Students’t-检验进行两样本均数差异显著性分析,P<0.05定义为显著性差异。

表1 RT-PCR引物序列Table 1 Sequences of Real-time PCR primers.
2 结果与分析
2.1 脐带间充质干细胞的形态学观察
如图1(彩图见图版三)所示,接种于常规聚苯乙烯平板表面培养后,MSCs表现为类成纤维细胞形态的贴壁细胞,增殖后聚集成簇,而CS作为底物的培养条件下,MSCs类似悬浮生长状态,单个细胞的体积明显较小,MSCs在CS表面自发聚集为球状体,并进行性增大,球团之间也存在再融合趋势。
2.2 划痕实验检测实验细胞迁徙能力
选取5个观察点,记录实验组及对照组48 h内划痕区域内细胞迁移情况(图2,彩图见图版三),经Image J软件分析愈合率结果(图3)显示,与对照组相比,实验组划痕间区域愈合速率较快,差异有极显著统计学意义 (P<0.01)。说明壳聚糖薄膜培养组MSCs具有更为活跃的体外迁徙能力。

图1 两种培养方式中MSCs的形态学观察Fig.1 Morphological observation of MSCs in two groups.(彩图见图版三)

图2 划痕实验检测MSCs 迁徙能力Fig.2 Migration activity of MSCs measured by wound healing assay.(彩图见图版三)
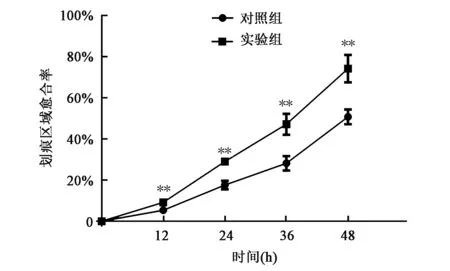
图3 划痕实验中两组MSCs划痕区域愈合率对比Fig.3 Comparison of healing rate in two groups by wound healing assa.
2.3 Transwell小室迁徙实验
倒置显微镜下对各组穿膜细胞数计数如图4(彩图见图版三)、图5所示:24 h时,对照组穿膜细胞数8.80±2.18,实验组为14.80±2.05;48 h时对照组穿膜细胞数11.20±1.79,实验组为21.60±1.87,经SPSS 22.0进行统计学分析,两组之间差异有极显著统计学差异(P<0.01),说明壳聚糖薄膜培养显著促进了MSCs的趋化特性。
2.4 Real-time PCR检测迁徙相关基因的表达水平
采用Real-time PCR方法检测两种方式培养的MSCs迁徙趋化相关基因表达,结果分析显示,CS培养组MSC球体中趋化因子MCP-1,趋化因子受体CXCR4、CXCR7,以及基质金属蛋白酶家族MMP-1、MMP-2、MMP-9、TIMP-2等基因表达水平显著上调,CS组mRNA相对表达倍数如图6所示。说明壳聚糖薄膜成球培养显著上调了MSCs中迁徙趋化相关基因的表达。

图5 24 h和48 h时两组MSCs在Transwell实验中穿膜细胞数比较Fig.5 Comparison of cell numbers in two groups by Transwell assay at 24 h and 48 h

图6 CS培养组MSCs迁徙趋化相关基因mRNA相对表达倍数Fig.6 The relative expression multiple of mRNA from genes about migration and chemokines of MSCs in chitosan film culture group.
3 讨论
众所周知,MSCs具有修复替代功能,并可通过旁分泌效应调节损伤部位的微环境[11],刺激内源性干细胞增殖,特定受损部位的迁徙细胞数目与MSCs发挥修复功能密切相关,如何提高MSCs移植后的迁徙效率越来越受到研究者的重视[12,13]。此前研究表明,CS成球培养可显著促进MSCs干细胞特性,潜在机制可能涉及CS对MSCs的底物依赖性基因调控[14]。本文的细胞划痕及Transwell迁徙实验结果显示,CS培养组细胞球体解离的MSCs具有更活跃的运动能力和更多的小室穿膜细胞数,证实了这种生物膜成球培养对MSCs的迁徙趋化特性的促进作用。
与其他球体培养方案一致,实验中还观察到CS成球培养中单个MSCs细胞体积较常规贴壁培养明显偏小。有研究表明,MSCs常规扩增后靶向组织迁徙效率低下与其输注生物体后发生的组织血管栓塞有密切关系,包括静脉输注后的肺部滞留和动脉输注后的脑血管栓塞,而单个MSCs细胞的大小是影响栓塞的重要因素[15,16];研究发现球体解离的MSCs体积较小,很大程度避免了动脉输注后的脑血管栓塞现象,并增强了对脑梗死的治疗效果[17]。这表明壳聚糖薄膜成球培养的小体积MSCs更有利于突破组织血管屏障,实现更为高效的迁徙作用。
此外,本文实验进一步通过RT-PCR分析证实了CS成球培养对MSCs迁徙趋化基因的显著影响。在各类损伤或炎症模型中,趋化因子会局部高表达从而动员趋化性细胞靶向迁徙发挥调节作用,MSCs迁徙效应同样与这种趋化作用密切相关[13]。研究表明,常规方式体外扩增后,MSCs表面的趋化因子受体表达迅速下降,严重削弱了靶向迁徙效应[5]。本文研究结果表明CS成球培养对MSCs趋化相关基因CXCR4、CXCR7、MCP-1等基因表达具有不同程度的上调。趋化因子受体CXCR4、CXCR7在MSCs迁徙过程中均具有重要作用,且两者存在串扰效应[18]。尤其CXCR4在两种培养方式下表达差异极显著(接近50倍相对表达量),SDF-1/CXCR4作为细胞迁徙中的主要趋化轴被广泛研究,MSCs在受损组织中的募集也有赖于这条通路的激活,而通过CXCR4基因的过表达也实现了MSCs高效的靶向迁徙[19,20]。MCP-1作为趋化因子在MSCs归巢中发挥重要作用[21],其在MSCs中的高表达可能与趋化特性的维持存在关联。
CS培养的MSCs 球体中MMP-1、MMP-2、MMP-9、TIMP-2等表达水平的上调对于MSCs的迁徙趋化同样具有重要意义。除了依靠远程的趋化作用到达靶向组织,MSCs移植到生物体内后还需要一定的组织屏障穿透能力,迁徙至损伤区域发挥修复作用,这个过程与MMP家族基因表达密切相关[22]。细胞迁徙过程中,需要通过MMP裂解组织基底膜,特别是MMP-2和MMP-9,其在降解胶原和明胶(基底膜的主要组分)中发挥关键作用[23]。研究表明,广谱MMP抑制剂存在下,MSCs穿过基底膜的能力可被有效阻断,MMP-1作为间质胶原酶,在高迁移率MSCs中活性较强[24];而MMP-2、TIMP-2基因的敲低,显著降低了MSCs的迁徙能力[25]。此外,TGF-β1、IL-1β等炎性因子的干预可以显著上调MSCs中MMP-2、MMP-9的表达,刺激MSCs的趋化性迁徙[25];细胞外基质的MMP水解产物对MSCs迁徙发挥介导作用[22];MMP-2活性抑制可阻遏SDF1/CXCR4信号传导,抑制MSCs迁移[26]。
值得注意的是,本文研究发现,CS薄膜培养的MSCs球体中趋化因子受体、MMP家族等相关检测基因都呈现出不同程度的表达上调。很多研究通过基因修饰、化学处理、细胞因子干预、缺氧培养等手段强化某些基因在MSCs中的表达,从而实现对其迁徙效应的促进作用[27~29]。然而,此类方法某种程度上忽略了常规贴壁培养环境与生物体内MSCs原始生存微环境的巨大差异是造成MSCs原始特性衰退的重要原因;而球体培养方案展现出了巨大的应用潜力,其模拟了MSCs团块聚集的生长方式,提供了轻度缺氧微环境,紧密的细胞间接触,ECM的立体包裹,使MSCs的生物活性整体得到了较好维持[30]。MSCs的迁徙机制较为复杂,我们的研究初步证实了CS成球培养对MSCs迁徙趋化特性的促进作用,仍需要进一步的深入探索。

