标准通道与微创经皮肾镜取石术在不同肾盂压力下治疗鹿角形肾结石比较
龙兆麟 黄韬 廖春贤
南方医科大学顺德医院(佛山市顺德区第一人民医院)泌尿外科(广东佛山 528300)
经皮肾镜碎石取石术(percutaneous nephroli⁃thotomy,PCNL)是目前治疗鹿角形肾结石的首选方式[1]。但是,PCNL术中灌注可引起肾集合系统压力失衡,这是导致发热、脓毒血症或感染性休克的重要原因[2-3]。微创经皮肾取石(minimally invasive percutaneous nephrolithotomy,MPCNL),具有穿刺通道小,术后并发症较低等优点,但可导致肾盂高压、术后发热感染甚至感染性休克的概率较高[4-5]。
持续的肾盂灌注,使得肾盂内压升高易导致术后发热或者感染性休克等,因此持续的同步监测肾盂内压对于减少术后并发症至关重要。但是目前研究多集中在标准通道与微通道PCNL术治疗鹿角形肾结石的疗效对比方面,而对于术中肾盂压力监测的研究较少[6-8]。为此笔者对我院2015年1月至2017年10月收治的185例鹿角形肾结石患者分别采用以20F、22F为代表的标准通道和以16F、18F为代表的微通道行PCNL,比较两种通道在不同肾盂压力下治疗鹿角形肾结石的临床疗效。
1 资料与方法
1.1 一般资料 收集自2015年1月至2017年10月在我院确诊的鹿角形肾结石患者185例。
入组标准:(1)单侧鹿角形结石;(2)完全或部分鹿角状肾结石;(3)无肾积水或合并轻度肾积水;(4)术前使用敏感抗生素治疗至尿培养阴性[9]。排除标准:(1)先天性肾脏畸形;(2)心肺功能不全而无法耐受手术者;(3)严重凝血功能障碍者。本研究经医院伦理委员会批准,所有患者及其家属均同意参与本次研究,并签署知情同意书。
纳入自2015年1月至2017年10月确诊的鹿角形肾结石患者185例,其中男81例,女104例,平均年龄(57.6±10.3)岁,术前常规检查血生化、肝肾功能、尿细菌培养等明确结石大小、位置及是否存在泌尿系感染。将患者随机分为16F、18F、20F、22F通道组,并且依据术中肾盂内压力≥30 mmHg,持续时间超过 10 min[10-11],将上述通道组再次分为低压组与高压组(表1)。所有PCNL术均由同一组医师完成。

表1 185例鹿角形肾结石患者基线资料Tab.1 Baseline data of 185 cases of staghorn calculi
1.2 手术方法 所有患者均先在气管插管全麻后,常规仰卧截石位下经输尿管镜逆行插入剪去头端的5F输尿管导管至肾盂,留置导尿管后改俯卧位,然后在C臂X线或B超定位下穿刺,通过随机分组,分别采用16F、18F、20F、22F 作为手术通道,置入8/9.8F输尿管镜行经皮肾镜气压弹道碎石取石术。将艾贝尔压力传感器同输尿管末端相连接,然后排除管道内气体,并将换能器同肾脏平面持平使得初始压力调零,将换能器连接Philips MP20型监护仪血压测量通道。测压系统每秒钟采集一次数据,数据实时计入数据库。
1.3 观察指标 (1)疗效方面:比较8组的碎石时间、手术出血量、结石清除率。(2)安全性方面:比较不同组别的出现发热、感染性休克、肾周积液的发生率。
1.4 统计学方法 采用SPSS 19.0统计软件进行统计分析,定量资料采用均数±标准差表示,组间比较采用t检验,检验水准α=0.05,以P<0.05为差异具有统计学意义。
2 结果
2.1 手术指标对比 (1)手术时间:首先进行比较不同通道之间的比较,16F及18F通道高压、低压组的手术时间均长于20F、22F通道高压、低压组(P<0.05),接着进行每个通道的高压、低压组之间的比较,结果表明高、低压组在手术时间方面,差异无统计学意义(P> 0.05);(2)出血量:在每个通道中,低压组的出血量均低于高压组,差异具有统计学意义(P<0.05),并且16F及18F通道低压组的出血量高于20F、22F低压组,组间比较差异有统计学意义(P<0.05);(3)结石清除率:16F及18F通道高压、低压组的结石清除率低于20F、22F通道高压、低压组,而在高压、低压组之间的比较,则表明低压组的结石清除率大于高压组,差异具有统计学意义(P<0.05)。见表2。
2.2 并发症指标对比 术后并发症方面,如表3所示,在每个通道组中,高压组并发症的发生率明显高于低压组(P<0.05),其中22F高压组并发症发生率在8组中最高。见表3。
3 讨论
鹿角形肾结石因具有结石复杂、取石困难和术后易复发的特征,是目前治疗泌尿系结石的难点。随着微创技术的发展,经皮肾镜碎石取石术已成为治疗鹿角形结石的首选手术方式[12]。但是传统的标准操作通道因通道口径宽,容易破坏段间或叶间血管,撕裂肾盏颈,从而引起严重的出血,导致手术并发症风险较高[13-14]。而近年逐渐广泛应用的微创经皮肾取石,具有穿刺通道小,术后并发症较低等优点,但正是因其通道过小,易造成肾盂高压、术后发热感染甚至感染性休克的概率较高[15-16]。为此,我们回顾性分析我院近3年来采用不同通道肾盂压力条件下治疗鹿角形结石的病例,从而分析何种方式既可以提高碎石率,又可降低肾盂压力,减少术后感染等并发症。
表2 8组患者的手术指标对比Tab.2 Comparison of the surgical indexes of 8 groups ±s
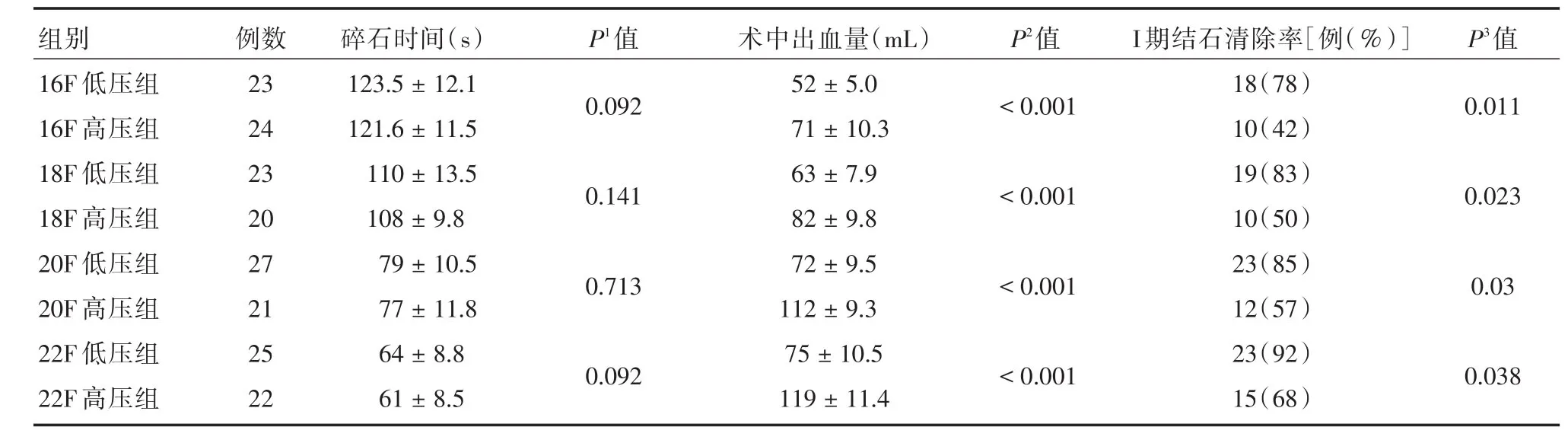
表2 8组患者的手术指标对比Tab.2 Comparison of the surgical indexes of 8 groups ±s
注:P1,高压、低压组碎石时间对比的P值;P2,高压、低压组术中出血量对比的P值;P3,高压、低压组Ⅰ期结石清除率对比的P值
组别16F低压组16F高压组18F低压组18F高压组20F低压组20F高压组22F低压组22F高压组例数23 24 23 20 27 21 25 22碎石时间(s)123.5±12.1 121.6±11.5 110±13.5 108±9.8 79±10.5 77±11.8 64±8.8 61±8.5 P1值P2值P3值0.092<0.0010.011 0.141<0.0010.023 0.713<0.0010.03 0.092术中出血量(mL)52±5.0 71±10.3 63±7.9 82±9.8 72±9.5 112±9.3 75±10.5 119±11.4<0.001 I期结石清除率[例(%)]18(78)10(42)19(83)10(50)23(85)12(57)23(92)15(68)0.038

表3 8组患者的术后并发症指标对比Tab.3 Comparison of postoperative complications of 8 groups
研究表明,持续的肾盂灌注,使得肾盂内压升高打开“返流开关”,含有细菌或内毒素的灌注液从集合系统返流进入静脉系统,引起术后发热或者感染性休克,因此持续的精确测量肾盂内压对于减少术后并发症至关重要[17-18]。但由于传统的测压方式具有不够灵敏、不精确等缺点,存在较大的误差[19]。我们从2014年1月开始使用艾贝尔压力测量传感器,具有反应灵敏、测量精确等优点,为本研究不同通道在高低肾盂压力条件下的PCNL疗效提供了设备保障。
本研究中,无论高压组或是低压组,以20F、22F为代表的标准通道的手术时间均明显短于以16F、18F为代表的微通道组,笔者认为有以下原因:(1)标准通道视野清晰、宽广,有利于碎石被超声吸引系统吸出;(2)微通道中,碎石堵塞输尿管镜和鞘之间的缝隙,不利于碎石排出,并且因其视野欠佳等原因也可延长手术时间。
在手术出血量方面,低压组的出血量均明显少于高压组,差异具有统计学意义(P<0.05),并且20F、22F通道中的低压组的术中出血量均少于16F、18F通道的低压组,差异具有统计学意义(P<0.05)。原因如下:(1)标准通道手术时间较短,减少术中出血时间;(2)20F、22F通道下视野较清,术者易控制碎石范围,不易损伤肾盂黏膜。
在并发症方面,高压组的感染相关并发症的发生率均高于低压组,差异具有统计学意义(P<0.05)。原因如下:(1)16F、18F微通道因其手术时间长,出现肾盂灌注高压,使得含有细菌及内毒素的灌注液返流入循环系统,因此术后感染概率较20F、22F组高;(2)20F、22F标准通道组,因其操作通道宽,灌注液引流通畅,结石不易发生堵塞,肾盂压力较低,减少了术后感染并发症的危险因素。
本研究中,我们采用艾贝尔压力测量传感器,具有反应灵敏、测量精确等优点,实时的监测标准通道及微通道在术中的肾盂压力,为明确其PCNL疗效提供了崭新的平台。局限之处在于该压力传感器是被动记录肾盂内压,无压力反馈元件,无法根据肾盂内压的变化反馈性的控制灌注压,因此目前仍需进一步改进压力传感器的操作模式。
综上所述,在肾盂压力<30 mmHg的低压力条件下,同16F、16F等微通道相比,20F、22F等标准通道治疗鹿角形肾结石既可以提高碎石率,又可减少术后感染等并发症。同时由于肾盂内压监测技术有利于减少术中灌注压过高,值得临床进一步推广应用。

