丹参素对腹膜粘连组织成纤维细胞胶原合成与降解的调控
曾煦欣 陈应军 毛建文 王芳 李艳萍 蒋泓 张丽华
1佛山科学技术学院口腔医学院(广东佛山 528000);2佛山市第一人民医院(广东佛山 528000);3广东药科大学(广州 510006)
手术后腹膜粘连(术后粘连)是腹盆腔手术常见并发症,发生率达90%以上,常导致肠梗阻、慢性腹痛、妇女不孕等后遗症发生[1-2]。术后粘连主要成因是组织受损处沉积的纤维蛋白未能及时被体内清除,成纤维细胞长入后过量分泌胶原等细胞外基质,导致纤维蛋白最终机化形成脏器间、脏器与腹膜间的永久性粘连。中药丹参(Salvia miltiorrhizaBge.)具有祛瘀止痛、活血通经的功效,近年被广泛用于术后粘连防治,效果良好[3]。本课题组前期对丹参防治术后粘连的药效基础与作用机制进行初步研究,从人体与大鼠腹膜粘连组织中分离培养出成纤维细胞(adhesion tissue fibro⁃blasts,ATF),发现丹参可抑制ATF增殖与胶原合成[4],其水溶性成分丹参素(Danshensu,DSS)通过下调转化生长因子β1(TGF⁃β1)mRNA水平抑制ATF增殖[5]。本研究使用TGF⁃β1刺激ATF模拟术后粘连的病理微环境,通过检测与胶原合成与降解相关的Ⅰ型胶原蛋白(COL⁃Ⅰ)、基质金属蛋白⁃1(MMP⁃1)与基质金属蛋白酶抑制剂⁃1(TIMP⁃1)表达水平,考察DSS对ATF细胞外基质的影响,以进一步探讨其分子药理学机制,为传统中药丹参在术后粘连防治领域中的应用提供更多理论依据。
1 材料与方法
1.1 药品与试剂 丹参素钠对照品(中国食品药品检定研究院),DMEM高糖培养基(吉诺生物医药技术有限公司),胎牛血清(Hyclone公司),0.25%胰酶(GIBCO公司),磷酸盐缓冲液(武汉博士德生物工程有限公司),Human TGF⁃β1(Invitrogen公司),CKK⁃8试剂盒(日本东仁化学),RNAprep试剂盒(TIANGEN公司),RT试剂盒(TAKARA公司),SYBR®Premix Ex TaqTM(TAKARA公司),Human COL⁃Ⅰ、MMP⁃1、TIMP⁃1 ELISA 试剂盒(CUSABIO BIOTECH公司)。
1.2 仪器 细胞培养板、培养皿与培养瓶(Cornig⁃Costar公司),HHB11500型电热恒温箱(广州医疗设备厂),DS⁃Ⅱ型电热三用水浴箱(北京市医疗设备厂),MCO⁃15AC型CO2培养箱(SANYO公司),SW⁃LG⁃1F超净台(苏净集团安泰公司),CKX⁃41型倒置显微镜(OLYMPUS公司),KDC⁃220HR高速冷冻离心机(科大创新股份有限公司中佳分公司),MiniOpticon型Real time PCR仪(BIO⁃RAD公司),ELx808酶标仪(BioTek公司),8道手动调节移液器(BIOHIT公司)。
1.3 方法
1.3.1 ATF的体外培养 取人体粘连组织,按照文献[6]方法进行ATF的原代培养,取第3~5代细胞进行实验。细胞培养条件:原代培养使用含20%胎牛血清的高糖DMEM培养基,传代后胎牛血清含量改为10%,温度37℃,CO2浓度5%,相对湿度95%。
1.3.2 CCK⁃8细胞活性实验 收集生长状态良好的ATF,经0.25%胰酶消化,以每孔5×103个的密度接种于96孔板,待细胞贴壁后,换成无血清培养基饥饿培养8 h,加入不同浓度TGF⁃β1(0、0.5、1、2.5、5、10、20、40、80 ng/mL),每个剂量组设6个复孔,培养24 h,移去原培养液后加入含10%CCK⁃8溶液100 μL,37 ℃,5%CO2培养箱中继续培养3 h,用酶标仪测定450 nm处吸光度值(OD值)。根据结果计算各组的细胞活性。细胞活性(viability)=用药组(OD值)/实验组(OD值)×100%。
按上述同样的方法接种ATF于96孔板,无血清培养基饥饿培养8 h后,加入10 ng/mL TGF⁃β1刺激6 h后,再加入不同浓度DSS(0、2.5、5、10、20、40、80、160 μmol/L),每个剂量组设6个复孔,培养48 h,按同法测定各组的细胞活性。
1.3.3 Real⁃time PCR实验 将ATF接种于直径6 cm培养皿,每皿细胞数1×106个,经贴壁、同步化处理后,分为空白组、模型组与DSS 2.5、10、40 μmol/L组。除空白组外,各组均按10 ng/mL剂量加入 TGF⁃β1,培养 6 h,DSS各组按2.5、10、40 μmol/L剂量加入丹参素钠,空白组与模型组加入等体积PBS,培养48 h。按试剂盒说明书进行操作,提取总RNA后逆转录为cDNA,置-20℃下冻存待用。根据NCBI提供的人体mRNA序列,用Prime Premier软件设计内参β⁃actin与目的基因COL⁃Ⅰ、MMP⁃1、TIMP⁃1的引物(表1),由上海英骏生物技术有限公司合成。按照SYBR®Premix Ex TaqTM中的25 μL体系进行Real time PCR检测,反应条件:95℃预变性30 s,95℃变性5 s,60℃退火/延伸30 s,40个循环。记录 CT值,采用2-ΔΔCT法计算各药物组相对于空白对照组的 MMP⁃1、TIMP⁃1 mRNA表达倍数F。F=2-[(待测目的基因平均CT值-待测内参平均CT值)-(对照目的基因平均CT值-对照内参平均CT值)]。
1.3.4 ELISA实验 收集各组细胞的培养上清液,按ELISA试剂盒上的说明书进行操作,检测上清液中COL⁃Ⅰ、MMP⁃1、TIMP⁃1的蛋白水平。
1.4 统计学方法 使用统计软件SPSS 16.0对实验数据进行方差齐性分析,各组间的差异采用单因素方差分析(One⁃way ANOVA),若方差齐性,组间差异比较采用LSD检验(Least⁃significant Differ⁃ence),方差不齐则采用Dunnett′s T3检验。
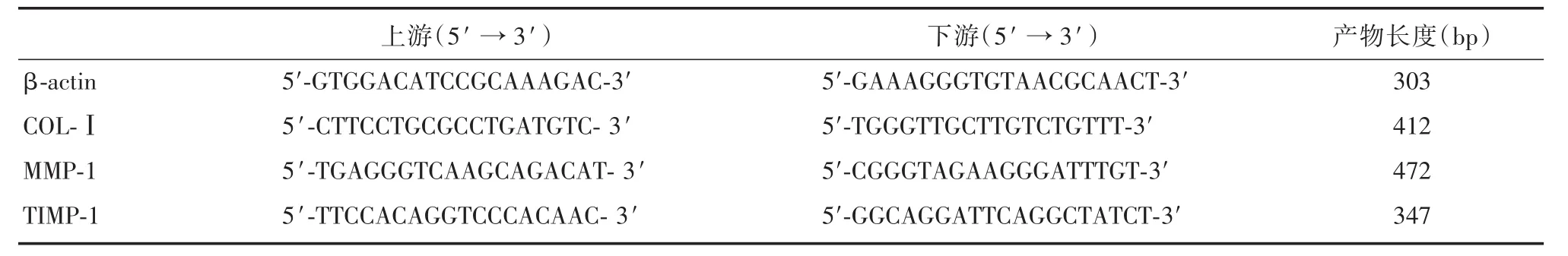
表1 Real⁃time PCR检测用引物序列Tab.1 Primers of Real⁃time PCR
2 结果
2.1 TGF⁃β1与DSS对ATF细胞活性的影响 不同剂量TGF⁃β1下的细胞活性如图1A所示,当浓度在5~10 ng/mL时细胞活性最高。在TGF⁃β1刺激下,DSS各剂量组的细胞活性如图2B所示,DSS 2.5、5、10、20、40 μmol/L 组与0 μmol/L 组相比,差异无统计学意义(P> 0.05),DSS 80、160 μmol/L组的细胞活性低于0 μmol/L组,差异有统计学意义(P< 0.01)。

图1 TGF⁃β1与DSS对细胞活性的影响Fig.1 Effects of TGF⁃β1 and Danshensu on fibroblast viability
2.2 DSS对ATF COL⁃Ⅰ、MMP⁃1、TIMP⁃1 mRNA表达的影响 各组ATF的COL⁃Ⅰ、MMP⁃1、TIMP⁃1 mRNA水平如图2A所示。One⁃way ANOVA结果显示,各组的COL⁃Ⅰ、TIMP⁃1 mRNA水平差异有统计学意义(P<0.01),MMP⁃1 mRNA水平差异无统计学意义(P>0.05)。LSD检验结果显示:与空白组比较,模型组、DSS 2.5 μmol/L 组的 COL⁃Ⅰ、TIMP⁃1 mRNA水平上调,差异有统计学意义(P<0.01),模型组与DSS 40 μmol/L组MMP⁃1 mRNA水平下调,差异有统计学意义(P<0.05);与模型组比较,DSS 2.5、10、40 μmol/L组的COL⁃Ⅰ mRNA水平下调,DSS 10、40 μmol/L组的TIMP⁃1 mRNA水平下调,差异有统计学意义(P<0.01,P<0.05)。
2.3 DSS对ATF COL⁃Ⅰ、MMP⁃1、TIMP⁃1 蛋白表达的影响 各组ATF的COL⁃Ⅰ、MMP⁃1、TIMP⁃1蛋白水平如图2B~2D所示。One⁃way ANOVA结果显示,各组ATF的COL⁃Ⅰ、MMP⁃1、TIMP⁃1蛋白水平差异有统计学意义(P<0.01,P<0.05)。LSD检验结果显示:与空白组比较,模型组的COL⁃Ⅰ、TIMP⁃1水平升高,MMP⁃1水平下降,DSS 2.5 μmol/L的COL⁃Ⅰ水平升高,DSS 2.5、10、40 μmol/L组的MMP⁃1水平下降,差异均有统计学意义(P<0.01);与模型组相比,DSS 10、40 μmol/L组COL⁃Ⅰ水平下降,DSS 2.5、10、40 μmol/L组TIMP⁃1水平下降,差异有统计学意义(P< 0.01);DSS 2.5、10、40 μmol/L组MMP⁃1水平升高,但差异无统计学意义(P>0.05)。
3 讨论
术后粘连的产生与各种细胞、细胞因子、趋化因子、缺氧、缺血等腹腔微环境的改变密切相关[6]。文献显示,迁移到腹膜损伤处的成纤维细胞在TGF⁃β的诱导下发生过度增殖,同时引起胶原等细胞外基质(extracellular matrix,ECM)过度沉积,最终形成不可逆的粘连[7],TGF⁃β在腹腔液中的过度表达可导致粘连发生率提高[8]。基质金属蛋白酶(matrix metalloproteinase,MMPs)是一类依赖于Zn2+的内肽酶,具有降解各种ECM成分的活性,其活性可被组织金属蛋白酶抑制剂(tissue me⁃talloproteinase inhibitors,TIMPs)抑制。两者在细胞迁移、细胞增殖、ECM沉积与降解中起重要调节作用。DIAMOND等[9]认为MMP⁃1水平升高与TIMP⁃1水平降低能促进ECM降解,从而减少粘连发生,若MMP⁃1水平抑制与TIMP⁃1水平升高则ECM沉积,导致粘连增加。本研究据此选取ECM代表性成分COL⁃Ⅰ以及与其沉积与降解相关的调节蛋白MMP⁃1与TIMP⁃1为检测指标,考察DSS对处于病理微环境下的ATF胶原合成与降解的影响。
本课题组在前期研究中将TGF⁃β1与人体ATF共培养,结果显示TGF⁃β1在一定剂量范围内可明显提高ATF的增殖活性与COL⁃Ⅰ合成水平[10]。本研究结果显示TGF⁃β1剂量在5~20 ng/mL时能提高ATF细胞活性,10 ng/mL TGF⁃β1可上调ATFCOL⁃Ⅰ、TIMP⁃1 mRNA 与蛋白水平,下调 MMP⁃1 mRNA与蛋白水平,表明该刺激剂量可模拟术后粘连形成的病理微环境,为本研究建立了体外模型。
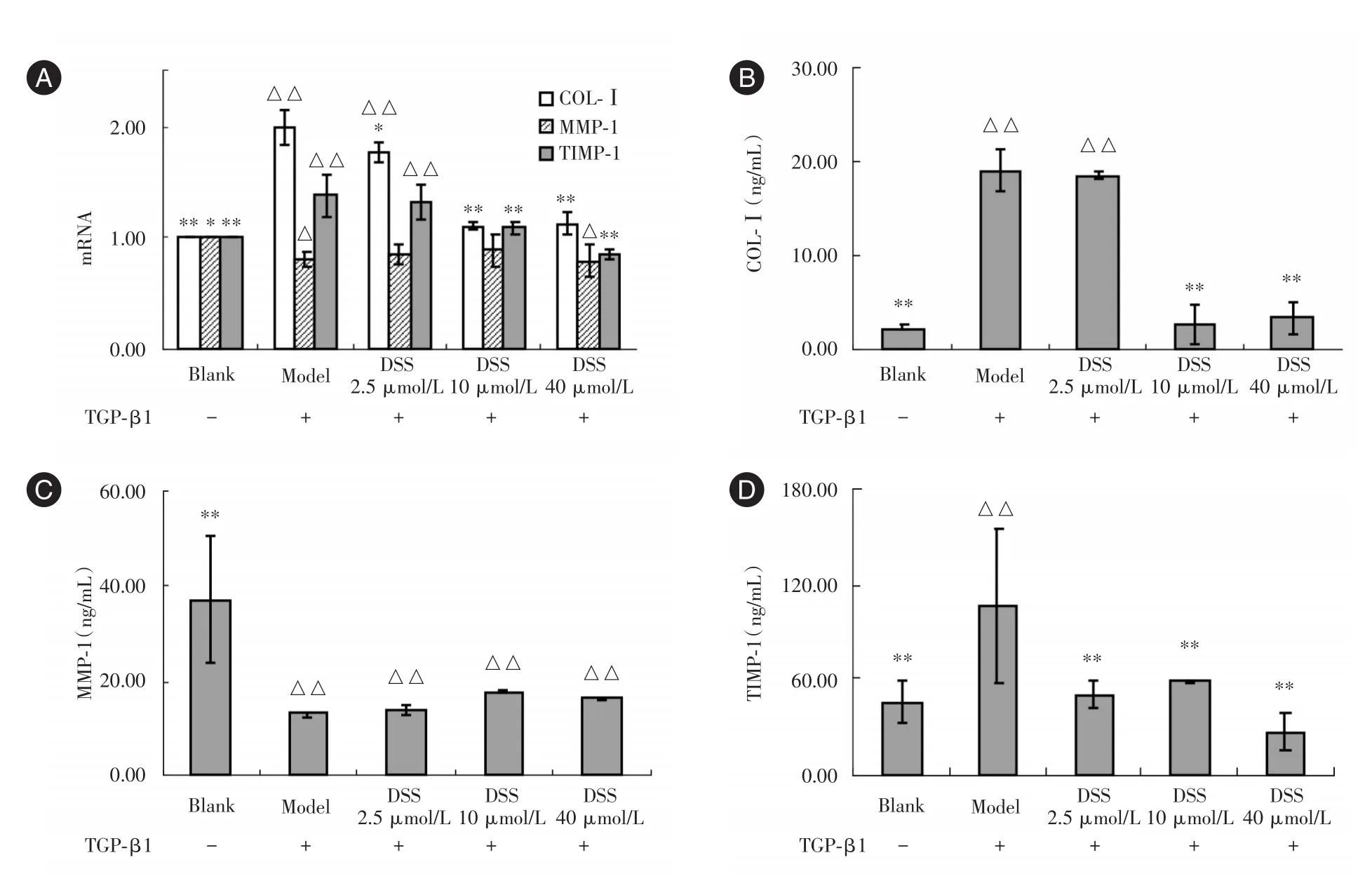
图2 各组COL⁃Ⅰ、MMP⁃1与TIMP⁃1的mRNA与蛋白表达Fig.2 COL⁃Ⅰ,MMP⁃1,TIMP⁃1 mRNA and protein expression in different groups
CCK⁃8实验结果显示DSS在2.5~ 40 μmol/L范围内不影响ATF细胞活性,据此选择2.5、10、40 μmol/L作为实验剂量,以保证在同一细胞数量水平上考察DSS对ATF的影响。Real⁃time PCR与ELISA结果显示DSS各剂量组COL⁃Ⅰ、TIMP⁃1 mRNA与蛋白表达水平低于模型组,同时DSS 10、40 μmol/L剂量组的COL⁃Ⅰ、TIMP⁃1表达水平与空白组无差异,提示DSS通过下调COL⁃Ⅰ表达抑制ATF胶原合成,下调TIMP⁃1表达促进ATF胶原降解,并将其COL⁃Ⅰ与TIMP⁃1恢复至无TGF⁃β1刺激的正常水平。本课题组的前期研究发现丹参另一个水溶性成分丹酚酸B对ATF也有类似作用:下调COL⁃Ⅰ、Fibronectin表达,同时促进MMP⁃9表达、降低TIMP⁃1活性,调节细胞外基质降解平衡[11]。丹酚酸B由3分子DSS与1分子咖啡酸缩合而成,结合本研究结果分析,丹酚酸B可能通过其水解产物DSS发挥对ATF胶原合成与降解的调控作用。
VERRECCHIA 等[12]发现 COL⁃Ⅰ、COL⁃Ⅲ、COL⁃Ⅴ等基因的表达受TGF⁃β/Smad3通路调控。近年的研究显示,DSS可干扰TGF⁃β/Smad3信号通路,抑制缺氧诱导的肺动脉平滑肌细胞增殖[13];通过下调肝星形细胞TβRⅠ、TβRⅡ蛋白的表达,抑制其活化增殖,同时上调Smad7 mRNA表达,下调Smad2、Smad3 mRNA表达,抑制TGF⁃β诱导的肝星形细胞活化[14];DSS还能减弱高糖刺激下腹膜间皮细胞COL⁃Ⅰ与fibronectin的蛋白与mRNA表达[15]。根据上述文献以及本研究结果,笔者推测DSS通过调控ATF TGF⁃β/Smads信号转导,降低ATF细胞外基质的过度沉积,从而减少粘连产生。今后我们将继续考察DSS、丹酚酸B等丹参主要化学成分对TGF⁃β信号通路的影响,为阐明丹参防治术后粘连的分子药理学机制提供更多理论依据。

