小鼠骨髓间充质干细胞移植途径对肝硬化治疗效果的比较
王 敏, 胡 皓, 韩 英
1.上海市儿童医院,上海 200062;2.复旦大学附属中山医院内镜中心;3.空军军医大学西京消化病医院
肝硬化是由于不同病因长期作用而引起肝脏慢性、弥漫性改变[1]。每年因各种原因所致肝硬化死亡人数高达50万[2]。肝硬化作为肝脏病发展的终末阶段,目前临床上广泛采用的治疗策略是保护残存肝细胞及对症治疗,但总体疗效欠佳[3]。干细胞因其具有多向分化能力、免疫调节能力,可以通过定向分化成肝细胞、旁分泌免疫调节因子等作用改善肝功能[4]。实验研究和临床试验[5-6]证实,干细胞治疗可减轻肝硬化程度,改善终末期肝病患者肝功能,因而逐渐成为肝硬化及终末期肝病治疗的新选择。目前报道的干细胞移植途径主要有外周静脉、肝门静脉、腹腔等[7]。以往研究主要将干细胞治疗机制及效果作为评价内容,而对于决定干细胞定植及治疗效果非常重要的干细胞移植途径的因素[8]却少有报道。本实验在小鼠肝硬化模型上,对比外周静脉、门静脉及腹腔三种移植途径移植骨髓间充质干细胞(mesenchymal stem cells,MSCs)治疗肝硬化的效果,通过定植细胞数量、组织学及肝功能比较,评价三种移植方式的优劣。为干细胞治疗终末期肝病的最优移植途径提供理论依据。
1 材料与方法
1.1实验动物及试剂、仪器设备4周龄雄性C57BL/6小鼠、C57BL/6-GFP+转基因小鼠由空军军医大学实验动物中心提供[生产许可证:SCXK(军)2007-007]。CCl4、天狼星红购自Sigma公司,小鼠MSCs培养基、成骨诱导培养基、成软骨诱导培养基购自广州塞业生物技术有限公司,胎牛血清DMEM/F12、胎牛血清购自Gibco公司,流式鉴定抗体购自Biolegend公司,流式细胞仪购自BD公司,荧光显微镜购自Olympus公司。
1.2MSCs分离及培养脱颈处死C57BL/6-GFP+小鼠,用质量浓度为750 g/L的乙醇浸泡消毒;超净台中取胫腓骨,剥离肌肉和结缔组织,剪断股骨胫骨两端,用1 ml注射器冲出骨髓,经70 μm细胞筛网后于4 ℃离心,离心率弃去上清,加入2 ml红细胞裂解液裂解红细胞,D-PBS液混匀终止裂解红细胞;离心重悬,加骨髓MSCs完全培养基,接种于25 cm2培养瓶中,孵箱中培养。绝对静置3 d后首次换液,洗去未贴壁的细胞;之后隔天换液至第3代行流式细胞表面标志物鉴定及成骨成脂诱导分化实验。
1.3MSCs流式鉴定及定向分化
1.3.1 流式鉴定:将第3代MSCs消化、重悬为单细胞悬液并计数,PBS重悬为107ml-1的细胞悬液。EP管中加入上述制备的悬液100 μl。分别加入流式抗体PE-CD90、FITC-CD29、PE-CD44、PE-CD34、FITC-CD45、PE-CD31,反复吹打,充分混合,室温避光孵育、清洗后上机检测。
1.3.2 成骨诱导:明胶铺板,晾干备用;将第3代MSCs消化接种于明胶板,加入适量成骨诱导分化培养基培养。每3 d更换诱导培养基,当光镜下可见大量钙结节时,换为每2 d进行1次半量换液;约4周后诱导完成。质量浓度为40 g/L的多聚甲醛固定,茜素红染液染色观察。
1.3.3 成脂诱导:将第3代MSCs加入骨髓MSCs成脂诱导分化培养基A液,诱导3 d后,加入骨髓MSCs成脂诱导分化培养基B液。诱导24 h后,换回A液继续诱导;如此交替5次。直至脂滴足够大和圆。质量浓度为40 g/L的多聚甲醛固定,油红O染色观察。
1.3.4 成软骨诱导:将2.5×105第3代MSCs放入15 ml离心管,加入成软骨诱导分化培养基(D-MEM培养基加入地塞米松、抗坏血酸、ITS添加物、丙酮酸钠、脯氨酸及TGF-β3),24 h内不要晃动。24~48 h后即可在离心管管底形成细胞小球。隔天换液1次,连续诱导4周。包埋固定切片后甲苯胺蓝染色观察。
1.4肝硬化模型构建选取50只6周龄雄性C57BL/6小鼠行肝硬化造模实验。采用CCl4诱导法。将CCl4溶于橄榄油中配制成诱导剂,诱导剂浓度按照第1周为13%、第2周为16%、第3周开始为20%直至造模结束。每周行2次腹腔注射,造模时间共计8周。注射剂量为7 ml/kg。另取同窝小鼠10只为对照,给予7 ml/kg橄榄油,注射时间周期与造模组相同。
1.5MSCs移植造模后C57BL/6小鼠随机分为4组,分别为未移植组、尾静脉移植(IV)组、门静脉移植(PV)组、腹腔移植(IP)组。各组移植MSCs细胞数为1×106。周围静脉移植组采用尾静脉注射法,缓慢注射。IP组采用腹腔注射法,于小鼠下腹部腹白线向左5 mm 注射。PV组:麻醉小鼠后在腹中部开口1~2 cm,将肠管右移充分暴露门静脉,穿刺门静脉缓慢注射细胞,拔出针头后用棉签轻压5~10 min以防渗血,将肠管复位后关腹缝合。移植后3 d冰冻切片行定植细胞分析,采用Image Pro Plus 6.0统计[9]。
1.6组织学分析及生化检测小鼠肝脏组织用质量浓度为100 g/L的甲醛固定,石蜡包埋行HE染色及天狼星染色。观察肝内结构及纤维沉积情况。小鼠心脏取血,行全自动生化分析。

2 结果
2.1MSCs的培养及分化鉴定光镜下MSCs呈长梭样生长,形态均一,成平行或漩涡状生长。取第3代细胞行细胞定向分化。成骨诱导分化4周后,茜素红染色可见细胞内大量钙结节沉积。成脂诱导3周后,油红O染色可见细胞胞质内红色圆形脂滴。成软骨诱导分化4周后,可见细胞内酸性黏多糖被成甲苯胺蓝染成淡蓝色(见图1A~1C)。
取3代细胞行流式分析,细胞表面分子特征为:MSCs表面分子CD90、CD44、CD29高表达,而造血干细胞表面分子CD34、CD45阴性,内皮细胞表面分子CD31阴性。提示MSCs分离效果良好(见图1D)。
2.2肝硬化大鼠模型构建8周后,50只C57BL/6造模小鼠存活43只,死亡7只,存活率86%。存活小鼠毛色无光,体质量较对照组轻[(21.38±3.34)gvs(25.4±3.34)g,P<0.001)]。随机取其中3只小鼠处死后行大体及病理学观察发现,正常小鼠肝脏颜色红润,表面光滑,边角锐利,质地柔软,无细颗粒样隆起。而造模组肝脏颜色灰暗,质地较硬,体积缩小,表面分布大小不等的细颗粒样结节(见图2C、2F)。HE组织学发现,造模后小鼠肝脏肝小叶结构破坏,炎性细胞浸润,假小叶形成。干细胞疏松,细胞内脂肪变,部分细胞变性坏死(见图2A、2D)。天狼星染色可见造模后肝内红染的纤维条索增多,粗细不等,假小叶形成(见图2B、2E)。模型小鼠肝脏呈现典型的肝硬化病理表现。

图1 MSCs鉴定和诱导分化 A:成骨诱导(100×);B:成脂诱导(100×);C:成软骨诱导(40×);D:流式细胞鉴定
2.3移植MSCs肝内定植情况分析将40只小鼠随机分成4组,分别接受尾静脉移植、腹腔移植、门静脉移植。移植3 d后,各组处死3只小鼠,取肝脏,冰冻切片制片,DAPI染色后行荧光显微镜观察,并计算GFP+细胞所占比例。发现,肝脏中绝大多数移植的干细胞主要集中在小叶间的汇管区,只有少数细胞转移至肝小叶的中央。GFP+定植分析显示,IV组阳性细胞比例为(4.65±0.68)%,IP组为(4.88±0.23)%,PV组为(5.04±0.77)%。提示这三种移植途径MSCs肝内定植数差异无统计学意义(P>0.05,见图3)。
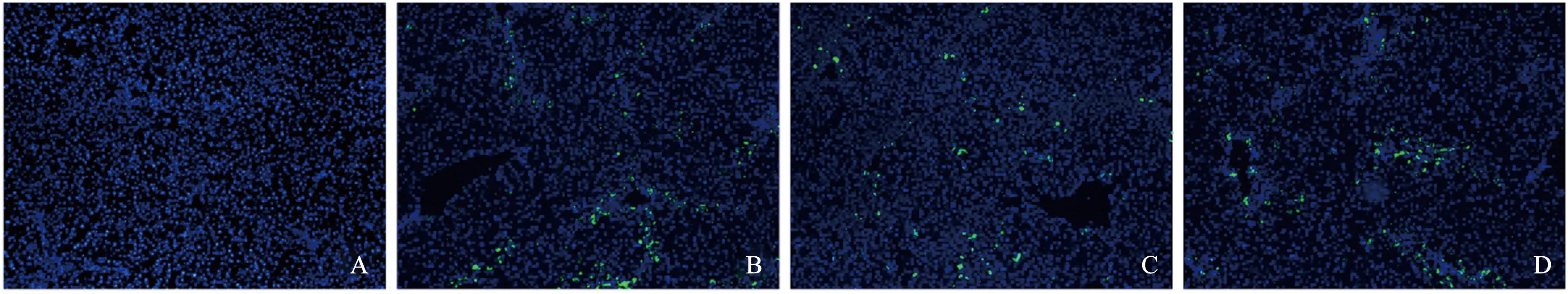
图3 GFP+ MSCs肝内定植(100×) A:对照组;B:IV组;C:IP组;D:PV组Fig 3 Distribution of GFP+ MSCs in liver (100×) A: control group; B: IV group; C: IP group; D: PV group
2.4移植后疗效评价2周治疗结束后,可见不同途径移植MSCs小鼠精神、食欲均有所增加。肝脏外观颗粒样变化改善,而未移植干细胞组仍呈典型的肝硬化外观。组织学上MSCs移植后肝内假小叶数量减少,炎症减轻。坏死肝细胞数量、浸润炎症细胞数据均有减少。天狼星染色发现,肝内纤维束减少变细,组织结构恢复,纤维化改善。但从组织学上看,三种不同移植途径的肝脏改善未见明显区别(见图4)。
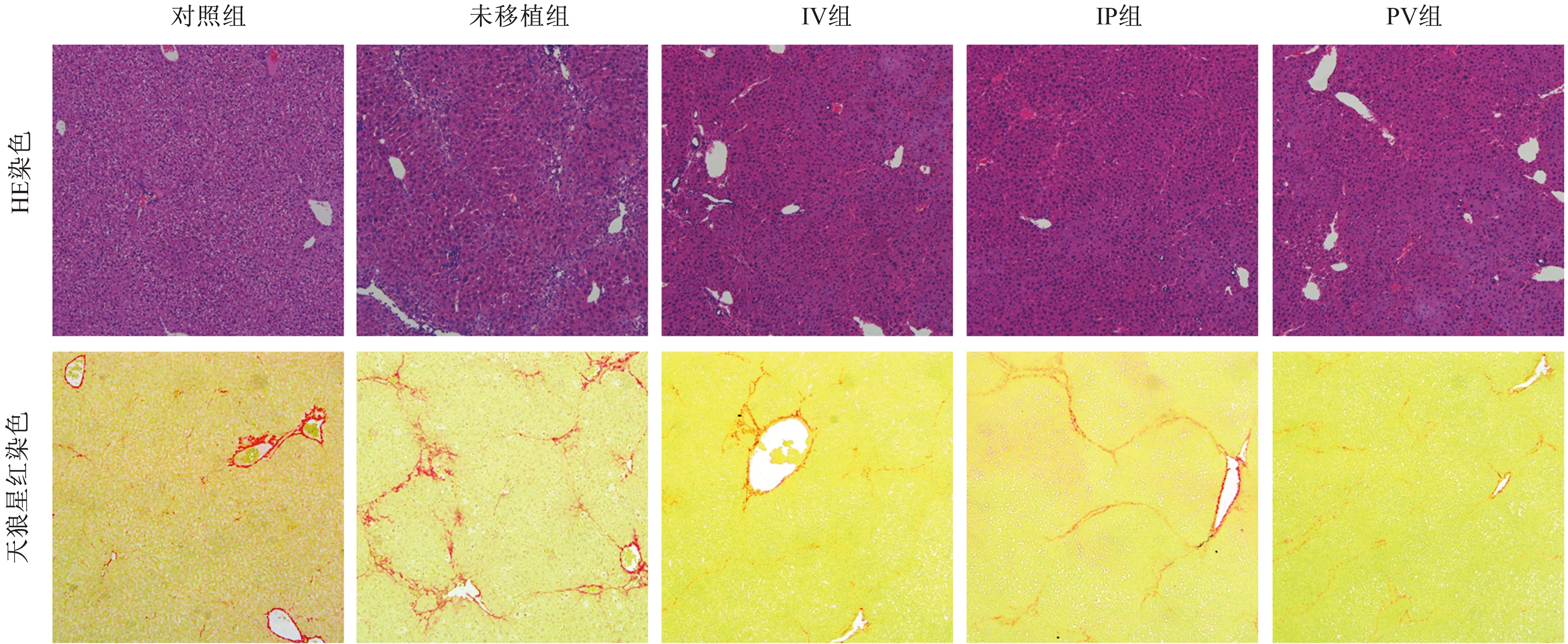
图4 MSCs移植后肝脏组织学比较(100×)Fig 4 Histology study of liver after MSCs transplantation (100×)
2.5移植后血清ALT、AST、ABL比较为进一步比较不同MSCs移植后对肝功能的恢复情况,我们取血对肝脏谷丙转氨酶(ALT)、谷草转氨酶(AST)及白蛋白(ALB)合成水平进行分析。三种移植途径相对于未移植组ALT(586.9±27.29)U/L水平显著降低。其中IV组(215.7±60.42)U/L(P<0.001)、PV组(232.5±82.0)U/L(P<0.001)、IP组(225.2±58.8)U/L(P<0.001);相较于未移植组AST(667.9±75.85)U/L,三种移植途径AST水平明显下降,IV组(342.3±89.24)U/L(P<0.001)、PV组(379.4±61.57)U/L(P<0.01)、IP组(367.4±58.62)U/L(P<0.01)。同时,移植组ALB合成能力与未移植组(14.95±1.19)g/L相比显著增强,其中IV组(21.15±1.68)g/L(P<0.01)、PV组(20.25±2.62)g/L(P<0.05)、IP组(21.07±1.02)g/L(P<0.01)。统计分析同时也发现,三种不同的移植途径组间差异无显著统计学意义(P>0.05,见图5)。
3 讨论
肝硬化是我国常见病,传统保肝为主的治疗方法对终末期肝硬化治疗效果有限。肝移植手术虽可以达到良好的效果,但因供体缺乏、手术费高昂、需服用免疫排斥药物等使得肝移植开展受限[10]。干细胞移植治疗肝硬化近十年来发展很快,国内外研究及应用报道不断增多。干细胞治疗终末期肝病的有效性已被证实,同时干细胞治疗具有免疫原性小、费用低的优点[11-13]。

注:**P<0.01;***P<0.001;ns:P>0.05。图5 MSCs移植后血清ALT、AST、ALB比较Fig 5 Comparison of ALT, AST and ALB after MSCs transplantation
然而对于影响干细胞定植的关键因素,细胞移植途径对肝硬化治疗效果的影响却鲜有报道。
在治疗终末期肝病的研究中使用的MSCs移植途径主要有:外周静脉(尾静脉)、门静脉、腹腔等方式,各方法均有特点。如外周静脉法(动物主要采用尾静脉注射):这种移植方式临床及动物研究报道最多,移植操作简单,不需要手术,对设备仪器要求低。但存在肺栓塞危险、肺脏定植细胞较多等问题。门静脉法:因肝脏供血主要来自门静脉,为MSCs治疗肝脏病特有的途径。但该方法操作复杂,需要手术,也有肺栓塞危险。腹腔注射法与前两者不同,它的优势主要是操作简单,移植细胞数相对较多,不会发生肺栓塞等危险。最近在炎症性肠病研究[14-15]中发现,腹腔移植法较静脉移植法有明显的优势。因此,我们选取了上述三种移植途径进行了比较。
我们的研究发现,虽然三种细胞移植途径不同,然而,在相同MSCs移植数量条件下,无论从组织学还是血清学变化,三种移植途径的治疗效果并没有明显差异。该研究结果与我们研究前的设想及我们既往在炎症性肠病上的研究结果[14]不同。我们分析可能的原因有:(1)定植于肝脏的MSCs细胞数目基本相同。我们在移植后第3天对定植于肝脏的MSCs数目进行了比较,发现各移植途径间无明显差异。因而在肝脏部位发挥作用的干细胞生物学效应基本一致。我们实验前曾预想“门静脉定植细胞最多,腹腔移植定位最少”,因为肝脏血供约75%来自门静脉,而腹腔由于迁移路径限制,到达肝脏的肝细胞数量不多[16]。然而结果与我们的设想并不相同。MSCs的迁移与炎症部位释放的趋化因子相关[17]。可见MSCs的定植数量与肝脏本身的炎症程度相关,与移植途径关系并不密切;(2)除定植于肝脏的MSCs外,还有大量的MSCs定植于肝外部位,这些部位的干细胞通过旁分泌作用,分泌多种细胞因子,通过血液途径到达肝脏,发挥调节和治疗作用。而这类旁分泌作用不同移植途径对其影响不大;(3)肝硬化的严重程度与MSCs治疗剂量间的关系。如果肝硬化逆转所需的最低MSCs数量远小于输入数量MSCs所能及的最低疗效,那么三种治疗途径的优劣不能显现出来。因此,在今后的实验中,我们还将对不同MSCs移植数量、不同肝硬化轻重程度的条件下研究移植途径对于MSCs治疗肝硬化疗效的影响。
虽然MSCs具有定向分化为其他终末期细胞的能力,但是目前多数研究[14,18-20]认为,MSCs发挥作用的模式为“hit and run”模式,多数MSCs会在48~72 h死亡或被清除出体内。这与我们实验中观察到的一致,移植后3 d我们尚能在肝脏观察到部分GFP+MSCs定植,但7 d后肝脏已无GFP+MSCs定植(数据未展示)。因此,我们认为,MSCs治疗肝硬化的机制可能主要是通过旁分泌作用分泌大量抗炎因子和免疫调节因子,减轻炎症反应,抑制炎性细胞,促进肝细胞再生修复而发挥作用的[21]。而非定向分化成终末肝细胞起作用的。
虽然三种移植途径并未见明显的治疗差异,但综合MSCs治疗肝硬化的可能机制及各移植途径的优缺点,我们初步认为,腹腔注射法最有发展前景。因其操作最简单、方便;同时不易发生肺栓塞,危险性小;细胞移植数量上可选的安全范围大,可移植较多数量细胞;腹腔内小血管密布,便于干细胞发挥旁分泌作用;同时,MSCs可在腹腔内与炎症细胞形成“细胞小体”(aggregates),可进一步增强其旁分泌和免疫调节作用[22]。然而以上结论仍需深入的基础和临床研究验证,方可得出科学结论。

