山药花青素合成关键酶基因的解析
殷剑美,王 立,张培通,韩晓勇
(江苏省农业科学院 经济作物研究所,江苏 南京 210014)
花青素是自然界一类广泛存在于植物中的水溶性天然色素,它不仅可以使花朵和果实呈现鲜艳的颜色而具有观赏价值,有利于吸引昆虫和食草动物协助传粉和种子传播,还有助于提高抗逆性,如抵御低温和紫外线伤害,以及防治植物病害[1-2],同时还是迄今为止发现的最强效的自由基清除剂,具有抗氧化衰老、抗突变、抗癌与抗动脉硬化等功能,对人体有保健功能[3-4]。
花青素是植物次生代谢的重要产物之一,其生物合成涉及多个酶,如苯丙氨酸裂解酶(PAL)、黄烷酮3-羟基化酶(F3H)、二氢黄酮醇4-还原酶(DFR)、花青素合成酶(ANS)和黄酮3-O-葡萄糖基转移酶(UFGT),而这些酶各自因物种不同而成为主导花青素形成的关键酶。研究表明,F3H、DFR、ANS和UFGT分别是金鱼草、矮牵牛、石竹和葡萄的关键酶基因[5-6]。目前大多数的研究集中在地上器官和组织中花青素方面,而对地下器官花青素的研究较少。
山药作为药食两用的植物,其营养价值、药用价值及抗病机理正逐步被发现和证实,并愈来愈受到广大消费者的青睐,具有十分广阔的市场前景[7]。紫山药(DioscoreaalataL.)是天然紫色山药品种,富含花青素,在南非和中国南部的栽培面积很广[8];紫山药皮可作为提取紫色素的来源[9];作为一种新型的天然色素资源,紫山药在食品、化妆品及医药等行业中也将具有广阔的应用前景。因此对山药花青素的研究不仅具有重要的理论意义,还具有较好的实用价值。
我们在前人研究的基础上,以紫肉山药和白肉山药为试验材料,分析了花青素合成基因在两者之间的表达差异,以期找出紫山药花青素合成的关键基因,为进一步研究紫山药花青素合成途径中各个基因的调控机理提供理论依据和技术支持。
1 材料与方法
1.1 试材及取样
供试材料为紫山药品种“Yzi006”(紫肉)和白山药品种“Ybai002”(白肉)。于2013年4月2日将它们种植于江苏省农业科学院(南京)实验基地,于4月26日出苗。在出苗后第50天分别取幼叶、成熟叶、幼茎和成熟茎;于出苗后第50、65、80天(块茎膨大初期),第95、110、125天(块茎膨大盛期),第140、155、170天(块茎膨大后期),以及第185天(块茎膨大末期)分别取地下块茎,所取样品用液氮速冻后,保存于-70 ℃备用;每份样品均取样3次,作为重复。山药生育期的划分参考黄文华[10]和殷剑美等[11]的方法。
1.2 克隆及测序
RNA提取和cDNA第一条链的合成参照Valderrama-Cháirez等[12]的方法(本文略加改进)。
根据NCBI (http://www.ncbi.nlm.nih.gov/)数据库中Actin-2、PAL、F3H、DFR、ANS、UFGT基因序列在山药基因组EST数据库中的比对结果,用Primer 5软件设计PCR引物(表1),进行扩增。PCR反应条件为:94 ℃预变性10 min;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 90 s,32个循环;72 ℃延伸10 min。引物由北京鼎国昌盛生物技术有限责任公司合成。PCR扩增产物用凝胶回收试剂盒回收,与pMD18-T载体在16 ℃下连接过夜,通过DH5α转化克隆,挑选阳性克隆菌液送交南京金斯瑞生物科技有限公司测序。
1.3 实时荧光定量PCR
在NCBI中,使用Blastn软件进行序列比对,在确定目的片段为山药中相关基因的核苷酸序列片段后,用Beacon Designer 7软件分别设计了各基因的荧光定量PCR引物(表1)。对不同组织中各个基因的实时定量检测分析在ABI7500 Real Time PCR仪(由美国应用生物系统公司生产)上完成。
1.4 花青素含量的测定
花青素含量的测定参考Merthens[13]的方法。将0.1 g新鲜组织材料切碎,加入6 mL提取液(浓盐酸∶80%乙醇=1∶99, v/v)浸提10 h。花青素含量的计算公式为:Q=(A530-0.25×A657)/FW,式中Q为花青素相对含量;FW为样品鲜重(g)。
花青素相对积累量的计算公式为:An=Qn×FMn,式中:An为花青素相对积累量;n为样品取样时间;Qn为花青素含量;FMn为1株的块茎鲜重(g)。花青素积累速率的计算公式为:R=(An-An-1)/D,式中D为2次取样的间隔天数[14]。
2 结果与分析
2.1 Yzi006和Ybai002不同组织器官中花青素含量的比较
Yzi006的幼叶、茎和块茎均呈紫色,成熟叶为绿色;Ybai002的幼叶、成熟叶和茎均为绿色,块茎为白色(图1A)。对以上组织器官中的花青素含量分别进行测定,从图1B可以看出: Yzi006幼叶和早期块茎中的花青素含量明显高于成熟叶和后期块茎中的,而茎中花青素含量变化不明显,且叶片、茎和块茎中花青素的含量均随着生长发育的推进而逐渐下降; Ybai002各个组织器官中花青素含量很低且基本保持不变。
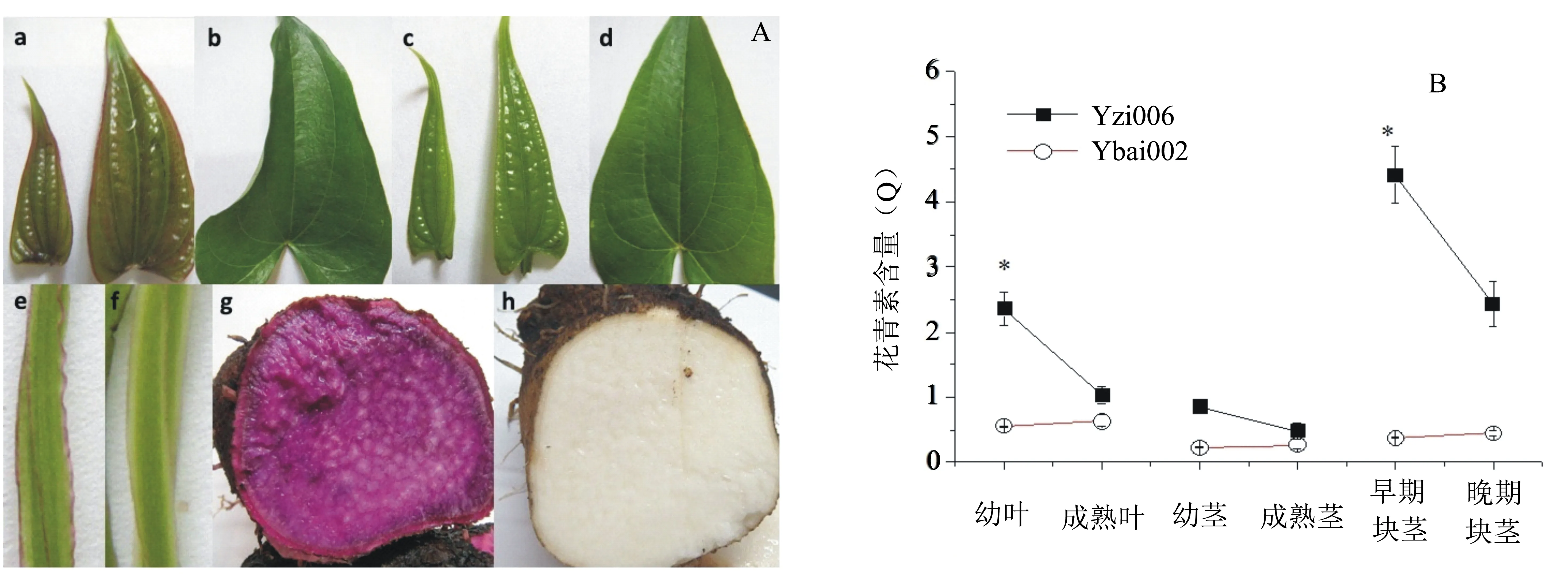
a:紫山药幼叶; b:紫山药成熟叶; c:白山药幼叶; d:白山药成熟叶; e:紫山药茎; f:白山药茎; g:紫山药块茎; h:白山药块茎。
2.2 Yzi006和Ybai002不同组织器官中花青素合成基因的表达水平
对山药叶、茎及不同生长期块茎中花青素合成基因PAL、F3H、DFR、ANS、UFGT的表达水平进行了分析,结果如图2所示。除了DFR基因外,其他基因在山药幼嫩组织中的表达水平更高。PAL在Yzi006叶、茎和块茎中的表达水平高于Ybai002相应组织器官中的,并且在茎中的表达水平远远高于在叶中的表达水平。F3H在叶和茎中的表达水平相同,但是在Yzi006块茎中的表达水平要高于在Ybai002块茎中的表达水平。值得注意的是,DFR在成熟叶中的表达水平要远远高于在幼叶和茎中的表达水平,且该基因在Yzi006块茎中的表达水平高于在Ybai002块茎中的表达水平。ANS和UFGT在叶、茎和块茎中的表达趋势相同,均在Yzi006幼叶和块茎膨大早期高度表达,而在Ybai002对应组织器官和其他组织器官中的表达水平很低。总之,PAL、F3H、DFR、ANS、UFGT在Yzi006块茎中的表达水平较高。
2.3 Yzi006块茎中花青素的积累
由图3可见: Yzi006块茎从开始形成时,块茎鲜重就一直持续增加,块茎中花青素的积累有两个高峰期,中间有一个缓慢增长期,呈一个典型的双“S”增长曲线。具体而言:第一个快速积累期在块茎膨大盛期,此时花青素含量达到最高;第二个快速积累期在块茎膨大后期,此时块茎鲜重增加速度最高;花青素含量在块茎膨大初期开始下降,在块茎膨大盛期有所回升,并且花青素积累量迅速升高;进入块茎膨大后期后,块茎重量快速增加,花青素含量持续下降,导致花青素进入缓慢积累阶段;到达块茎膨大末期时,块茎停止生长,花青素含量略有回升,花青素积累量趋于最高。
2.4 Yzi006块茎中花青素积累量、积累速率与花青素合成相关基因表达水平间的关系
对紫山药块茎中花青素积累量、积累速率和花青素合成相关基因的表达水平进行综合分析(表2),发现各个基因的表达水平与花青素积累速率存在协同性。PAL、F3H、DFR、ANS、UFGT在第50~110天内极显著性高度表达的同时,紫山药块茎中花青素积累速率快速升高,在第125天积累速度达到最大值31.37/(株·d),存在极显著性差异;当ANS、UFGT基因表达水平分别在第125、140、155天显著性回升后,花青素积累速率再次显著性升高,在第155天达到第2个高峰,积累速率最快为15.87/(株·d)。由此可见,花青素合成基因PAL、DFR、ANS、UFGT的表达水平均与紫山药块茎中花青素积累存在明显的相关性。
3 讨论
由于花青素通常贮藏于花、叶、茎等器官中,所以,在蛋白质和基因水平上研究花青素合成酶及其相关基因的报道多出自这些器官,而对植物地下器官尤其是块茎中花青素合成酶及其相关基因的研究还不多。薯芋块茎类植物花青素生物合成的调控方式与植物花、果实等地上器官中的情形很可能不同,有可能存在一种全新的花青素合成与调控机制,因此对山药花青素合成代谢的相关研究,不仅对进一步明确花青素合成调控机理具有重要意义,对于严重缺乏科研资料背景的山药作物本身更是意义非凡。

“*”和“**”分别表示差异达显著(P<0.05)和极显著(P<0.01)水平。

图3 Yzi006块茎重量、块茎中花青素含量和积累量的变化
由于木质素和茎木质化的原因,PAL在甘蔗幼茎中的表达量要远远高于叶中的表达量,且PAL在茎中的表达水平与茎的发育速度呈正相关,因此Kolahi等推测PAL对甘蔗茎的木质化具有重要作用[15]。本研究也发现PAL在山药茎中的表达水平要高于叶中的。Sun等[16]发现F3H在红色花系和白色花系的瓜叶菊中均有表达,因此指出F3H不是瓜叶菊花青素合成途径中的关键基因。这与本研究中F3H在紫山药和白山药中的表达情况相同。因此,PAL和F3H的表达水平对紫山药块茎中花青素含量和积累量虽具有相关性,但这2个基因不是调控紫山药花青素合成的关键点。
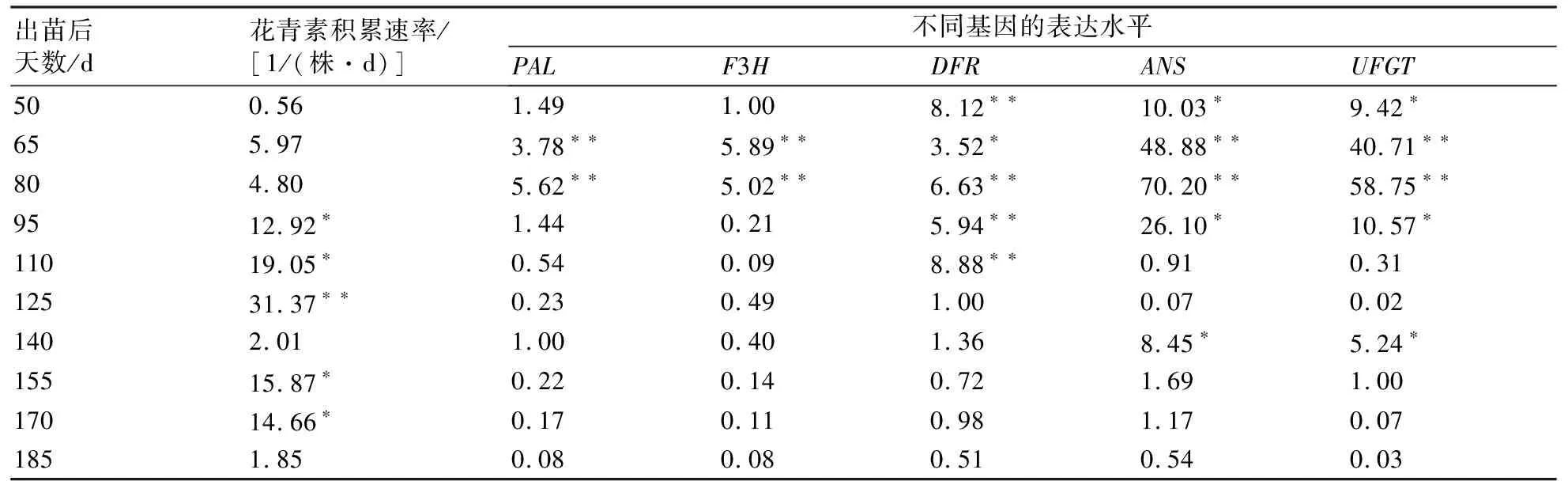
表2 紫山药块茎发育过程中花青素积累速率与相关基因表达水平间的关系
注:同列数据后附“*”代表P<0.05,差异显著;“**”代表P<0.01,差异极显著。
DFR不仅参与花青素的合成,同时也产生缩合单宁的诱导性底物[17]。Liu等[18]检测到高粱中SbDFR1基因参与了合成花青素,SbDFR3基因合成3-脱氧花青素起到植物胁迫反向的补偿作用[19]; Cheng等[20]成功克隆了岛银杏中DFR基因的3个拷贝,并发现GbDFR1和GbDFR2的主要作用是参与植物防护机制,抵御伤害、胁迫以及外源激素的刺激,而GbDFR3的职责主要是合成花青素。在本研究中,DFR基因在功能叶中的表达水平比在幼叶和茎中高,并且在白山药中的表达水平高于紫山药中的,有可能是因为白山药叶片中需要DFR合成更多的缩合单宁来抵御UV-B以及虫害等伤害。
周生茂等[21]从田薯地下块茎中分离到1个ANS基因(DaANS1),并发现其表达模式与ANS酶活性和花青素含量在块茎中的变化具有协同性;而Afifi等[22]和Piero等[23]分别报道在葡萄藤和甜橙中UFGT与花青素的合成具有重要关联性,而ANS与花青素合成的关联性不大。本研究发现,ANS和UFGT均在紫山药幼叶及块茎形成早期高度表达,而在白山药中低表达或不表达,推测ANS和UFGT可能是导致紫山药和白山药颜色差异的关键基因。
Yzi006块茎中花青素的积累速率存在两个高峰值,第一个较高的峰值出现在块茎膨大盛期,第二个较低的峰值出现在块茎膨大后期;PAL和F3H基因的表达水平只在块茎膨大初期最高,DFR从块茎膨大初期开始到盛期结束一直持续较高的表达水平,ANS和UFGT在块茎膨大初期的表达水平最高,之后下降,而在块茎膨大盛期和第二个花青素积累速率达到高峰前再次上升,推测DFR、ANS和UFGT对块茎膨大初期和后期花青素的积累具有重要作用,而PAL和F3H只对块茎膨大初期花青素的积累具有影响。综上所述,推测紫山药花青素合成的关键基因可能是ANS和UFGT或是两者之一,其表达模式还需进一步研究。

