PrGV多角体膜蛋白(PEP)的分析
黄海剑,张宝琴1,
(1海南大学 热带农林学院,海南 海口 570228;2浙江大学 昆虫科学研究所,浙江 杭州 310058)
杆状病毒(baculovirus)是一类含有囊膜结构的双链环状DNA病毒,是目前发现最早、研究最多的昆虫病毒,在害虫生物防治中发挥着重要的作用[1]。杆状病毒根据其包涵体形态可分为核型多角体病毒(Nucleopolyhedrovirus,NPV)和颗粒体病毒(Granuclovirus,GV),其中GV病毒的包涵体呈椭圆形的颗粒状,常常只包埋单个病毒粒子,可以在环境中长期稳定存在[2]。近年来,随着杆状病毒基因组测序的完成,越来越多的研究者从分子水平揭示了病毒编码蛋白的功能,为病毒的合理利用提供了理论指导。
菜粉蝶颗粒体病毒(PierisrapaeGranulovirus,PrGV)属于杆状病毒科颗粒体病毒属,是一类特异侵染菜粉蝶的GV病毒,其宿主菜粉蝶(Pierisrapae)属鳞翅目,幼虫称菜青虫,严重危害甘蓝、萝卜、花菜等十字花科作物,影响蔬菜的产量和品质[3]。PrGV基因组大小为108 592 bp,预测编码框为120个,占整个基因组的91%[4]。蛋白同源性比对发现,有33个PrGV基因只存在于GV基因组,但在NPV基因组并不存在,这其中包括1个编码多角体膜蛋白(polyhedron envelope protein,PEP)的ORF20[5]。有研究表明,PEP是颗粒体囊膜蛋白成分之一,可能参与颗粒体的形成[6-7]。然而,关于该蛋白在病毒侵染、组装、扩散等生命过程中的作用尚不清楚。
本研究对PrGV PEP进行原核表达,并制备了该蛋白的多克隆抗体,通过表达时相分析、免疫标记、细胞定位等手段对PrGV PEP进行深入研究,旨在为进一步了解PrGV的生物学特性奠定基础。
1 材料与方法
1.1 材 料
1.1.1 菜青虫饲养 试验用菜青虫和甘蓝植株采自浙江大学紫金港校区,并在人工气候环境下饲养,饲养温度控制在(26±0.5) ℃,相对湿度控制在(50±5)%,光周期(白天/黑夜)为16 h/8 h。
1.1.2 PrGV病毒 PrGV纯病毒由浙江大学昆虫科学研究所分子昆虫研究室提供。取新鲜的甘蓝叶片,裁成1 mm×2 mm的碎片,将含有PrGV病毒的溶液稀释100倍,用毛笔均匀涂抹于叶片表面,置容积为1 cm3的玻璃培养皿内自然晾干;然后放入刚蜕皮并饥饿3 h的2龄菜青虫幼虫。放入1 h后,将完全取食完叶片的幼虫,即感染PrGV幼虫,放入新鲜(不含病毒)的甘蓝叶片上继续饲养。
1.2 方 法
1.2.1 RNA提取与定量PCR 分别挑取感染PrGV后第0,3,6,12,18,24,36,48,72和96 h的菜青虫若虫,利用RNAiso plus(TaKaRa,Dalian,China)提取RNA ;随后,按照ReverTra Ace qPCR RTMaster 试剂盒(ToYoBo,Osaka,Japan)说明书,将mRNA反转录成cDNA;定量PCR按照SYBR Green试剂盒(Bio-Rad,Hercules,CA,USA)说明书配置反应体系,并利用CFX Connect Real-Time System(Bio-Rad)实时检测荧光信号。定量PCR反应程序如下:95 ℃预变性3 min;95 ℃变性10 s,60 ℃退火延伸30 s,共循环40次。以P.rapae18S rRNA作为内参,利用2-ΔΔCt法进行试验结果计算[8]。共进行3个生物重复,每个生物重复包含3个技术重复,定量引物设计详见表1。
1.2.2 PEP原核表达 根据PrGV PEP编码蛋白的CDs序列,设计1对含有BamHⅠ和XhoⅠ酶切位点的PrGV PEP-sense和PrGV PEP-antisense引物(表1),利用PCR扩增目的片段并与PMD-19T(TaKaRa)连接;测序正确后分别用BamHⅠ、XhoⅠ双酶切PEP-PMD-19T,与经同样双酶切的pGEX-4T-2表达载体(Pharmacia,Piscataway,NJ,USA)相连接,获得PEP-pGEX-4T-2重组质粒,转化E.coliBL21;挑取单菌落接种到含有氨苄青霉素的LB培养基中;加入IPTG至终浓度1 mmol/L ,37 ℃下诱导表达6 h;最后,通过SDS-PAGE将诱导表达得到的菌液进行分离,确定目的蛋白的表达情况。

表1 定量PCR和原核表达引物及其序列Table 1 Primers and sequences used in prokaryotic expression and quantitative real-time PCR
1.2.3 PEP-GST重组蛋白回收与多克隆抗体制备 将诱导表达获得的融合蛋白进行SDS-PAGE凝胶电泳,并用预冷的0.25 mol/L KCl溶液染色后切取目的条带;样品经电泳、脱盐、浓缩等处理后送至华安生物有限公司(Huaan Biotech,Hangzhou,China)制备PrGV PEP多克隆抗体。
多克隆抗体制备选取健康的新西兰大耳白兔,分5次免疫,每次蛋白用量为0.5 mg/只:第1次将纯化蛋白与弗氏完全佐剂等体积混合,皮下免疫大白兔;第2~5次免疫使用纯化蛋白与弗氏不完全佐剂等体积混合液,每次免疫间隔14 d。最后一次免疫后10 d取少量血清,利用ELISA测定抗体效价,检测合格后采用颈动脉放血法大量收集兔血,3 000 r/min离心15 min后所得的血清即为抗血清,于-80 ℃冰箱保存。
1.2.4 PEP的Western blotting检测 取感染PrGV后刚死亡的菜青虫,在RIPA裂解液(Beyotime Biotechnology,Beijing,China)中研磨;利用SDS-PAGE分离蛋白后,将其转移到PVDF膜;PVDF膜经1×TTBS(2.42 g Tris-base,8 g NaCl,体积分数0.1% Tween,pH 7.6,定容到1 L)冲洗1遍后,用质量分数5%脱脂奶粉封闭PVDF膜,并按1∶2 000的体积比加入PrGV PEP多克隆抗体,4 ℃孵育过夜;PVDF膜经1×TTBS洗涤3遍后,按照1∶15 000的体积比加入羊抗兔二抗(Jackson Immuno Research,West Grove,PA,USA),4 ℃封闭过夜;取出PVDF膜,用1×TBS(2.42 g Tris-base,8 g NaCl,pH 7.6,定容到1 L)洗涤3遍;随后,向PVDF膜加入Clarity western ECL substrate(Bio-Rad),利用Molecular Imager®ChemiDocTM XRS+System(Bio-Rad)拍摄图像。
1.2.5 PEP的免疫金标记 利用蔗糖密度梯度离心法纯化PrGV病毒样品,将其浸泡在固定液(质量分数4%多聚甲醛,体积分数0.3%戊二醛,质量分数4%蔗糖)中;样品经1×PBS洗涤后,分别用体积分数50%,70%,80%,90%,95%和100%的乙醇脱水;脱水后的样品在Lowicryl K4M(Polysciences,Inc.,Warrington,PA,USA)中浸泡,并放入装有紫外灯的-20 ℃冰箱中;将聚合后的样品在LKB Bromma 11800 pyramitome切片机下进行定位,随后用装有钻石刀的Powertome-PC超薄切片机进行超薄切片。
将含有超薄切片的铜网用质量分数1% BSA封闭,并按1∶200体积比加入PrGV PEP多克隆抗体,室温下孵育2 h;经1×PBS洗涤后,按1∶200体积比加入带有金标记的羊抗兔二抗(Sigma,St.Louis,MO,USA);样品经1×PBS洗涤后,用碱性柠檬酸铅染色并在JEM-1230 TEM(JEOL,Tokyo,Japan)下观察。
1.2.6 生物信息学分析 利用SMART(http://smart.embl.de/)分析序列结构域;利用邻接法(MEGA5.0,http://www.megasoftware.net/)构建系统发生树分析基因间关系,系统发生关系用自举法检测1 000次;利用PrGV PEP序列在NCBI上搜索同源基因,并用Clustal X 1.81软件进行多序列比对。
2 结果与分析
2.1 PEP的序列分析
PrGVPEP基因的核苷酸和氨基酸序列见图1。

灰色部分为PEP保守结构域 The grey shading indicates the conserved domain of PEP图1 PrGV PEP基因的核苷酸和氨基酸序列Fig.1 Nucleotide and amino acid sequence analysis of PrGV PEP
根据基因组测序结果(图1),获得编码框总长为615 bp的PEP基因序列,该基因位于PrGV基因组13 806-14 420 nt,共编码304个氨基酸,预测分子量大小为23 ku,等电点为7.942。SMART预测结果表明,该基因包含1个PEP保守结构域,位于第16-121个氨基酸。
利用BLAST软件搜索PEP的同源序列,发现PrGV PEP与鳞翅目昆虫的GV PEP有较高的同源性,氨基酸序列相似性约为50%。然而,PrGV PEP与其他核型多角体病毒(NPV)的基因组序列并无同源性,可能是GV所特有的。进化树分析结果(图2)表明,侵染昆虫GV的PEP可分为2组:木薯天蛾颗粒体病毒EeGV、稻纵卷叶螟颗粒体病毒CmGV、马铃薯麦蛾颗粒体病毒PoGV、菜粉蝶颗粒体病毒PrGV、小菜蛾颗粒体病毒PxGV、地老虎颗粒体病毒AsGV、分月扇舟蛾颗粒体病毒CaGV等为一组;斜纹夜蛾颗粒体病毒SlGV、草地贪夜蛾颗粒体病毒SfGV、一点粘虫颗粒体病毒MuGV、一星粘虫颗粒体病毒PuGV、棉铃虫颗粒体病毒HaGV等为另一组。其中,PrGV PEP与PxGV PEP的亲缘关系最近,该结果从侧面反映了GV与宿主之间的演化关系。
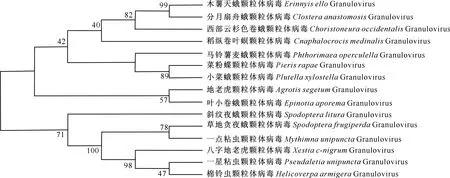
图2 基于邻接法构建的PEP蛋白种系发生树Fig.2 Phylogenetic analysis of PEP using Neighbor-joining method
2.2 PEP的表达时相分析
利用定量PCR方法实时监测PEP基因的增长动态,结果(图3)表明,菜青虫在感毒后0~18 h检测不到PEP的表达。随着感染时间的推移,感毒菜青虫体内的PEP含量逐渐升高,在感染72 h时达到峰值,随后开始下降,感染后96 h的表达量下降到与36 h近似水平。
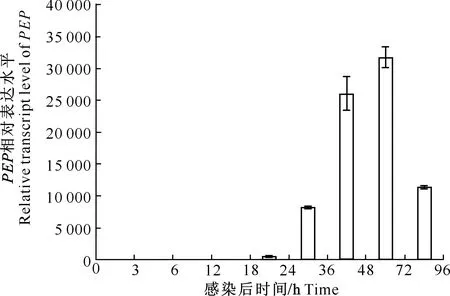
图3 PrGV感染后PEP基因表达水平Fig.3 Expression of PrGV PEP after PrGV
2.3 PEP的原核表达
将PrGV PEP构建到pGEX-4T-2载体,并导入E.coliBL21进行原核表达。SDS-PAGE分析结果(图4)表明,导入pGEX-4T-2的空载体能够诱导表达出26 ku的条带,而未加IPTG诱导的E.coliBL21无法表达外源蛋白。PrGV PEP能在E.coli中诱导表达,其与GST的融合蛋白分子量大小为49 ku,与预测的蛋白分子量相近。与E.coliBL21自身的蛋白相比较,PrGV PEP融合蛋白的表达量较高,可以进行蛋白回收。
2.4 PEP的Western blotting检测
将回收的PrGV PEP-GST蛋白免疫健康的新西兰大耳白兔,最终获得PrGV PEP多克隆抗体。为检测这些抗体的特异性,用Western blotting方法杂交PrGV提取物中的目的蛋白。结果(图5)表明,在23 ku和15 ku附近均有特异性条带,并且2条条带亮度相近。

M.蛋白质分子量标准;1.未加IPTG诱导的E.coli BL21;2.含有pGEX-4T-2质粒的E.coli BL21诱导表达GST;3.含有PEP-pGEX-4T-2重组质粒的E.coli BL21诱导表达PrGV PEP-GSTM.Protein Marker;1.E.coli BL21 sample without induction ofIPTG;2.Induction of E.coli BL21 with pGEX-4T-2 plasmid; 3.Induction of E.coli BL21 with PEP-pGEX-4T-2 plasmid图4 PrGV PEP-GST融合表达分析Fig.4 Expression of PrGV PEP-GST in E.coli BL21
2.5 PEP的免疫金标记分析
为探究PrGV PEP在病毒颗粒体上的具体位置,用胶体金标记的方法对该蛋白进行定位分析,结果见图6。
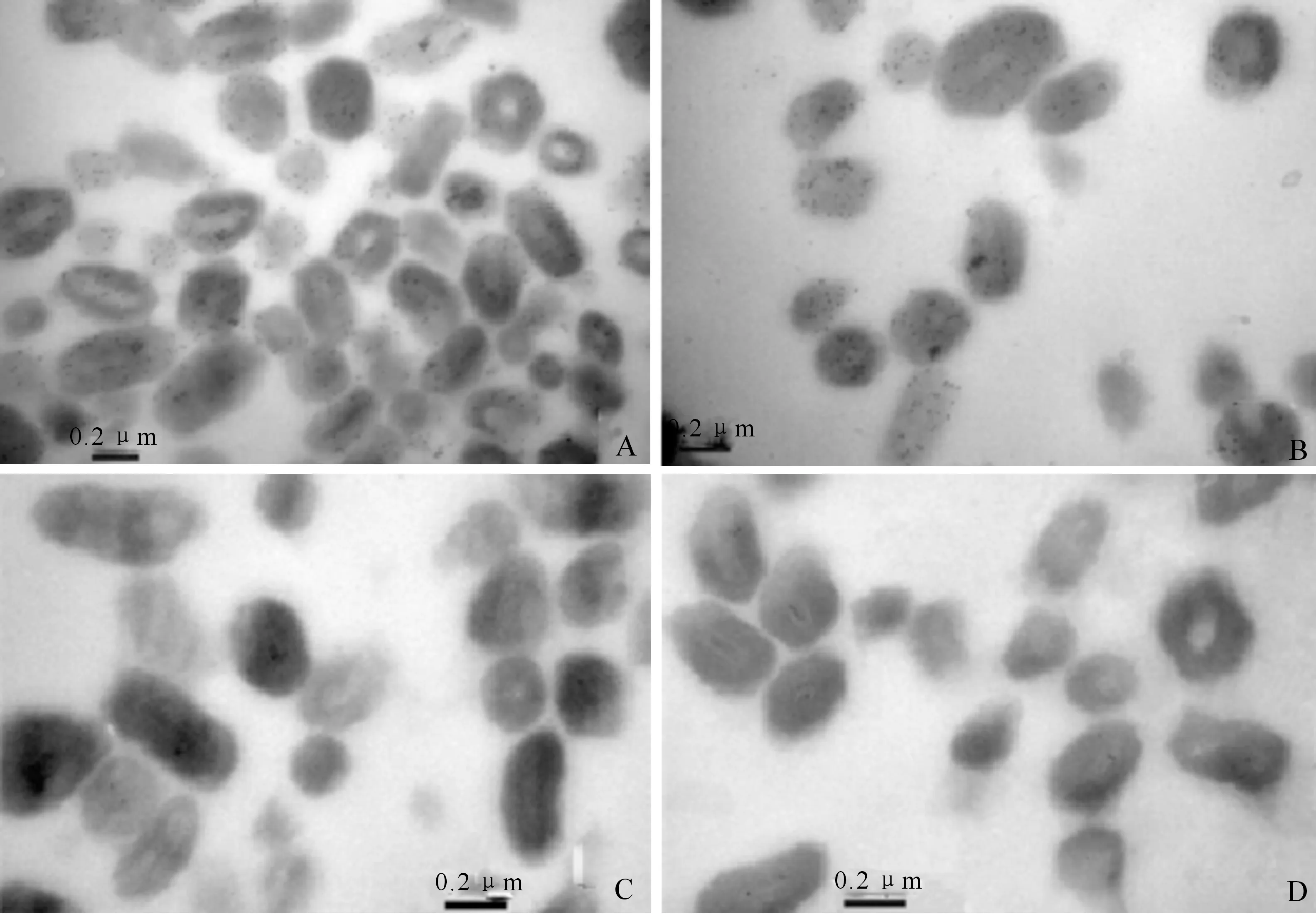
A、B.PrGV PEP多克隆抗体为一抗标记PrGV包涵体;C.清水为一抗标记PrGV包涵体;D.兔阴性血清为一抗标记PrGV包涵体Immunolabelling using anti-PrGV PEP serum (A,B),water (C),and preimmune serum (D) as primary antibodies,respectively
电镜结果显示:PrGV PEP抗体能够特异地与颗粒体结合,10 nm的金颗粒遍布整个病毒粒子,而无病毒粒子的地方则未见金颗粒存在(图6-A,B)。平均每个颗粒体上有20~40个金颗粒,说明PrGV PEP在病毒上的含量较高。相比之下,以清水或以兔阴性血清为一抗的对照组未观察到标记的金颗粒(图6-C,D),说明该抗体具有非常高的特异性。
3 讨 论
本研究利用制备的PEP多克隆抗体,在感染PrGV的菜青虫体内成功检测到目的蛋白;通过免疫金标记,将PEP定位到包涵体上,发现该蛋白在颗粒体上含量很高,分布较为均匀,说明PEP是GV包涵体的重要组分;菜青虫感染PrGV后,其体内PEP基因表达水平逐渐上升,并在感染72 h时达到峰值。杆状病毒包含双相生活循环,即在侵染初期产生出芽型病毒(budded virus,BV),引起宿主整体感染,而在侵染后期产生多角体衍生病毒(occlusion-derived virus,ODV)释放到周围环境[9]。PEP基因在侵染后期表达量较高,说明该基因很可能是PrGV后期表达的重要基因。
迄今为止,对杆状病毒的研究主要集中在NPV上[10-15],而对GV的研究相对较少,且多集中在对病毒株的报道[16-21]。其中关于PrGV的研究报道涉及基因组[5]和个别功能基因[22-23],但对于PEP基因尚未见报道。本研究对GV特有基因PEP的进化关系、表达模式、细胞定位等进行具体分析,为深入研究该基因功能及PrGV的功能基因组学奠定了基础。PEP是杆状病毒的重要组成部分,广泛存在于NPV和GV中[16,18-21]。PEP主要分布于电子致密的膜上,包裹病毒的蛋白基质[24]。王利群等[25]通过对不同NPV多角体膜蛋白的分析发现,这些序列之间的同源性远低于多角体蛋白。本研究发现,PrGV与其他昆虫GV PEP氨基酸序列的相似性只有50%左右,说明不同GV的PEP也存在一定差异,这可能与GV的宿主特异性相关。而PrGV的PEP与NPV则无同源性,这可能是病毒长期进化过程中形成的[18-21]。
利用PrGV PEP的多克隆抗体,在PrGV提取物中分别检测到23 ku和15 ku 2条特异性条带,类似的现象也在ODV-E18、ODV-EC27等基因中观察到[5]。杆状病毒表达系统能够进行蛋白切割、甲基化、糖基化等翻译后加工过程,如甜菜夜蛾多角体病毒SeMNPV的外壳融合蛋白,在成熟过程中可产生76 ku的原始蛋白和60 ku的切割产物[26-27]。PrGV PEP预测分子量大小为23 ku,猜测15 ku的条带可能是成熟蛋白被切割后的产物。
随着很多病毒新株系被报道及一些基因功能被逐步解析明确[28-29],杆状病毒不仅非常成功地应用于生物防治[30-31],也为人们深入了解这些微生物与宿主的相互影响提供了可能[32],而PrGV PEP的独特性有可能为解释GV一类微生物的奥秘提供了重要线索。

