阴香内生菌YXG2-3的抑菌活性与生长条件优化
张斯颖, 骆焱平,胡 坚,韩丹丹,王兰英
(海南大学 热带农林学院,海南 海口 570228)
植物病害是影响农作物产出的重要因子之一,每年都会造成巨大的经济损失[1]。鉴于化学防治带来的负面影响,生物防治优势日益凸显[2-3]。植物内生细菌不仅可产生新的抑菌活性物质、防病机制多样,而且具有内生联合固氮、促生等作用,是当今生物防治研究中被关注较多的领域。金岩等[4]对五味子中的内生细菌进行研究发现,部分内生细菌对五味子、番茄等病原真菌有较强的抑菌活性,具有开发为生防菌的潜能;林玲等[5]从棉花根部分离得到87株对棉花病原真菌具有拮抗活性的内生细菌,发现这些菌株分布于7个属,具备不同的生防作用机制;李悦等[6]对分离自烟草的解淀粉芽孢杆菌和荧光假单胞杆菌进行研究发现,这2株内生细菌的胞外代谢产物及挥发性代谢产物能抑制烟草灰霉病菌菌丝的生长,引发菌丝畸形,有望开发为复合微生物制剂。由此可见,从植物内生细菌资源中挖掘生防微生物切实可行。但在以往的研究中,关于能够广谱抑制热带植物病害的内生细菌报道相对较少。YXG2-3是本课题组前期从阴香根部分离筛选获得的1株内生细菌,该菌株对香蕉枯萎病原菌盆栽防效可达63.8%[7]。本研究拟采用平板对峙法、菌丝干重法和孢子萌发法,测定YXG2-3对多种热带病原真菌的抑菌活性,采用浸果法测定菌株发酵液滤液对香蕉炭疽病的防效,确定菌株分类地位,优化其生长条件,以期明确该菌株的生防价值及适宜的生长条件,为其开发应用奠定基础。
1 材料与方法
1.1 材 料
内生细菌YXG2-3,从阴香根内部分离得到;靶标菌包括橡胶基腐病菌(Fusariumvenfricosum)、香蕉枯萎病菌(Fusariumoxysporumf.sp.)4号生理小种、香蕉炭疽病菌(Colletotrichummusae)、芒果炭疽病菌(Colletotrichumgloeosporiordes)、橡胶炭疽病菌(Colletotrichumacutatum)、芒果蒂腐病菌(Botryodiplodiatheobromae)、水稻纹枯病菌(Rhizoctoniasolani)、橡胶黑团孢病菌(Periconiaheveae)、橡胶落叶棒孢霉病菌(Corynesporacassiicola)、椰子灰斑病菌(Pestalotiapalmarum),由海南大学热带农林学院农药实验室提供。
供试香蕉品种为粉蕉(Musaparadisiaca),果实采自海南大学热带农林学院实验基地;试验对照药剂为45%咪鲜胺乳油,由美国富美实公司生产。
1.2 方 法
1.2.1 YXG2-3皿内拮抗作用的测定 将供试内生细菌YXG2-3接种在NA斜面上,8 ℃培养24 h后备用;靶标菌接种在PDA平板上,25 ℃恒温培养5 d后备用。采用对峙划线法,用直径5 mm的打孔器在靶标菌菌落边缘打取菌饼,将菌饼接种于PDA平板中央;再用接种环挑取YXG2-3,于距PDA平板中央2 cm处左右两边各划一条直线,每个处理重复3次,以不接内生细菌为对照。将接种后的平板置于25 ℃培养箱中培养2~5 d,计算内生细菌的抑菌率。
抑菌率=(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-5.0)×100%[8]。
1.2.2 YXG2-3发酵液滤液对靶标菌孢子萌发的影响 将供试内生细菌YXG2-3接入LB培养液,28 ℃、180 r/min振荡培养18 h,取出后5 000 r/min离心10 min,上清液用0.22 μm细菌过滤器过滤,收集滤液备用。将靶标菌(因皿内测定芒果蒂腐病菌抑菌效果不理想,水稻纹枯病菌不产生无性孢子,故未测定这2种病菌,下述试验同)接种在PDA平板上,25 ℃恒温培养5 d后,参照文献[9]制备孢子悬浮液。将发酵液滤液与孢子悬浮液混合均匀,取1滴滴加在凹玻片上,以过滤的LB培养液替代YXG2-3发酵液滤液作为对照,每处理重复3次,25 ℃保温保湿培养,待对照孢子萌发率达到85%时,统计各处理的孢子萌发率,计算孢子萌发抑制率。
孢子萌发率=(萌发孢子数/检查孢子总数)×100%;
孢子萌发抑制率=(对照组孢子萌发率-处理组孢子萌发率)/对照组孢子萌发率×100%[10]。
1.2.3 YXG2-3对靶标菌菌丝生长量的影响 将供试靶标菌接种于PDA培养基上,25 ℃恒温培养5 d,用无菌水制成1×106CFU/mL孢子悬浮液备用;将YXG2-3接入LB培养液,28 ℃、180 r/min恒温振荡培养18 h,用分光光度计于630 nm下测定其吸光度(D630 nm),并用LB培养液稀释至D630 nm为1.0左右,作为种子培养液备用。配制马铃薯葡萄糖液体培养基(PD)培养液,装入150 mL三角瓶中,每瓶装样量为54 mL,准确称取5个玻璃珠,记录数据后将玻璃珠放入三角瓶中;然后分别加入3 mL靶标菌孢子悬浮液和YXG2-3种子培养液,以加入相同体积LB替代YXG2-3种子培养液作为对照,每个处理重复3次。25 ℃、150 r/min条件下恒温振荡培养6 d,培养物用烘至恒质量的滤纸过滤,将滤纸、菌丝及玻璃珠一起在烘箱中于60 ℃烘至恒质量,称质量后,按公式计算菌丝干质量及抑菌率。
菌丝干质量=总干质量-滤纸干质量-玻璃珠质量;
抑菌率=(对照组菌丝干质量-处理组菌丝干质量)/对照组菌丝干质量×100%[11]。
1.2.4 YXG2-3对香蕉炭疽病防效的测定 采用浸果法测定YXG2-3对香蕉炭疽病的防效[12]。采集八成熟的香蕉果实,落梳后去花器及伤病果,每梳保留5个果,用清水清洗后在室内阴干,备用。按照1.2.2中方法制备内生细菌YXG2-3发酵液滤液,将阴干后的香蕉果实浸泡在YXG2-3发酵液滤液中2 min,室温阴干,作为内生细菌处理;以250 μg/mL 咪鲜胺水溶液处理为药剂对照,以无菌水处理为空白对照。所有处理果实均用厚度0.04 mm的聚乙烯袋分别密封包装后放入纸箱,置于温度为25 ℃、相对湿度为78%的储藏室存放。果实成熟时进行各处理病情调查。病情分级标准[13]如下:0 级,果实无病斑;1 级,病斑占果皮面积的 10%以下;3 级,病斑占果皮面积的 11%~25%;5 级,病斑占果皮面积的 26%~50%;7 级,病斑占果皮面积的 51%~75%;9 级,病斑占果皮面积的 76%以上。按下式计算病情指数和防效。
病情指数=∑(各级病果数×相对级数值)/(调查总果数×9)×100;
防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.2.5 YXG2-3菌株的鉴定 (1)形态特征及生理生化特性。参照文献[14-15]的方法进行细菌培养特征、菌株形态特征以及生理生化特性的鉴定。
(2)16S rDNA序列分析。按照全式金基因组DNA提取试剂盒说明书操作步骤,提取YXG2-3基因组DNA。采用细菌16S rDNA通用引物7F(5′-CAGATTTGATCCTGGCT-3′)、1540R(5′-AGG-AGGTGATCCAGCCGCA-3′),对获得的菌株总DNA进行PCR扩增。PCR扩增体系为:DNA模板0.5 μL,10×Buffer 2.5 μL,dNTP 1 μL,Taq酶0.2 μL,上游及下游引物各0.5 μL,用双蒸水补足至25 μL。PCR反应循环条件为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,共30个循环;72 ℃修复延伸20 min。PCR产物送上海英骏生物技术有限公司进行测序,获得的序列提交至GenBank(http://www.ncbi.nlm.nih.gov)进行注册,并对序列进行Blast分析,用MEGA6.0邻接(Neighbor-Joining)法构建系统发育树[16]。
1.2.6 YXG2-3生长条件的优化 (1)碳源、氮源的优化。以LB为基础培养液,使含碳质量分数相同,分别以葡萄糖5 g/L、麦芽糖5 g/L、蔗糖4.75 g/L、果糖5 g/L、甘露糖5 g/L为外加碳源, LB培养液为对照,进行菌株生长最适碳源优化;使含氮质量分数相同,分别以KNO33.25 g/L、 (NH4)2SO44.25 g/L、牛肉浸膏3.46 g/L替代LB培养液中的酵母粉,以LB培养液为对照,进行菌株生长最适氮源优化。
将配制的碳、氮源优化培养液分别分装至50 mL三角瓶中,装样量为18 mL。灭菌后培养液接入种子培养液(制备方法同1.2.3)2 mL,28 ℃、180 r/min恒温振荡培养18 h,用分光光度计测定其D630 nm值,每个处理重复3次。
(2)最适pH的确定。以LB为基础培养液,将培养液pH分别调至5.0,6.0,7.0,8.0,9.0,分装至50 mL三角瓶中,装样量为18 mL。灭菌后用1 mol/L HCl或NaOH调节培养液pH,接入种子培养液2 mL,培养条件和检测方法同上,每个处理重复3次。
(3)最适培养温度的确定。以LB为基础培养液,分装至50 mL三角瓶中,装样量为18 mL。灭菌后接种种子培养液2 mL,分别置于23,28,33,38,43 ℃培养,其他培养条件及检测方法同上。每个处理重复3次。
1.3 数据处理
采用SPSS 17.0对试验数据进行统计分析,采用Duncan’s新复极差法对数据进行差异显著性多重比较。
2 结果与分析
2.1 YXG2-3对10种靶标菌的皿内拮抗作用
菌株YXG2-3对10种病原真菌皿内拮抗活性的测定结果(表1)显示,该菌株对香蕉炭疽病菌的抑菌活性最好,抑菌率可达79.88%;对水稻纹枯病菌的抑菌活性也较高,抑菌率大于70%;该菌株对其余供试靶标菌的抑菌率均在50%以上。可见该菌株所分泌的抑菌活性物质较为多样,抑菌谱广。

表1 菌株YXG2-3对10种靶标菌的皿内抑菌活性Table 1 Antibacterial activities of strain YXG2-3 against 10 targets %
注:同列数据后标不同小写字母表示在P<0.05水平差异显著,标不同大写字母表示在P<0.01水平差异显著。下表同。
Note:Different lowercase letters indicate significant difference atP<0.05 level,and different capital letters indicate extremely significant difference atP<0.01 level.The same below.
2.2 YXG2-3发酵液滤液对靶标菌孢子萌发的影响
YXG2-3发酵液滤液对8种植物病原真菌孢子萌发影响的测定结果(表2)显示, YXG2-3发酵液滤液对供试靶标菌孢子萌发均有一定的抑制作用,但效果不理想,抑制率均小于50%。

表2 YXG2-3发酵液滤液对靶标菌孢子萌发的影响Table 2 Effect of YXG2-3 fermentation broth on spore germination of targets %
2.3 YXG2-3对靶标菌菌丝生长量的影响
YXG2-3对供试靶标菌菌丝生长量影响的测定结果(表3)表明,供试8种靶标菌中,YXG2-3对香蕉枯萎病菌的抑制效果最好,抑菌率为81.33%;对香蕉炭疽病菌的抑菌活性次之,抑菌率为74.45%;除橡胶黑团孢病菌外,对其余几种靶标菌的抑菌率均在60%以上。

表3 YXG2-3对靶标菌菌丝生长量的影响Table 3 Effect of YXG2-3 on mycelial growth of targets %
2.4 YXG2-3对香蕉炭疽病的防效
YXG2-3对香蕉炭疽病防效的测定结果(表4)显示,香蕉果实贮藏18 d后基本成熟,且各处理均有发病,其中无菌水对照组病情指数达86.66,YXG2-3发酵液滤液处理组与药剂对照组病情指数均小于30;YXG2-3发酵液滤液对香蕉炭疽病的防效为66.22%,略低于药剂对照组的70.40%,二者差异不显著(P>0.05)。
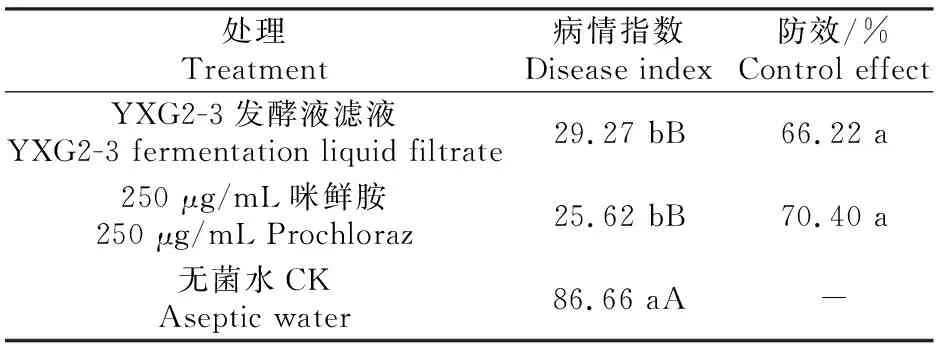
表4 YXG2-3对香蕉炭疽病的防治效果Table 4 Control effect of YXG2-3 against Colletotrichum musae
2.5 YXG2-3菌株的鉴定
2.5.1 形态特征及生理生化特性 YXG2-3经NA平板培养24 h后,肉眼可见菌落较小,圆形,表面光滑凸起,边缘整齐。显微镜下可观察到该菌株菌体呈杆状,革兰氏阴性,无芽孢,运动,鞭毛数根、极生。生理生化特性测定结果(表5)表明,YXG2-3接触酶阳性,氧化酶阳性,V.P反应阴性;能使明胶液化,但不能水解淀粉;不能将苯丙氨酸氧化脱氨;能利用柠檬酸盐生长,能从蔗糖合成果聚糖;能进行反硝化反应;可以利用丙二酸盐,产碱;可以利用葡萄糖、海藻糖、蔗糖、麦芽糖等作为唯一碳源进行生长;41 ℃下不能生长;当 NaCl 质量分数大于 2% 时,生长被抑制;能在KB培养基上产生荧光色素。经鉴定认为,该菌生理生化特性与荧光假单胞菌(Pseudomonasfluorescens)的生理生化特征完全相同。
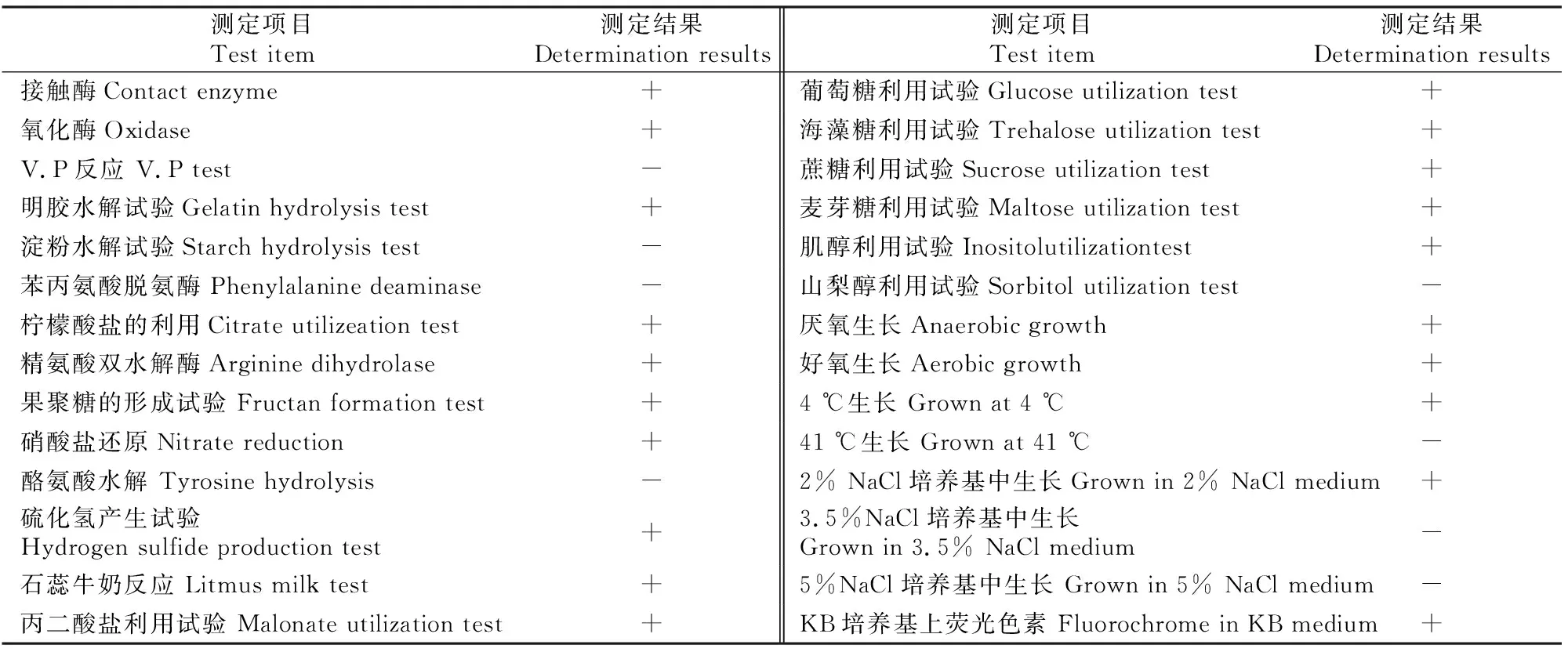
表5 YXG2-3的生理生化特征鉴定Table 5 Physiological and biochemical characteristics of YXG2-3
注:+阳性,-阴性。
Note:+Positive;-Negative.
2.5.2 16S rDNA序列鉴定 菌株YXG2-3 16S rDNA碱基序列全长1 497 bp,将此序列在GenBank中注册,获得登录号为KT996106。运用在线Blast软件进行分析发现,同源性较高的参考菌株多数为假单胞杆菌属菌株,选取其中5株同源性高的菌株构建系统发育树(图1),发现菌株YXG2-3与荧光假单胞杆菌P.fluorescens(AY538263)在系统发育树同一分支上,二者同源性达99%以上,结合该菌株的生理生化特征初步推断,YXG2-3为荧光假单胞杆菌。

图1 基于16S rDNA序列构建的菌株YXG2-3的系统发育树Fig.1 Phylogenetic tree of strain YXG2-3 based on 16S rDNA sequence
2.6 YXG2-3生长条件的优化
2.6.1 碳源和氮源的优化 将YXG2-3接种于含有外加碳源的LB培养液中,28 ℃、180 r/min振荡培养18 h,测定其D630 nm,结果(表6)发现,外加碳源均能促进菌株生长,且以麦芽糖效果最好,与其他处理差异极显著;将供试菌株YXG2-3接种于不同氮源的LB培养液中,各处理菌株生长量均显著低于氮源为酵母粉的对照。

表6 不同碳源和氮源对YXG2-3生长量的影响Table 6 Effects of different carbon sources and nitrogen sources on YXG2-3 growth
2.6.2 最适pH 将供试菌株YXG2-3接种于不同pH的LB培养液中,28 ℃、180 r/min振荡培养18 h,结果(图2)发现,pH对菌株生长量的影响较大,pH为5.0时菌株D630 nm值仅为0.036;随着pH增加,菌株生长量迅速增大,当pH为7.0时菌株生长量达最高值,D630 nm为2.265,显著高于其他pH处理(P<0.05);当培养液呈碱性时,菌株生长量开始下降,可见该菌株适宜生长的pH为中性。
2.6.3 最适培养温度 将供试菌株接种到LB培养液中,分别于23,28,33,38和43 ℃及180 r/min条件下振荡培养18 h,测定其D630 nm值,结果(图3)发现不同温度下菌株生长量不同,随着温度升高,菌株生长量呈现先升高后降低的趋势。在测定温度范围内,33 ℃时菌株生长量达最大值,随着温度进一步升高,菌株生长量迅速降低,温度达到43 ℃时菌株不能生长。

图中不同小写字母表示在P<0.05水平差异显著。下图同Different lowercase letters indicate significant difference at P<0.05.The same below图2 pH对YXG2-3生长量的影响Fig.2 Effects of pH on YXG2-3 growth
3 讨 论
本研究表明,内生菌YXG2-3为荧光假单胞杆菌,虽然荧光假单胞杆菌已经在世界范围内得到大量关注[17-19],但将其应用于防治热带病害的报道较少。而YXG2-3不仅对土传病害香蕉枯萎病有很好的防效[7],对采后病害香蕉炭疽病也有突出的防治作用。同时,本研究发现,YXG2-3适宜生长温度为33 ℃左右,适合在pH中性环境中生长,该生长条件与香蕉种植环境相符[20],因此该菌株有望应用于香蕉病害的防治。另外也有研究报道,荧光假单胞杆菌具有繁殖快、竞争定殖能力强等优点,是目前污水处理、微生物肥料生产应用中最常见、最重要的细菌菌种之一[21-24]。可见,今后可开展YXG2-3在香蕉植株根际定殖能力及对香蕉植株促生能力的研究。
有人认为,荧光假单胞杆菌作为生防菌的优势在于其产生的次生代谢产物种类多样[25]。本研究对其进行抗菌谱测定发现,菌株YXG2-3对镰刀菌属(橡胶基腐病菌、香蕉枯萎病菌)、立枯丝核菌属(水稻纹枯病菌)、炭疽菌属(香蕉炭疽病菌、芒果炭疽病菌、橡胶炭疽病菌)、黑团孢属(橡胶黑团孢病菌)、棒孢属(橡胶落叶棒孢霉病菌)、拟盘多毛孢属(椰子灰斑病菌)、球二孢属(芒果蒂腐病菌)7个属的10种靶标菌的抑菌率均大于50%,说明该菌株抑菌谱较广,证实了“荧光假单胞杆菌分泌的活性物质较为多样”这一观点。同时,本研究结果显示,YXG2-3可以有效控制靶标菌菌丝增长,但其发酵液滤液不能有效抑制靶标菌孢子萌发,分析原因可能是该菌株产生的次生代谢产物主要对靶标菌的生物合成有明显抑制作用,而对生物氧化影响作用较小[26]。因此今后可对其抑菌活性成分进行分离纯化,以深入研究其抑菌机理。
4 结 论
YXG2-3对香蕉炭疽病菌等10种热带病原真菌皿内抑菌活性很强,与靶标真菌共培养时能够很好地抑制供试靶标菌菌丝质量的增加。其发酵液滤液对靶标菌孢子萌发影响不大,但能有效防治香蕉炭疽病害,防效与对照药剂咪鲜胺(250 μg/mL)相当。经鉴定该菌株为荧光假单胞杆菌,适宜的碳、氮源分别为麦芽糖和酵母膏,pH中性环境最有利于其生长,培养温度33 ℃左右较为适宜。

