副干酪乳杆菌的功能特性及其应用研究进展
耿文超,关今韬,2,程 申,贠军贤
(1.浙江工业大学 化学工程学院 绿色化学合成技术国家重点实验室培育基地,浙江 杭州 310014;2.浙江大学 化学工程与生物工程学院,浙江 杭州 310027)
在全球益生菌发酵类食品中,乳杆菌发酵食品创造的价值占总量的20%[1]。干酪乳杆菌(Lactobacilluscasei)是乳杆菌属的重要成员,它可以在肠道内大量存活,通过调节肠道菌群失衡改变肠道微生态环境,增强人体免疫力,对人体发挥着益生菌的作用,是人类“健康三益生菌”之一。
副干酪乳杆菌(Lactobacillusparacasei)是由Collins等[2]首次提出从干酪乳杆菌亚种中划分出来的新种。2008年,国际细菌分类委员会(Judicial Commission of the International Committee on Systematics of Bacteria)驳回了Dick等将其归入干酪乳杆菌属的分类[3],重新将副干酪乳杆菌及其亚种划分出来。目前为止,其分类学地位一直存在争议。副干酪乳杆菌广泛存在于人体口腔[4]及肠道[5],发酵乳制品(尤其是奶酪)和植物原料发酵物(泡菜、酒和饲料)等[6]诸多环境中,它具有干酪乳杆菌属调节肠道和增强免疫力等益生功能,代谢产生的细菌素具有优良的抑菌性能。因此,在食品、医疗保健等领域能够发挥重要作用。近年来,副干酪乳杆菌在其他领域的应用有所拓展,作为潜在的重要工业微生物,可以用来合成高值有机酸,如L-乳酸和苯乳酸[7-8];另外,随着越来越多的细胞在表面酶展示技术的发展及其在生物技术和疫苗领域的应用,副干酪乳杆菌以其优异的生物安全性及相对较厚的细胞膜,使其得以作为生物活性分子尤其是蛋白质和酶的表面展示平台,这种特性引起了人们的注意。
本文中,笔者对副干酪乳杆菌的筛选鉴定、功能特性及近几年在食品工业、微胶囊技术、生产乳酸或苯乳酸以及微生物细胞表面酶展示等新领域的应用研究进展进行综述分析。
1 副干酪乳杆菌的筛选鉴定
乳杆菌群中的干酪乳杆菌群数量较多,其中副干酪乳杆菌、鼠李糖乳杆菌及干酪乳杆菌三种菌亲缘结构相近[1,6],很难利用传统的方法进行区分。目前,对副干酪乳杆菌菌株鉴定,常用分子生物学技术(如,16S rDNA序列同源性分析),并结合发酵过程中糖类同化能力(API CH检测系统)及代谢产物、PCR扩增等技术,进行新菌株的鉴定。2005年,Komatsuzaki等[9]从发酵鱼制品中筛选出1株高产γ-氨基丁酸(GABA)的乳酸菌菌株NFRI 7415,用16S rDNA序列检测表明,其与L.paracaseiJCM 8130同源性达99.8%;通过API CH 检测系统检测其对不同糖类的同化能力,证实其为副干酪乳杆菌。2010年,Wang等[10]从新生婴儿粪便和泡菜中分离得到5株乳杆菌菌株,分别通过16S rRNA引物扩增和API 50CHL检测系统并结合代谢产乳酸的类型,分离得到1株能够代谢产生L-乳酸的副干酪乳杆菌L.paracaseiF08。2017年,Sunthornthummas等[11]从工厂变质发酵牛奶中分离得到一株菌,经过API 50 CHL检测其与副干酪乳杆菌同源性达99.7%;结合16S rDNA序列和PCR扩增等技术,证明其为副干酪乳杆菌,与干酪乳杆菌成功区分开。由此可见,通过16S rDNA序列检测、API CH检测系统并结合代谢产物、PCR扩增等方法,可以快速、准确地对乳杆菌属中的副干酪乳杆菌进行鉴定,这是目前最有效的鉴定方法。
2 副干酪乳杆菌的功能特性
2.1 生理特性
副干酪乳杆菌具有良好的生理功能,它不仅可以通过控制肠道的微生物菌落影响着人体的消化系统,调节人体肠道群,增强免疫力,而且还具有良好的耐酸耐胆盐特性[12-13],口服实验证明其为安全有效的益生菌株。Marzotto等[14]用含有副干酪乳杆菌的发酵酸奶连续喂食12~24个月大的婴儿4周,7 d后对婴儿粪便取样检测,结果发现:副干酪乳杆菌在92%的婴儿粪便样品中含量最高,成为人体内乳杆菌的主要菌群;随后逐渐稳定,说明其能够在人体内定植生长。Verdenelli等[15]对50名健康的意大利成年人进行分组试验,结果发现:副干酪乳杆菌在人体内的耐受性很好,服用过鼠李糖菌L.rhamnosusIMC 501和副干酪乳杆菌L.paracaseiIMC 502的成年人肠道蠕动明显加强,对于肠道和人体排便规律等起到了良好的调节作用。此外,副干酪乳杆菌还可增强宿主对微生物病原体的抵抗力,增强免疫球蛋白数量。Calder等[16]通过在健康人体内通过服用含副干酪乳杆菌的牛奶,建立疫苗接种模型调节免疫系统,42 d后进行对比,结果发现:无论在人体血浆(IgG1、IgG3)还是唾液中(IgA)特异性抗体数量较之前都有明显增加,说明副干酪乳杆菌可以安全有效地提高人体免疫力,良好的生理功能使得副干酪乳杆菌在医疗保健方面具有重要的研究价值。
2.2 抑菌性能
副干酪乳杆菌在代谢过程中能够产生细菌素[17],能够抑制肠道中的有害菌。细菌素多为有抑菌活性的多肽类物质,对抑制病原菌、调节肠道平衡发挥着重要的作用。近年来,国内外对副干酪乳杆菌抑菌性和细菌素的研究逐步深入,已报道了多种新的细菌素。
Hassan等[18]从酵母发酵液中分离得到的副干酪乳杆菌亚种(L.paracaseissp.toleransL17),可以有效地抑制层生镰刀菌(FusariumproliferatumM5689)、禾谷镰刀菌(FusariumgraminearumR4053)和白曲霉(AspergilliumcandidusC25)等产毒素真菌。Ashokkumar等[19]从生驴奶中分离筛选得到了1株副干酪乳杆菌,该菌株产生的细菌素粗提物对鼠伤寒沙门氏菌(Salmonellatyphimurium)有很强的抑制作用,其最小抑菌浓度(MIC)指数为128 μL。Wannun等[4]从人体口腔分离出1株副干酪乳杆菌株L.paracaseiSD1,其培养液经沉淀、过滤、层析等分离,得到了抑菌活性物质“Paracasin SD1”,经SDS-PAGE分析表明,其分子量为2.402 8×104,对口腔致病菌有很好地抑制作用。雷虹等[20]自乳酸菌发酵泡菜液中分离出副干酪乳杆菌株L.paracaseiHD1.7,其代谢合成分子量约1.4×104的肽类抑菌物,对大肠杆菌(E.coli)、金黄色葡萄球菌(Staphylococcusaureus)、李斯特氏菌(Listeriasp.)和沙门氏菌(Salmonellasp.)等很多致病菌的生长都有抑制作用。Miao等[21]从西藏发酵牛奶中分离鉴定获得1株副干酪乳杆菌亚种L.paracaseisubsp.toleransFX-6,其能够产生分子量为2 114的新型细菌素F1,对细菌和真菌均有抑制作用。Li等[22]将副干酪乳杆菌株L.paracaseiHD1.7与枯草杆菌进行混合培养,观察到由于其产生的细菌素“Paracin 1.7”的作用,使枯草杆菌的生长受到抑制。林晓龙等[23]从内蒙古传统乳制品中分离鉴定出1株副干酪乳杆菌L.paracaseiQ-1-4,其发酵上清液对鼠伤寒沙门氏菌(SalmonellatyphimuriumCMCC50115)具有抑制作用,经蛋白酶处理后抗菌活性下降,说明所产抗菌物质为蛋白类物质。副干酪乳杆菌及其对多种目标菌具有显著的抑制作用,现总结于表1。总体来看,国内外已经开始对副干酪乳杆菌抑菌性能及新型细菌素方面进行系统研究,这些新型细菌素在食品工业和医药领域具有广阔的应用前景。

表1 副干酪乳杆菌抑菌作用
3 副干酪乳杆菌的应用研究
3.1 乳制品和功能食品
大多数副干酪乳杆菌株来源于传统的干酪和酸奶[1],能够在乳品中很好地生存,同时还有调节风味的作用。Van Hoorde等[24]选取2株副干酪乳杆L.paracaseiR-40926和R-40937,观察到其在干酪中很好地生长,同时发酵过程中还代谢产生了酶和其他调节风味的物质。Poveda等[25]将副干酪乳杆菌L.paracaseissp.CECT 7882加入奶酪中,检测到奶酪中的游离脂肪酸和醇类等物质都有所增加,较传统的奶酪风味质量明显提升。除了乳制品,副干酪乳杆菌在肉制品的应用研究中也有少量报道[26-27]。
副干酪乳杆菌在疫苗和功能食品中也有潜在的应用前景[28-29]。Nocerino等[29]将377个12~48个月大的婴儿分为3组进行对比,其中两组分别食用含有副干酪乳杆菌L.paracaseiCBA L74的发酵牛奶和大米,另一组则没有食用含副干酪乳杆菌菌株的食物,90 d后发现,两组服用过含该菌种食物的婴儿无论是对常见传染病还是呼吸道感染、急性肠胃炎等的免疫能力都较未服用过的要高,说明副干酪乳杆菌对于婴儿疾病的免疫能力具有增强作用。
3.2 副干酪乳杆菌微胶囊
为了防止副干酪乳杆菌在食品应用中失去活性,利用细胞微胶囊技术对菌体进行包埋,可以保护菌的活性[1,30]。常用的微胶囊膜材包括乳蛋白质、糊精、海藻糖及海藻酸钠等。Thomas等[31]以乳蛋白为载体,通过凝乳酶的酶促诱导凝胶化作用,制备了副干酪乳杆菌微胶囊,在pH 2.5条件下培养后,发现细胞成活率较未包埋细胞显著提高。David等[32]通过喷雾干燥法将副干酪乳杆菌包埋入以麦芽糖糊精和海藻糖为基质的微胶囊中,研究微胶囊时材料浓度对细胞成活率的影响,结果发现,菌种活性达60%以上。Ortakci等[33]以海藻酸盐为载体,将L.paracaseiLBC-1e包埋制备得到海藻酸盐微胶囊,在用磷酸盐模拟的胃液环境下包埋细胞成活率较于未包埋细胞成活率优势明显。Teanpaisan等[30]将来自于人体口腔中的副干酪乳杆菌L.paracaseiSD1菌株包埋入海藻酸盐颗粒中,在海藻酸盐质量浓度为20 g/L、CaCl2浓度为0.05 mol/L条件下,制备得到的副干酪乳杆菌微胶囊在果汁中冷藏56 d后,比未包埋菌株活性要高得多。
但是,针对食品和药品应用目的之微胶囊对包埋材料和菌株有严格的要求,现有的副干酪乳杆菌微胶囊包埋技术尚不成熟,使得其在食品或药品工业中的应用较少。因此,菌种的进一步选育、新胶囊材料的研究以及适用于工业化制备的微胶囊包埋技术的研究,是需要进一步探索的方向。
3.3 L-乳酸的制备
乳酸是一种重要有机酸,其结构简单,有D型和L型两种光学异构体。乳酸需求量大,在全球范围内被广泛应用于生物、医药和新材料等诸多工业领域[34]。化学合成法生产乳酸为D,L-乳酸,而发酵方式生产可以得到光学纯度很高的D-或者L-乳酸。目前,全球70%以上的乳酸采用发酵方式生产,主要为L-乳酸;而D-乳酸由于高产菌株少,目前尚没有规模化工业生产。副干酪乳杆菌在发酵过程中可以利用糖类原料,进而可以大量生产高纯度的L-乳酸[27],总结相关研究结果于表2中。
Moon等[35]利用从土壤中分离得到1株副干酪乳杆菌亚种CHB2121,在含有200 g/L葡萄糖的培养基中发酵培养产出192.00 g/L乳酸,L-乳酸光学纯度达96.6%,产率为0.96 g/g,生产强度达3.99 g/(L·h);Choi等[36]以菊芋块茎中的菊粉型糖类为底物,利用副干酪乳杆菌KCTC13169和KCTC13090,发酵合成了乳酸,其中KCTC13169乳酸产量是干酪乳杆菌KCTC3109发酵产乳酸量的6倍,发酵过程无酸性物质或者水解酶存在,乳酸产量和转化率分别达到92.50 g/L和98%,L-乳酸纯度达93.2%。Nguyen等[37]以微藻中的糖类作为底物,通过副干酪乳杆菌LA104发酵,发酵合成的L-乳酸质量浓度达37.11 g/L,生产强度为1.03 g/(L·h),光学纯度达95.7%,说明微藻也是大规模生产L-乳酸的潜在底物。Kuo等[38]通过敲除D-乳酸脱氢酶基因改造的L.paracasei7B菌株,对木质纤维素原料底物抑制具有耐受性,通过分批补料方式发酵葡萄糖,合成215 g/L的L-乳酸;利用木质素和稻草水解物为原料进行发酵,产L-乳酸质量浓度达99.00 g/L,生产强度分别为(2.25~3.23)、5.27 g/(L·h)。Tian等[39]还通过在副干酪乳杆菌细胞内亚克隆NADH生物传感器,监控环境变化对L-乳酸发酵过程的影响规律,结果表明:胞外氧化还原电势显著影响胞内氧化还原条件、细胞生长和代谢,如随着通气量的增加、氧化还原电势的改变,L-乳酸总生产强度得到提升,但总产率有降低的趋势。
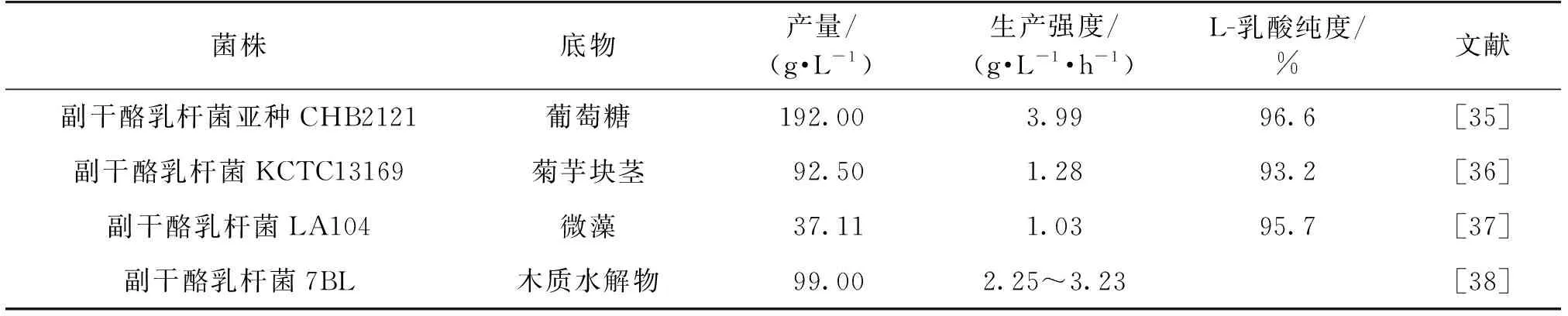
表2 有关发酵产L-乳酸的副干酪乳杆菌菌株
虽然副干酪乳杆菌发酵液中L-乳酸的质量浓度可达200 g/L,而且产率已有大幅度提高,在大规模生产L-乳酸方面有广阔前景。但是,目前这些工作主要处于实验室研究阶段,鲜有中试规模或工业规模的研究数据,因为已经报道的研究所采用的底物成本较高。因此,采用低廉的底物进行发酵,并开展中试和大规模制备方面的探索,是目前亟须开展的工作。
3.4 苯乳酸的合成
苯乳酸是一种新的高附加值有机酸,具有广谱的抑菌性。由于其自身优良的性能,在食品、制药、组织工程等领域有重要应用前景。苯乳酸主要通过微生物发酵或生物转化法进行合成,合成苯乳酸的菌株以植物乳杆菌、干酪乳杆菌及其他乳酸菌为主[40],较化学合成法具有反应条件温和、无需高毒溶剂等优点。
副干酪乳杆菌也可以合成苯乳酸。刘戈等[7]报道了将副干酪乳杆菌(L.paracaseiW2)发酵培养基中添加苯丙酮酸,并对发酵条件进行优化,使得苯乳酸的产量达801 mg/L,比优化前提高1.4倍[8];其合成方法与干酪乳杆菌转化合成苯乳酸的方法(以苯丙酮酸为底物)相似[41]。最近,Valerio等[42]向8株乳酸菌株的发酵培养基中加入苯丙酮酸,通过比较前后抑菌活性的变化,结果表明:由于加入苯丙酮酸促进了苯丙酮酸衍生物的生成,发酵液的抑菌活性有明显提高;在培养基加入苯丙酮酸后,副干酪乳杆菌株L.paracasei2.1发酵合成的苯乳酸量是加入前的6倍,抗真菌活性也显著提高。
副干酪乳杆菌通过微生物转化法合成苯乳酸的研究刚刚起步,主要集中在转化条件的优化和抑菌性研究中,转化合成机制的研究还没有开展,高产菌株仍然很少,目前尚没有工业化生产。因此,筛选高效菌株,进行菌株的基因工程改造,进一步优化发酵和转化条件,揭示转化合成机制,是下一步需要研究解决的问题。
3.5 细胞表面酶的展示
生物酶在生物转化反应中对底物识别特异性强,反应通常在水溶液中进行。采用细胞酶表面展示技术,对酶进行固定化和展示,可以提高全细胞催化剂的效率,并能够使酶得到重复利用,有助于进一步降低成本。近几年其在生物转化、全细胞催化及疫苗开发等领域引起了关注[43-44],其中,革兰氏阴性菌,如大肠杆菌、恶臭假单胞菌(P.putida),革兰氏阳性菌,如谷氨酸棒杆菌(C.glutamicum)、乳酸菌属和芽孢杆菌属(B.subtilis)内生孢子等,都被用于细胞表面酶展示,构建崭新的全细胞催化剂。
乳酸菌属表面展示以其优异的生物安全性受到了重视,其中研究较多的是乳球菌和乳杆菌属。副干酪乳杆菌作为重要的细胞表面酶展示微生物,近期也是研究热点。Velikova等[45]对两种不同数量肽聚糖结合位点的糖苷酶InuB41和InuLC1在副干酪乳杆菌表面的展示进行了研究,通过优化发酵条件及展示酶的纯化和性能测试,结果表明:两种酶分子量都在1.0×105左右,其生物特性并没有因为锚定部位的不同而受影响;同时,两种酶对底物特异性不同,InuB41对菊粉有很强的特异性,而InuLC1则对果糖特异性强。这种副干酪乳杆菌细胞表面展示糖苷水解酶,可以作为崭新的细胞工厂,能够同时利用淀粉和菊粉混合底物,在新的功能性食品及生物化学品的合成方面具有广阔前景。这种方法常常不需要基因改造,克服了生物安全性问题,比传统的固定酶技术酶活性好,暴露完全。因此,可以将外源融合蛋白(包含活性酶)通过副干酪乳杆菌细胞锚定单元锚定于细胞外壁,构建新的全细胞催化体系,使其在细胞表面展示,发挥特定功能,在生物技术领域有着广泛的应用前景。
4 展望
副干酪乳杆菌作为乳杆菌群的重要成员,具有优良的抑菌性能,在肠道调节、增强免疫力等方面发挥着益生作用。它的筛选和鉴定可以利用分子生物学技术,如16S rDNA序列同源性分析,并结合发酵过程中糖类同化能力及代谢产物和PCR扩增等方法。副干酪乳杆菌的应用研究主要集中在乳制品与功能食品、菌体细胞微胶囊技术、L-乳酸制备、苯乳酸合成和微生物细胞表面酶展示技术等方面。近几年,这种微生物在食品工业、医药、生物技术和化工等领域应用的研究不断深入,在微胶囊、乳酸、苯乳酸、微生物细胞表面酶展示等方面的研究引起了业内广泛的重视,成为当前工业微生物和生物化工领域关注的前沿领域之一。
但是,当前报道的副干酪乳杆菌高产菌株仍然很少,其在高值有机酸发酵合成及细胞表面酶展示等新领域的应用刚刚起步,相关的机制和基础研究十分有限,这些是下一步研究的重点方向。另外,随着国内外学者研究的逐步深入,副干酪乳杆菌发酵有机酸的产率和产物浓度将不断提高,从发酵液中直接分离有机酸对于大规模生产应用至关重要。然而,目前对于其发酵产物中有机酸的分离则鲜有研究。因此,研究和筛选有机酸高产菌株、研究其细胞表面酶展示技术、探索副干酪乳杆菌发酵液中有机酸的分离技术等,都有深远意义。

