不同冻结方式对草鱼肉挥发性成分的影响
康翠翠,施文正*,方 林,王锡昌
(上海海洋大学食品学院,上海水产品加工及贮藏工程技术研究中心,上海 201306)
草鱼是我国主要的淡水鱼类养殖品种,2016年全国淡水养殖鱼类产量是2 816万 t,其中草鱼产量最高,为590万 t,占淡水养殖鱼类产量的20.96%[1]。目前,草鱼主要以鲜活销售为主,但草鱼的生产具有地域性和季节性,集中上市时易造成产品积压,不仅影响草鱼的价格,还会造成淡水鱼资源浪费,制约淡水渔业的发展,因此需要对草鱼进行加工,以丰富市场供应,满足消费者需求。冷冻是水产品保鲜常用的方法之一,对维持水产品市场供需平衡有重要的作用,也是水产品贮藏的主要方法之一[2]。可是,冷冻会使鱼肉体内产生大小不同的冰晶,损伤细胞组织结构,引起蛋白质变性,解冻后会造成汁液流失,导致鱼肉的营养成分损失,肉质变硬,口感降低,严重影响鱼肉的品质[3]。但鱼肉在进行冻结时,若能快速的通过最大冰晶生成带,则冻结速率较快,形成的冰晶体积小、数量多且分布均匀,对组织细胞的破坏作用小,鱼肉解冻后则能较好的保持鱼肉的营养物质、口感和风味[4]。目前,对鱼的研究主要集中在保鲜[5-9]、冻藏温度和时间以及冻结方式对感官品质、理化性质、微观结构和质构方面的影响[10-12],而冻结方式对草鱼不同部位挥发性成分影响的研究报道较少。因此,研究冻结方式对不同部位草鱼肉风味物质的影响具有重要的意义。
电子鼻能识别简单和复杂的气味,可以客观地判断不同样品间的挥发性气味是否具有差异性。固相萃取整体捕集剂MonoTrap是集大表面积、硅胶、活性炭和十八烷基的特性为一体的多性能新型吸附剂,可用于极性和非极性以及高沸点和低沸点化合物的提取,这种吸附模式称之为整体材料吸附萃取(monolithic material sorptive extraction,MMSE),与常用的固相微萃取等传统吸附方式相比,MonoTrap具有更大的孔径和比表面积,对样品的吸附效率相对较高[13-14]。气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用技术是鉴定食品中挥发性物质最常用的方法,可对挥发性成分进行定性和定量分析。本实验以草鱼的背肉和红肉为研究对象,采用电子鼻和MMSE-GC-MS联用技术对经过不同方式冻结(-20 ℃快速冻结、-20 ℃酒精浸渍冻结、-20 ℃冰柜直接冻结)的不同部位草鱼肉的挥发性成分进行分析和鉴定,探讨不同部位草鱼肉在不同冻结方式处理条件下风味物质的种类和含量发生的变化,以期为草鱼的冷冻加工、贮藏和保鲜提供理论依据和技术指导,促进草鱼养殖业的发展。
1 材料与方法
1.1 材料与试剂
草鱼购于上海市临港新城古棕路农工商超市,每条鱼的体质量为2.5~3.0 kg;氯化钠、无水酒精(均为分析纯)上海国药集团化学试剂有限公司。
1.2 仪器与设备
7890A-5975C GC-MS联用仪 美国Agilent公司;热脱附器、多功能进样器、具有程序升温气化的冷却型进样口、玻璃衬管 德国Gerstel公司;MonoTrap RCC18(2.9 mm×5 mm,1 mm) 日本GL Sciences公司;FOX-4000电子鼻 法国Alpha MOS公司;DF-101S集热式恒温加热磁力搅拌器 巩义市予华仪器有限责任公司;DW-25W300低温冰箱 上海圣科仪器设备有限公司;SALD4-0.16F型低温实验箱 上海澳莹制冷设备有限公司。
1.3 方法
1.3.1 原料预处理
将6 尾草鱼即杀,去头、尾、皮、骨和内脏,清洗干净后,分别取其背肉和红肉,整形,切成3 cm×3 cm×2 cm的鱼块,将每种鱼块各自混合,沥干清洗鱼块时残留的水分后进行真空包装,鱼块单层平铺摆放,每袋鱼肉的质量约150 g。
1.3.2 冻结与解冻
将经过真空包装的样品随机分成4 份,分别按照以下方式进行处理:对照组:样品不经过冷冻处理,直接放入4 ℃冰箱贮藏8 h;速冻:将样品放入低温实验箱内进行快速冻结;酒精浸渍冻结:将样品放入经过-20 ℃冰箱预冷12 h的无水酒精中进行浸渍冻结;冰柜直接冻结:将样品放入-20 ℃冰箱中直接冻结。当背肉鱼块的中心温度降至-18 ℃时,结束冻结。将冻结后的样品放入4 ℃冰箱解冻8 h,用于挥发性成分的测定。
1.3.3 电子鼻分析
电子鼻样品:将各组解冻后的样品分别与0.18 g/mL的NaCl溶液按1∶1的质量比混合,匀浆后称取3 g样品装入10 mL的自动进样瓶中加盖待测,每组样品平行测定4 次。
电子鼻分析条件:载气为合成干燥空气;流速150 mL/min;顶空产生参数:产生温度50 ℃,产生时间600 s,搅动速率500 r/min;顶空注射参数:注射体积2 500 μL,注射速率2 500 μL/s;获得参数:获得时间120 s,延滞时间600 s。
1.3.4 GC-MS测定挥发性成分的条件
样品处理:将各组解冻后的样品分别与0.18 g/mL的NaCl溶液按1∶1的质量比混合,匀浆后称取5 g样品装入15 mL的自动进样瓶中加盖待测,每组样品平行测定3 次。
萃取条件:将4 个MonoTrap RCC18(简写为MT RCC18表示)用固定装置相连后,放入已称取好样品的顶空瓶中,使MT RCC18始终位于样品上方,在50 ℃的水浴温度条件下吸附50 min,待MT RCC18对草鱼肉中的挥发性成分完全萃取后,将其与固定装置分离,迅速装入热脱附管,由前处理平台(多功能进样器)将MT RCC18转移至热脱附器中进行热脱附。
GC条件:DB-5MS弹性毛细管柱(30 m×0.25 mm,1 μm);载气为He,流速1.2 mL/min;升温程序:起始柱温40 ℃,不保持;以5 ℃/min的速率升至100 ℃,不保持;再以2 ℃/min的速率升至180 ℃,不保持;最后以5 ℃/min的速率升至240 ℃,保持5 min。采用不分流模式,汽化室温度240 ℃。MS条件:电子电离源;电子能量70 eV,离子源温度200 ℃;传输线温度280 ℃;质量扫描范围m/z 35~450。热脱附器条件:不分流模式,起始温度60 ℃,以180 ℃/min的速率升至240 ℃,保持6 min。冷却型进样口条件:液氮制冷,起始温度-40 ℃,平衡30 s,以12 ℃/s的速率升至270 ℃,保持15 min。
1.4 数据处理
1.4.1 电子鼻数据分析
电子鼻中自带的Alphasoft V11统计分析软件对样品数据进行采集和处理,然后将数据进行主成分分析(principal component analysis,PCA)[15]。
1.4.2 GC-MS数据分析
定性:挥发性成分通过系统自带NIST 02和Wiley质谱数据库进行定性确认,且仅当正反匹配度均大于800(最大值为1 000)的化合物才予以报道[16-17]。另外,以C7~C40的正构烷烃作为标准品,利用标准品的保留时间计算出各个样品中化合物的保留指数,和文献中的保留指数进行对比,结合数据库的分析结果,共同对萃取出的挥发性化合物进行定性。
定量:通过面积归一化法求得各成分在不同样品挥发性成分中的相对含量;并对实验结果进行方差分析,数据由SPSS 21.0软件进行分析处理[18]。
关键风味化合物的确定:采用相对气味活度值(relative odor activity value,ROAV)法[19],定义对样品总体风味贡献最大的组分:ROAVstan等于100,对其他挥发性物质则按公式(1)计算:
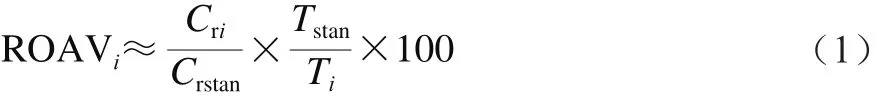
式中:Cri、Ti分别为各挥发性物质的相对含量/%和相应的感觉阈值/(μg/kg);Crstan、Tstan分别为对样品总体风味贡献最大组分的相对含量/%和相应的感觉阈值/(μg/kg)。
2 结果与分析
2.1 电子鼻检测结果
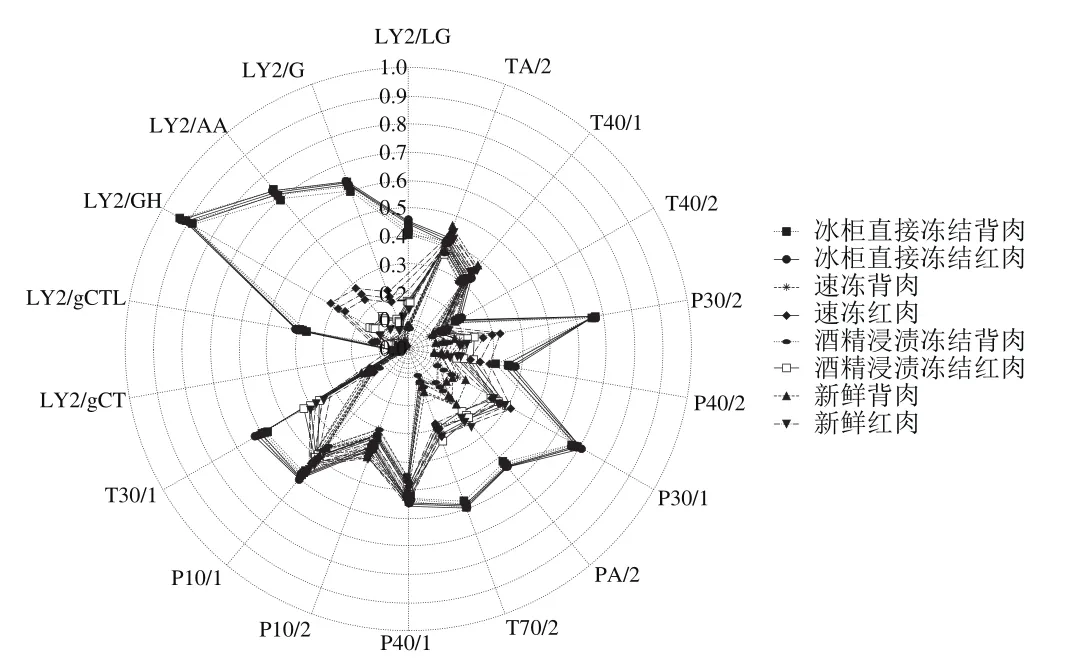
图1 不同冻结方式下草鱼肉电子鼻传感器响应值雷达图Fig.1 Sensor responses of E-nose to grass carp meat frozen by different methods
电子鼻可利用传感器阵列的响应曲线识别样品中的挥发性气味,对检测的气味进行判别和分析[20]。如图1所示,为了使样品间的差异性明显的表现在雷达图中,传感器的响应值要求在0.3以上,每组样品传感器的最大响应值都达到了0.45以上,符合电子鼻检测样品的响应值要求。每组样品的挥发性气味轮廓图之间具有差异性,冰柜直接冻结草鱼肉的气味轮廓图与其他样品具有明显的差异。LY2/gCT、LY2/gCTL和T40/2传感器响应值较低且各组间差异较小,TA/2、T40/1、P40/1和P10/2传感器响应值有所差异,P30/2、P40/2、P30/1、PA/2、T70/2和P10/1传感器响应值差异明显。因此电子鼻的传感器可以良好区分各组样品的挥发性气味。
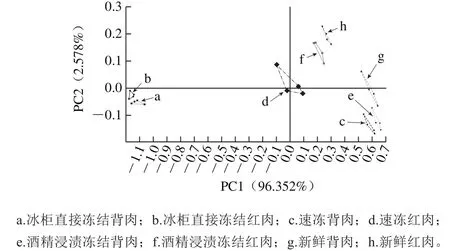
图2 不同冻结方式下草鱼肉挥发性气味PCA图Fig.2 PCA analysis of volatile fl avor compounds of grass carp meat frozen by different methods
PC1和PC2分别是PCA[21]转换中得到的第1主成分和第2主成分的方差贡献率,贡献率越大,说明此主要成分可以较好地反映原来多指标的信息,一般情况下,总贡献率超过85%为宜[22]。由图2可以看出,PC1为96.352%,PC2为2.578%,总方差贡献率为98.93%,说明PC1和PC2已经包含了原始数据的大量信息,PCA图可较好反映不同冻结方式下的草鱼背肉和红肉的挥发性气味。
判别指数(discrimination index,DI)是电子鼻数据统计软件进行PCA时提供的样品区分程度的表征值,通过计算各个组之间的表面积和每个组的表面积得到。DI在80~100之间表明区分有效,并且该值越大,表示区分效果越好[15,23]。图2显示DI为88,说明电子鼻可以有效区分经过不同冻结方式处理的草鱼背肉和红肉的挥发性气味。从图2可以看出,不同鱼肉样品之间无重叠,且在图2中的分布呈现一定的变化规律,说明草鱼肉经过冻结处理后,挥发性气味发生了一定的变化,且不同方式冻结对草鱼背肉和红肉挥发性成分的影响不同。8 组样品主要分布在3 个区域,冰柜直接冻结的样品与新鲜样品的距离最远,说明其气味与新鲜样品的气味差异最大,3 种冻结方式中冰柜直接冻结对草鱼风味影响最大;速冻和酒精浸渍冻结的草鱼背肉和红肉分别与新鲜样品的背肉和红肉的距离较近,说明速冻和酒精浸渍冻结的样品与新鲜样品的气味差异不显著,这2 种冻结方式对草鱼风味的影响较小。因此可以得出,经过不同冻结方式处理的草鱼肉气味具有明显差别。为深入探究冻结方式对不同部位草鱼肉挥发性成分的影响,采用MMSE-GC-MS对不同冻结方式草鱼挥发性风味成分进行定性和定量分析。
2.2 不同冻结方式草鱼肉挥发性成分分析
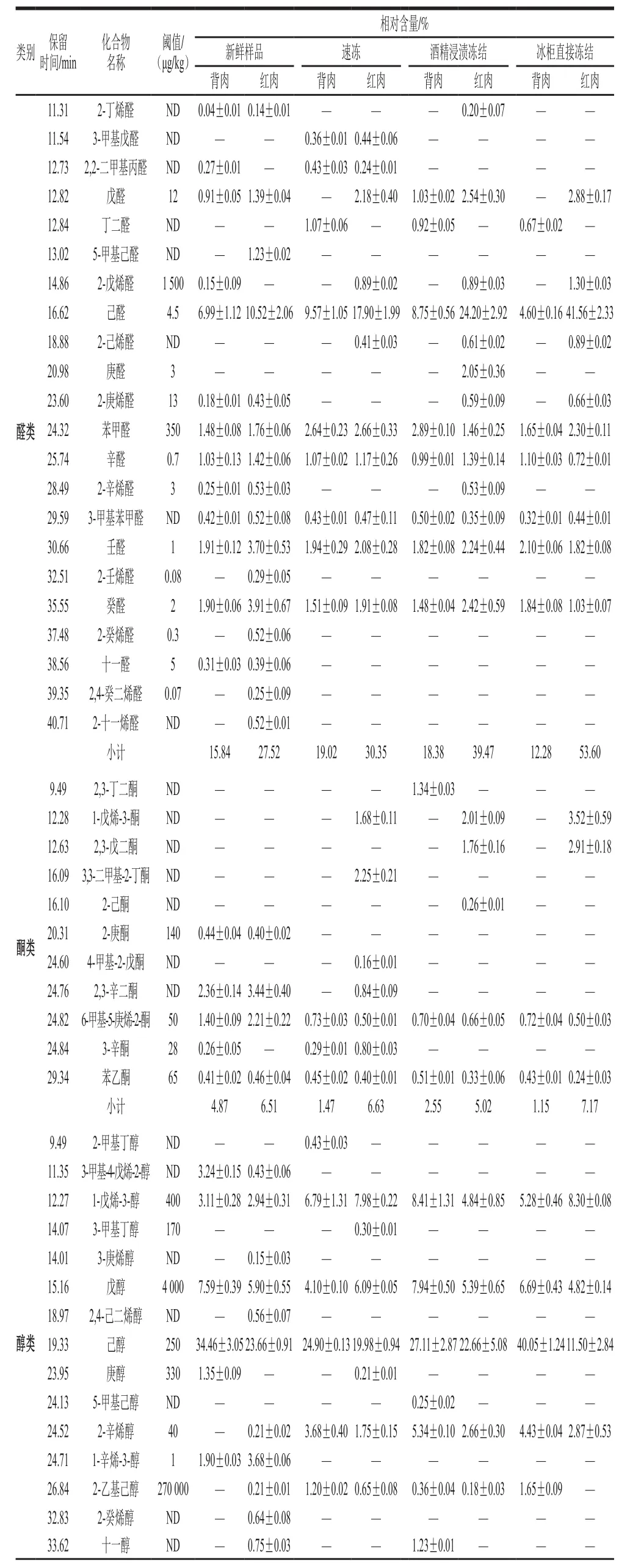
表1 冻结方式对草鱼肉挥发性成分的影响Table1 Inf l uence of freezing methods on volatile compounds of grass carp meat
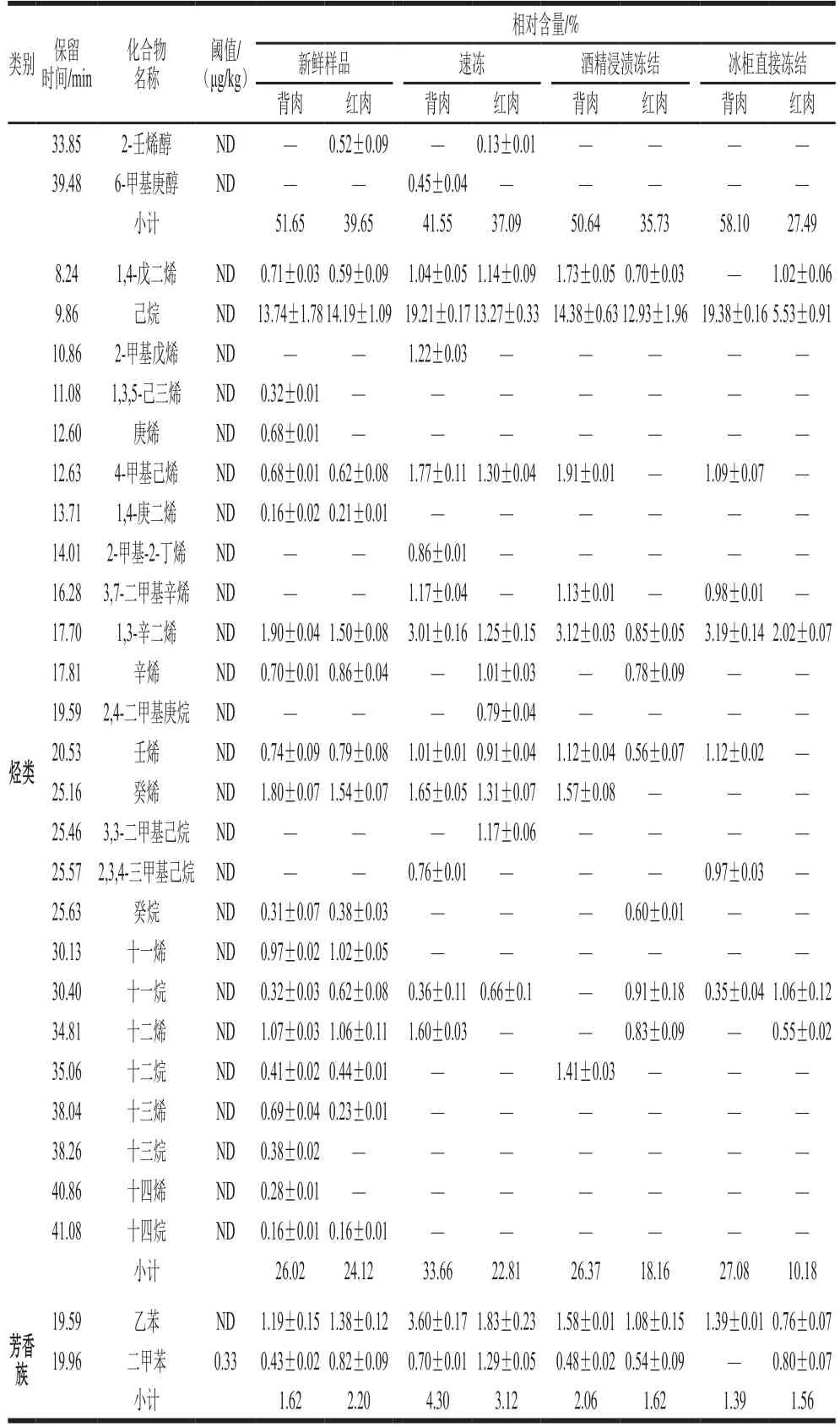
续表1
如表1所示,草鱼肉的挥发性风味物质主要由醛类、酮类、醇类和烃类构成,也含有少量的芳香族化合物。与新鲜草鱼肉相比,冷冻后的草鱼背肉和红肉的挥发性物质种类明显减少,并且随着冻结速率的降低,鱼肉中挥发性化合物的种类在逐渐减少,各个样品风味物质的组成和相对含量也存在一定的差异。这是由于低温抑制了脂肪酶、蛋白酶等内源酶的活性,导致一些酶解产物挥发性化合物的种类和含量的减少,另外,一些水溶性的蛋白质和脂肪等在鱼肉解冻时随着汁液流失,冻结速率越快,汁液流失越少,挥发性物质保留越好。挥发性物质的种类和含量与新鲜样品最相近的是速冻后样品,其次是酒精浸渍冻结的样品。可见,冻结方式对草鱼背肉和红肉的挥发性成分的种类和相对含量影响显著。
各挥发性成分对样品总体风味的贡献与其相对含量没有直接对应关系,而是由它在样品中的浓度和其感觉阈值的比值决定[24]。为进一步确定不同冻结方式下草鱼不同部位的关键风味化合物,根据表1中各种挥发性化合物的相对含量和其对应的感觉阈值,可以看出壬醛在新鲜样品的背肉和红肉以及冰柜直接冻结样品的背肉中相对含量较高,且其感觉阈值较低,仅为1 μg/kg,己醛在速冻样品、酒精浸渍冻结样品的背肉和红肉以及冰柜直接冻结样品的红肉中相对含量较高,且其阈值为4.5 μg/kg,也比较低,故它们对各自样品的总体气味贡献最大,所以定义新鲜样品的背肉和红肉以及冰柜直接冻结样品的背肉壬醛的ROAVstan等于100,速冻样品、酒精浸渍冻结样品的背肉和红肉以及冰柜直接冻结样品的红肉的己醛的ROAVstan等于100,其他挥发性化合物ROAV通过公式(1)进行计算,结果见表2。显然,所有组分0≤ROAV≤100,而且ROAV越大的组分对样品总体风味的贡献也越大。一般认为ROAV不小于1的物质为所分析样品的关键风味化合物,0.1≤ROAV<1的物质对样品的总体风味具有重要的修饰作用[19]。

表2 不同冻结方式下草鱼肉挥发性成分的ROAVTable2 Relative odor activity values of grass carp meat frozen by different methods
由表2可知,草鱼肉的关键风味化合物是戊醛、己醛、庚醛、辛醛、2-辛烯醛、壬醛、2-壬烯醛、癸醛、2-癸烯醛、十一醛、2,4-癸二烯醛、己醇、2-辛烯醇、1-辛烯-3-醇、二甲苯等。草鱼肉的主体风味成分主要由醛类和醇类物质构成,这些挥发性化合物对草鱼肉风味形成做出了重要贡献。
2.2.1 醛类化合物
鱼肉中含有的醛类物质的种类较多,含量较高,其感觉阈值较低,是鱼肉最主要的挥发性风味物质,对鱼肉总体风味的形成有重要的贡献。从新鲜草鱼、速冻、酒精浸渍冻结和冰柜直接冻结背肉中分别萃取出的醛类物质有13、9、8 种和7 种,相对含量分别为15.84%、19.02%、18.38%和12.28%。背肉中醛类化合物的种类逐渐减少,除新鲜背肉外,相对含量随着冻结速率的降低而降低,但种类和相对含量都差别不大。从新鲜草鱼、速冻、酒精浸渍冻结和冰柜直接冻结红肉中分别萃取出的醛类物质有16、11、13 种和10 种,相对含量分别为27.52%、30.35%、39.47%和53.60%。红肉中醛类化合物的种类逐渐减少,但冻结后醛类物质种类差别不大,相对含量随着冻结速率的降低而急剧增多,这可能是因为冻结速率越慢,对肌肉组织细胞破坏越大,脂肪氧化酶析出越多,脂肪氧化程度越高,氧化产生的醛类物质含量越高[25]。可见,冻结方式对草鱼红肉挥发性成分影响较大,而对背肉挥发性成分影响不显著。己醛是亚油酸自动氧化作用产生的13-氢过氧化物断裂后生成的物质[21],浓度较低时,具有清香和草香味,浓度较高时,具有酸败味和辛辣味[26]。各组样品中己醛是所有醛类化合物中相对含量最高的,尤其是各红肉组样品,其己醛相对含量远高于其他醛类,并且随着冻结速率的降低而升高。己醛的阈值较低,只有4.5 μg/kg,各组的ROAV都很高,对各组鱼肉的风味形成有重大贡献。辛醛、壬醛和癸醛在各组样品中均被检出,辛醛和壬醛是油酸氧化的产物[27],具有青草味和油脂味,壬醛还具有鱼腥味[28],癸醛呈现甜香和柑橘香[29]。辛醛、壬醛和癸醛在各样品中的相对含量都不高,但阈值较低,分别为0.7、1 μg/kg和2 μg/kg,因此它们的ROAV比较高,是各自样品的关键风味化合物。2-壬烯醛、2-癸烯醛和2,4-癸二烯醛仅在新鲜样品红肉中被检出,3 种方式冻结后的样品中均未被检出,这3 种物质在样品中的相对含量虽然很少,但它们的阈值极低,分别为0.08、0.3 μg/kg和0.07 μg/kg,相应的ROAV分别为97.97、46.85和96.53,因此这3 种物质对新鲜样品红肉风味形成有重要贡献。
2.2.2 酮类化合物
从表1可知,鱼肉挥发性成分中酮类物质种类少,相对含量也较低,其感觉阈值远高于其同分异构体的醛类[30],它们的ROAV几乎都小于1,对样品的气味形成贡献较小,但它对鱼肉的腥味有一定的增强作用,尤其是烯酮类的化合物[31]。速冻后样品含有酮类物质的种类和含量与新鲜样品差别最小。
2.2.3 醇类化合物
饱和醇类的感觉阈值很高,除非浓度较高,否则对样品风味形成贡献不大,不饱和醇类的阈值相对较低,对所在样品总体风味有一定贡献[32]。从新鲜草鱼、速冻、酒精浸渍冻结和冰柜直接冻结背肉中分别萃取出的醇类物质有6、7、7 种和5 种,相对含量分别为51.65%、41.55%、50.64%和58.10%。背肉中醇类化合物的种类差别不大,除新鲜背肉外,相对含量随着冻结速率的降低而升高,这可能是由于冻结速率越低,蛋白质变性程度和脂肪氧化程度会变大[25],而醇类物质主要来源于糖、氨基酸和醛类物质的还原和脂肪酸酶促氧化等[33],具体形成机理有待进一步深入研究。从新鲜草鱼、速冻、酒精浸渍冻结和冰柜直接冻结红肉中分别萃取出的醇类物质有12、8、5 种和4 种,相对含量分别为39.65%、37.09%、35.73%和27.49%,种类和相对含量都随着冻结速率的降低而降低。己醇是各组样品中相对含量最高的醇类,并且在背肉中的相对含量高于红肉,它具有青草味[34],从表2可以看出,它的ROAV相对较高,对各组样品风味形成有一定的贡献。1-辛烯-3-醇是由亚油酸的氢过氧化物降解产生的,具有蘑菇香和泥土的气味[35],只在新鲜样品的背肉和红肉中被检出。它的阈值较低,相应的新鲜背肉和红肉的ROAV很高,分别为99.48 μg/kg和99.46 μg/kg,对所在样品的风味形成有重要的贡献。
2.2.4 烃类和芳香族化合物
烃类化合物可能是来源于烷基自由基的脂质自氧化过程或类胡萝卜素的分解产物[15]。从表1可以看出,各样品中烃类物质的种类较多,相对含量较高,但由于其感觉阈值较高,故对样品总体风味形成贡献较小。另外,随着冻结速率的降低,背肉中烃类物质种类降低,含量差别不大,红肉中烃类物质种类和相对含量都降低。在各样品中还检出了乙苯和二甲苯,它们可能来源于鱼所生存的环境,由环境污染物转移到鱼体内的。它们会使鱼肉产生令人不愉快的气味。各样品中二甲苯的相对含量较低,但其阈值较低,从表2可知其ROAV较高,因此会对各样品的风味形成造成很不好的影响。
3 结 论
3 种冻结方式中,速冻能使草鱼肉快速的通过最大冰晶生成带,可最大程度保持鱼肉的鲜度品质。电子鼻可以有效区分新鲜和不同冻结方式处理的草鱼背肉和红肉的挥发性气味。冰柜直接冻结样品的气味与新鲜样品的气味差异最大,3 种冻结方式中冰柜直接冻结对草鱼风味影响最大。随着冻结速率的降低,萃取出的背肉和红肉中挥发性物质种类减少,背肉中醛类物质的相对含量呈降低的趋势,醇类物质的相对含量呈增高的趋势,红肉中醛类物质的相对含量急剧增加,醇类物质相对含量呈下降的趋势。3 种冻结方式中与新鲜样品挥发性物质的种类和含量最接近的是速冻后的样品,差异最大是冰柜直接冻结样品。综合可知,3 种冻结方式中,速冻更有利于保持冻结草鱼肉的品质,使冻结后草鱼肉的风味接近于新鲜鱼肉,其次是酒精浸渍冻结。

