洋葱伯克氏菌Burkholderia contaminans抗菌蛋白分离纯化及生物学特性分析
张婧婷,施俊凤*,范三红,*
(1.山西大学生命科学学院,山西 太原 030006;2.山西省农业科学院农产品贮藏保鲜研究所,山西 太原 030031)
果蔬采后病害的发生是导致其产后损失的主要原因,目前化学杀菌剂的使用仍是减少病害的主要措施[1]。但是化学杀菌剂容易引起残留污染、病原菌产生抗药性、以及对动物和人体健康产生威胁等一系列问题[2]。利用拮抗微生物进行果蔬产后防治具有很好的前景[3],引起世界各国科学家的广泛关注[4]。
洋葱伯克氏菌群是一类基因型不同、表型相近的菌株复合群[5-6],广泛存在于土壤、水和植物根际,具有生物防治、生物降解、促进植物生长等多种功能[7-9]。洋葱伯克氏菌(Burkholderia contaminans)对梨青霉病(Penicillium expansum)[10]、香蕉炭疽病(Colletotrichum musae)[11]、甜樱桃褐腐病(Sclerotinia laxa)[12]和葡萄灰霉病(Botrytis cinerea)[13]等各种采后病害具有生物防治效果。本实验室筛选的洋葱伯克氏菌,研究表明其不仅可以有效防止葡萄、草莓、番茄等果实的采后腐烂,而且对果蔬采后常见病原真菌有较好的抑制作用[14]。本实验研究该菌株抗菌蛋白分离纯化的方法,并探究其生物学性质,不仅能够开发新的微生物资源,而且为克隆基因表达蛋白,构建转基因工程菌提供一定理论支撑。
1 材料与方法
1.1 材料与试剂
拮抗菌洋葱伯克氏菌(B. contaminans)B-1菌株由本实验室从杏果实表面分离,并根据核糖体26S D1/D2区和ITS区核甘酸序列比对及生理生化特性鉴定。B-1发酵培养基YSP[15]:蛋白胨10 g,酵母膏5 g,葡萄糖10 g,蒸馏水1 000 mL,pH 7.0。
病原菌灰葡萄孢霉(B. cinerea):从发病葡萄果实分离,并通过ITS区进行鉴定。PDA培养基[16]的配制用于病原菌活化及活性检测,配方为马铃薯200 g(小块煮取汁),葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0。
透析袋(截留相对分子质量8 000~14 000)、纤维素DE-52、Sephadex G-100葡萄糖凝胶 北京Solarbio科技有限公司;过硫酸铵 美国Sigma公司;四甲基乙二胺美国Ameresco公司;标准蛋白Marker 北京艾德莱生物科技有限公司;其余试剂为国产分析纯。
1.2 仪器与设备
GL-20G-II离心机 上海安亭科学仪器厂;XO-650D超声波细胞破碎仪 南京先欧仪器制造有限公司;TH-500梯度混合器、DHL-A电脑数显恒流泵、DBS-100D电脑全自动部分收集器 上海沪西分析仪器厂有限公司;DYVZ-24DN电泳槽、DYY-2C电泳仪北京六一仪器厂。
1.3 方法
1.3.1 蛋白质含量的测定
以牛血清白蛋白作为标准,蛋白含量的测定采用Bradford染色法[17]。
1.3.2 抑菌活性的检测
采用双层琼脂扩散法[18]测定抑菌活性,无菌琼脂打底,放入牛津杯,倒入混有灰葡萄孢子(1×105CFU/mL)的培养基,形成带孔平板,每孔加200 μL待测液体。26 ℃恒温培养5 d,十字交叉法测量抑菌圈直径,每个处理重复3 次。
1.3.3 B-1抗菌蛋白的粗提
菌种B-1活化后以1%接种量至发酵培养基YSP中发酵(28 ℃,200 r/min)培养24 h后,于4 ℃、10 000 r/min离心20 min,弃上清液,收集菌体沉淀,用磷酸缓冲液洗涤多次,加入原菌液体积的1/5~1/10的裂解液冰浴超声裂解(300 W,10 s/10 s,20 min)。裂解液中加入硫酸铵粉末至10%饱和度,4 ℃静置过夜,4 ℃、10 000 r/min离心20 min,收集上清液和沉淀,上清液参考1.3.1节测定蛋白含量,沉淀参考1.3.2节检测活性。
按同样的方法在上清液中加入硫酸铵至饱和度为0%、20%、30%、40%、50%、60%、70%、80%、90%、100%,确定饱和度范围。
收集蛋白沉淀,充分透析除盐,BaCl2饱和溶液检查透析是否完全[19],冷冻干燥浓缩除菌,使其最终质量浓度为1.5 mg/mL。
1.3.4 纤维素DE-52离子交换层析
取5 mL粗蛋白溶液上样于经0.05 mol/L、pH 7.1的Tris-HCl缓冲溶液平衡后的DE-52离子交换层析柱,用0~2 mol/L NaCl的Tris-HCl(0.05 mol/L、pH 7.1)缓冲溶液梯度洗脱,洗脱速率为1.5 mL/min,每管收集5 mL。收集洗脱液,以管子数目为横坐标,吸光度(A280nm)为纵坐标,绘制洗脱曲线。收集每个洗脱峰,将每个洗脱峰经PEG-6000浓缩、透析除盐、0.22 μm过滤器除菌,配成质量浓度为1 mg/mL的蛋白溶液,参照1.3.2节进行活性检测,对活性较强的组分进行进一步的纯化。
1.3.5 G-100葡聚糖凝胶层析
将抗菌活性强的蛋白粗提液经过葡聚糖凝胶层析柱G-100,上样量为2 mL,洗脱液为Tris-HCl(0.05 mol/L、pH 7.1)缓冲溶液,洗脱速率为0.5 mL/min,每管收集2 mL。将收集到的各个洗脱峰按照1.3.4节绘制洗脱曲线。参照1.3.2节检测活性。将有活性的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)检测。1.3.6 SDS-PAGE
参照Laemmli等[20]方法,配制12%的分离胶和5%的浓缩胶,5 μL样品与15 μL的4×loading buffer沸水浴煮沸5 min,将样品和标准样品同时电泳,浓缩胶电压为80 V,待溴酚蓝指示剂进入分离胶,将电压调至120 V,待电泳结束后剥胶,染色脱色拍照,并根据条带进行分析。
1.3.7 B-1抑菌物质特性的测定
1.3.7.1 热稳定性
将1.3.3节的粗蛋白溶液分别置于30、40、50、60、70、80、90、100 ℃处理30 min,未经处理的蛋白溶液作为对照[21]。参照1.3.2节测定活性。
1.3.7.2 pH值稳定性
用2 mol/L的NaOH和HCl溶液,分别调节1.3.3节的粗蛋白溶液pH值为2、3、4、5、6、7、8、9、10、11、12,室温静置24 h,未经处理的蛋白溶液作对照[22]。参照1.3.2节测定活性。
1.3.7.3 有机试剂敏感性
参考纪兆林等[23]方法,取1.3.3节的粗蛋白溶液,按体积比1∶1分别加入甲醇、乙酸乙酯、石油醚、氯仿、正己烷摇匀静置放4 h,若不分层直接浓缩,若分层分别旋转蒸发,混合上下浓缩液,使各个浓缩液体积一致,未经处理的蛋白溶液作对照。参照1.3.2节测定活性。
1.3.7.4 蛋白酶敏感性
参考Franco等[24]方法,向1.3.3节粗蛋白溶液中加入不同蛋白酶(胃蛋白酶、木瓜蛋白酶、蛋白酶K),使蛋白酶最终质量浓度为1 mg/mL,28 ℃水浴2 h,70 ℃水浴3 min使酶失活,未经处理的粗蛋白作对照。参考1.3.2节测定活性。
1.3.7.5 紫外线敏感性
取5 份1.3.3节粗蛋白溶液于40 W紫外灯下距离20 cm分别辐照10、30、60、90、120 min,未经处理的蛋白溶液为对照。参照1.3.2节测定活性。
1.3.7.6 常见试剂敏感性
参考Turgism等[25]方法,配制5、50 mg/mL的Tween-80、SDS、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、二硫苏糖醇(dithiothreitol,DTT)和巯基乙醇,分别取20 µL与180 µL粗蛋白溶液混匀,28 ℃水浴2 h,未经处理的蛋白溶液作对照。参照1.3.2节测定活性。
1.4 数据分析
实验数据采用Origin 85和Excel 2007软件进行处理分析,Duncan’s多重比较进行差异显著性检验。
2 结果与分析
2.1 硫酸铵饱和度的确定
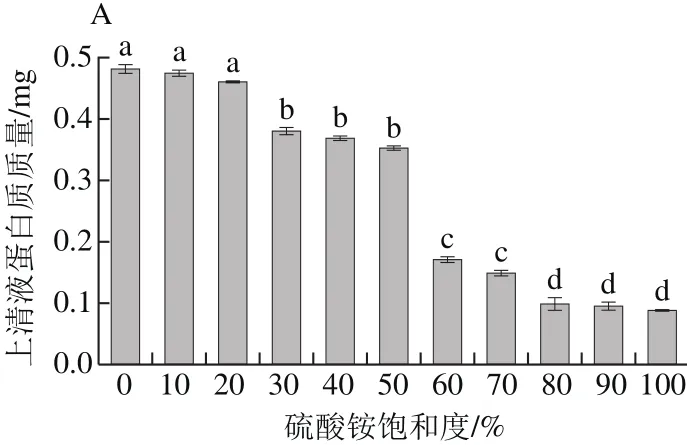
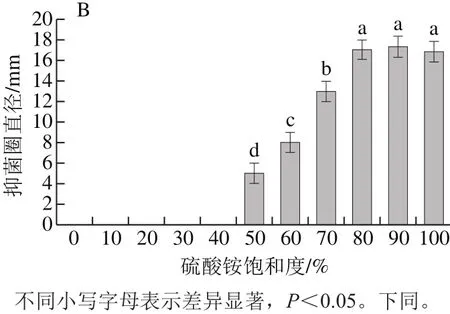
图1 不同饱和度上清液蛋白质质量(A)及沉淀抑菌活性(B)Fig.1 Protein content (A) in supernatants after ammonium sulphate precipitation at different degrees of saturation and antimicrobial activity (B) of protein
从图1A可以看出,经过硫酸铵沉淀,上清液中的蛋白逐渐被沉淀下来。当硫酸铵饱和度为10%和20%时,上清液蛋白质质量很高,与0%相比无明显差异(P>0.05);当饱和度为30%~50%时,与对照组有显著性差异(P<0.05)。当硫酸铵饱和度进一步增加到80%时,上清液蛋白质质量仅为0.107 mg,当饱和度继续增加到100%,虽然上清液蛋白质量有所降低,但与80%无明显差异(P>0.05)。从图1B可看出,当硫酸铵饱和度为0%~40%时,沉淀无活性;当饱和度为50%~80%时,随着硫酸铵饱和度的增大,抑菌圈也增大,且差异显著(P<0.05),饱和度为80%时,抑菌圈直径大小为17 mm,但是随着饱和度的增加,沉淀抑菌圈直径差异不明显(P>0.05)。综合考虑,选择80%饱和度的硫酸铵沉淀蛋白。
2.2 纤维素DE-52离子交换层析和G-100葡聚糖凝胶层析结果
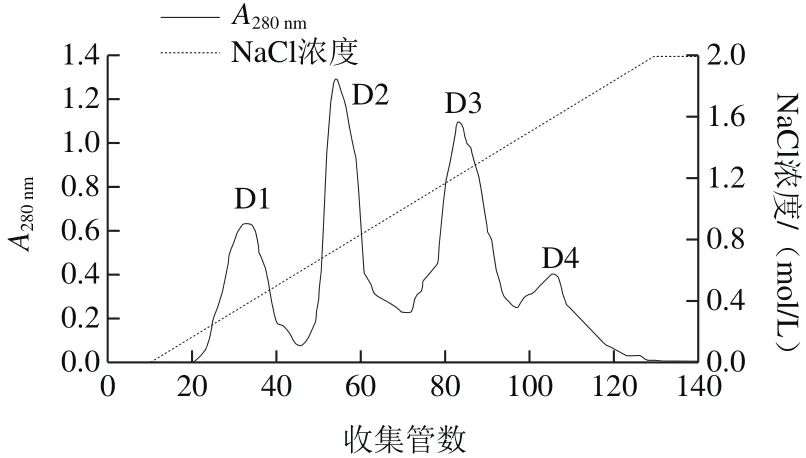
图2 纤维素DE-52离子交换层析Fig.2 DEAE-cellulose DE-52 ion exchange chromatography
初始阶段,用缓冲溶液充分洗脱,使A280nm小于0.02,并且保持恒定,再用含有NaCl的缓冲溶液线性缓冲。洗脱曲线如图2所示,粗蛋白经过纤维素DE-52离子交换层析,最后得到4 个蛋白峰,分别命名为D1、D2、D3和D4,收集各部分经活性检测,D2具有活性,其余无活性。将D2收集浓缩进一步用G-100进行葡聚糖凝胶层析,分子筛层析结果曲线如图3所示,分离得到3 个蛋白峰,分别命名为G1、G2、G3,经活性检测,G3有活性,G1和G2没有活性。
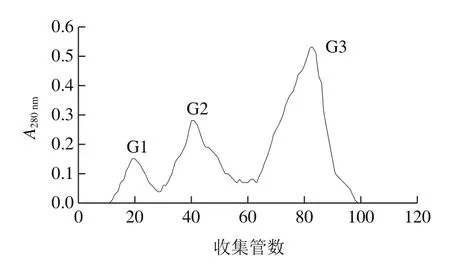
图3 Sephadex G-100分子筛凝胶过滤层析Fig.3 Sephadex G-100 gel fi ltration chromatography
图4A为经离子交换层析得到各部分蛋白峰抑菌活性结果,分离得到的4部分蛋白峰,其中D2具有明显的抑菌活性,其抑菌圈直径为18 mm。图4B为D2经葡聚糖凝胶层析得到的结果,层析后得到3部分蛋白峰,经抑菌活性检测看出,G3具有抑菌活性,抑菌圈直径为16 mm。
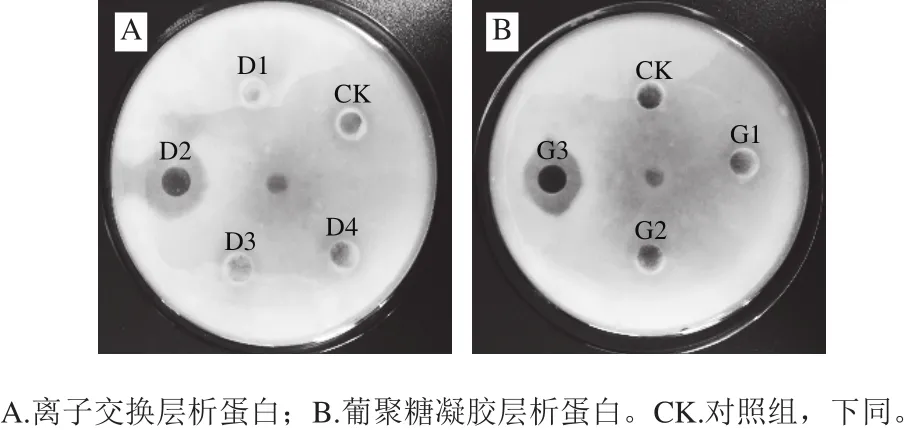
图4 各个蛋白峰对灰霉菌的抑制效果Fig.4 Antifungal effect of all protein fractions against Botrytis cinerea
2.3 B-1抗菌蛋白分离纯化结果
通过计算分离纯化每步蛋白质的质量,从表1可以看出,经硫酸铵沉淀得到7.5 mg粗蛋白溶液,最后可得到1.76 mg的目的蛋白,其得率为23.40%。
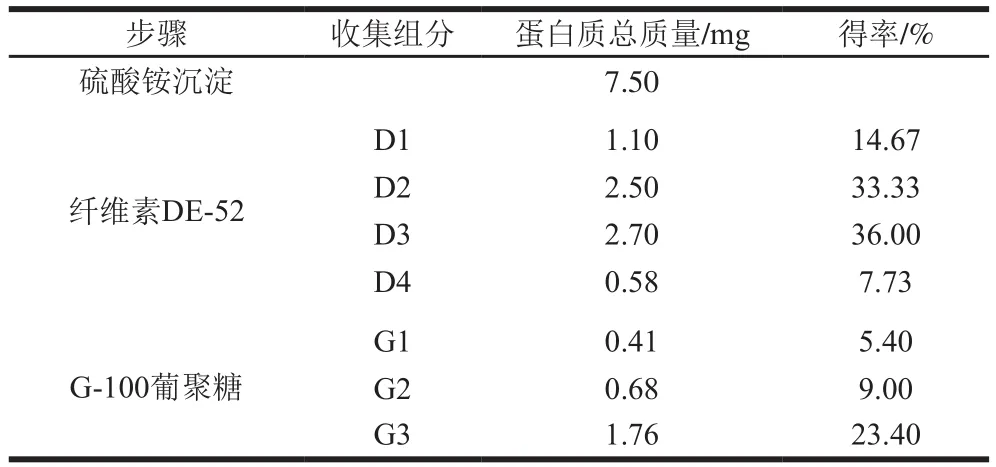
表1 B-1抗菌蛋白分离纯化及其得率Table1 Puri fi cation steps of antifungal protein from B-1
2.4 SDS-PAGE分析结果
从图5可看出,经过每一步的分离纯化,杂蛋白含量越来越低。经80%的硫酸铵沉淀得到的蛋白中,蛋白种类非常多,经过纤维素DE-52离子交换层析后,大部分杂蛋白被去除,在经过分子筛层析后得到了一条达到电泳纯的抗菌蛋白,同标准蛋白比较,该抗菌蛋白分子质量约为17.6 kDa。
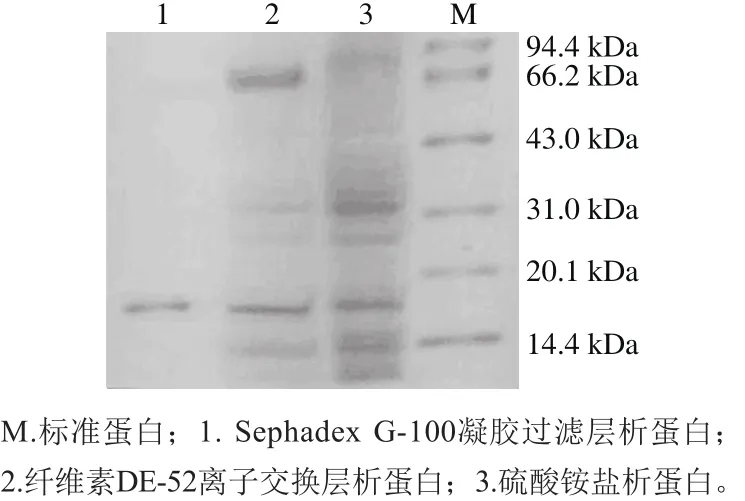
图5 SDS-PAGE图谱Fig.5 SDS-PAGE prof i les
2.5 粗蛋白的热稳定性结果
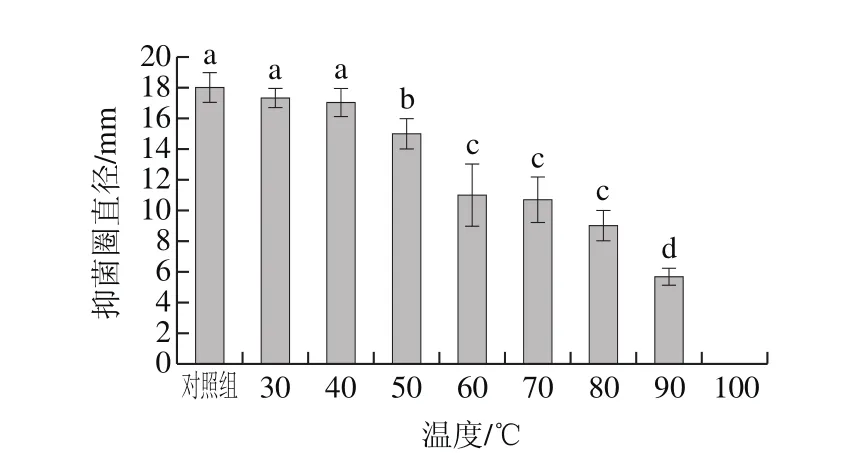
图6 温度对抑菌物质的影响Fig.6 Inf l uence of temperature on stability of antimicrobial protein
如图6所示,蛋白溶液在30 ℃和40 ℃处理30 min时,其活性与对照组相比无显著差异(P>0.05)。80 ℃处理30 min后,虽然抑菌活性有所下降,但仍为对照组的54.56%。说明该蛋白具有一定的耐热性。
2.6 粗蛋白的pH值稳定性结果

图7 pH值对抑菌物质的影响Fig.7 Inf l uence of pH on stability of antimicrobial protein
如图7所示,该抑菌物质对酸碱的耐受性较强,pH 3~11下均有抑菌活性。pH 3时,抑制率为最适条件下的51.97%,pH 11时,抑菌率为29.44%。蛋白活性最强的pH值范围为5~7,表明该蛋白在偏酸性及中性条件下稳定性较好。
2.7 粗蛋白对有机试剂、蛋白酶和紫外线的敏感性结果
粗蛋白溶液经有机试剂、蛋白酶和紫外照射处理后结果如表2所示,与对照组相比,均未有显著性差异(P>0.05),说明该抑菌物质对有机试剂、蛋白酶及紫外照射不敏感。图8为抑菌物质对有机试剂和蛋白酶敏感性的效果图。
表2 抑菌物质对有机溶剂、蛋白酶和紫外照射的敏感性Table2 Sensitivity of antimicrobial protein to organic solvents,proteases and UV irradiation
图8 抑菌物质对有机试剂(a)和蛋白酶(b)敏感性的效果图Fig.8 Inhibition zones of antimicrobial protein in the presence of organic solvents (a) and proteases (b)
2.8 粗蛋白对常见试剂的敏感性
分别采用5 mg/mL和50 mg/mL两个质量浓度的试剂处理,由表3可知,Tween-80、EDTA和SDS与对照组相比无显著性差异(P>0.05),而DTT和巯基乙醇则差异很大(P<0.05)。采用DTT和巯基乙醇低质量浓度处理时,蛋白仍具有轻微的抑菌作用,而当质量浓度增加时,抑菌活性丧失。DTT和巯基乙醇是常用的还原剂,可能会破坏蛋白结构,使其活性丧失。Tween-80在质量浓度为50 mg/mL时,抑菌物质活性增强了12.5%。
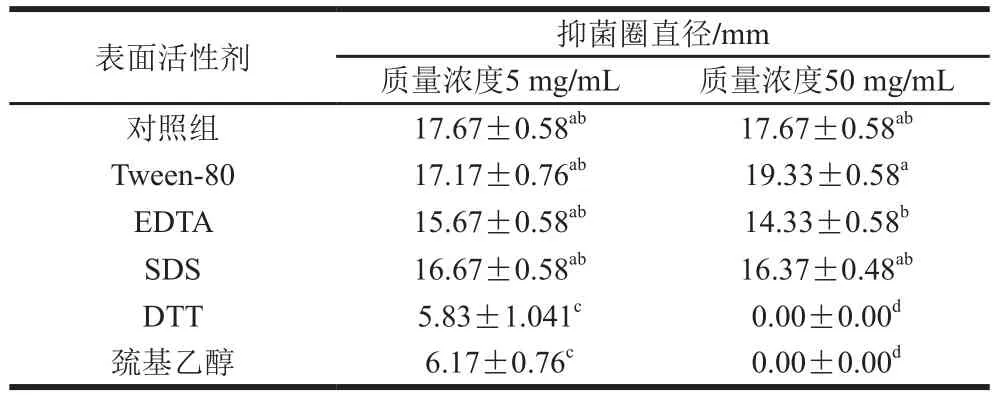
表3 抑菌物质对表面活性剂敏感性Table3 Sensitivity of antimicrobial protein to surfactants
3 讨 论
洋葱伯克氏菌在农业领域中具有生物防治、生物降解以及促进植物生长等多种功能,有广泛的应用前景[26-27]。其可产生硝吡咯菌素、吩嗪、嗜铁素、Cepaciamide A等多种次生代谢物质[28-29],硝吡咯菌素是可以阻断病原菌呼吸链中脱氢酶和细胞色素之间电子传递。有研究表明洋葱伯克氏菌还可产生降解水源污染物三氯乙烯的酶[30]。权春善等[31]从洋葱伯克氏菌上清液中分离纯化出对多种病原菌具有抑菌活性的环二肽。洋葱伯克氏菌株AMMDR1[32]使豌豆种子细菌化后,腐霉菌游动孢子对豌豆幼苗侵染率及卵孢子在根部定殖率大大降低,而产抗生素基因的缺失突变株不能抑制腐霉菌对豌豆的侵染,表明产生抗生素是Bcc菌株生物防治机制之一。Deng Peng等[33]从土壤中分离到菌株B. contaminans MS14,可抑制草坪褐斑病,并从菌株中分离纯化到一种抗真菌糖肽Occidiofungin,该环状糖肽化合物包含8 个氨基酸残基,一个氨基酸上连接酰基和木糖,它可使真菌细胞内部和形态发生畸变,且对多数病原真菌具有抑制作用。
本实验以灰葡萄孢霉为指示菌,对B. contaminans B-1抑菌物质纯化过程进行抑菌活性追踪,前期实验确定B-1发酵液的上清液无任何抑菌活性,菌悬液与发酵液的抑菌活性无显著性差异,通过裂解菌体,从裂解液提取到有抑菌活性的蛋白,该抗菌物质可能为一种胞内蛋白,测得该蛋白分子质量约为17.6 kDa,之前的文献鲜见报道,故推测该抗菌蛋白可能为一种新蛋白。
基因组和蛋白组的发展促进抗菌蛋白分子和基因工程的研究应用,将来可通过对此抗菌蛋白进行序列分析,克隆抗菌蛋白基因,构建生防工程菌。因此以抗菌蛋白作为防治植物病害的新型生防因子具有巨大的应用前景。

