婴幼儿配方羊乳粉生产环节蜡样芽孢杆菌分离株多位点序列分型分析
刘 阳,葛武鹏,*,张 静,郭春锋,梁秀珍,王 智,张兴吉,王 瑞
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西省飞天乳业有限公司,陕西 宝鸡 721100;3.陕西百跃优利士乳业有限公司,陕西 咸阳 712000)
蜡样芽孢杆菌属由多个生理生化特性高度相似的革兰氏阳性菌群组成,主要包括蜡样芽孢杆菌(Bacillus cereus)、炭疽芽孢杆菌(B. anthraics)、蕈状芽孢杆菌(B. mycoides)、假蕈状芽孢杆菌(B. pseudomycoides)、苏云金芽孢杆菌(B. thuringiensis)、细胞毒素芽孢杆菌(B. cytotoxicus)、图瓦永芽孢杆菌(B. toyonensis)及韦氏芽孢杆菌(B.weihenstephanensis)8 种[1-2]。其中B. cereus因产高黏附能力的孢子而在自然界中广泛存在,是一种易引起人畜共患疾病的病原菌[3],主要代谢物有呕吐毒素、细胞毒素K、溶血性肠毒素BL和非溶血性肠毒素等,可引起呕吐、腹泻等临床症状,在中国因其引发的食物中毒事件总量仅次于沙门菌,婴幼儿等低免疫人群感染后可诱发心膜炎、菌血症和脑膜炎等并发症,甚至危及生命[4-7]。乳粉生产工艺中的巴氏杀菌、超高温瞬时杀菌、浓缩、喷雾干燥等环节可确保杀灭蜡样芽孢杆菌等所有致病微生物的菌体细胞,但具有耐热特性的孢子极易在特定条件下萌发,转为繁殖细胞,使其代谢产物在终产品中存在而诱发食源性疾病[8-9]。在食品安全管控中生物性危害在各国均是最为严苛的,在我国各类食品中亦有严格限量规定,特别是婴幼儿配方食品[10-11]。我国规定不同食品中蜡样芽孢杆菌的菌落总数应小于103~105CFU/g(CFU/mL),并且其在婴幼儿配方食品中作为致病风险指标也是主要监控的生物性危害之一[12-13]。近年来有关B. cereus的研究主要集中在粮食类餐食方面,如有学者[14-15]研究了炒米饭和大米分离株的毒力基因、致病机理、基因进化关系,有关婴幼儿配方食品的研究大多体现在对其分离株及其毒力基因表达上,而关注于生产加工环节的研究偏少,特别是对于羊奶粉加工环节得到的分离株基因进化关系的研究更是鲜见报道[16]。
随机扩增多态性DNA(random amplification polymorphic DNA,RAPD)采用一条随机引物进行基因扩增,可用于较大样本量的初步分型,但无法得到分离株之间的基因进化关系[17-19]。多位点序列分型(multiple locus sequence typing,MLST)是一种基于7 个管家基因的分子分型技术,其采用双向测序以得到精确、分辨率较高的结果,运用非加权平均数(unweight pair-group method using arithmetic averages,UPGMA)、基于相关序列(based upon related sequence types,BURST)等算法对结果进行分型分析,且建有实现数据全球共享的平台——MLST国际数据库(PubMLST Database)[20-22]。该数据库涵盖了B. cereus、金黄色葡萄链球菌(Staphylococcus aureus)、白色念珠菌(Candida albicans)等108 种微生物以及噬菌体、质粒的MLST方案,其中B. cereus的PubMLST Database建立于2004年,实现了不同国家、不同地区、不同实验室实验结果的比对和溯源性分析,使得临床和食源性分离株的遗传多样性得到广泛研究[6,23]。本实验对经RAPD初步分型得到的42 株B. cereus进行MLST分型分析,探究出婴幼儿配方羊乳粉加工生产环节得到的分离株的基因多样性和系统进化关系,为其溯源和有效防控提供了参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
2016年7月—2016年11月于陕西省A、B、C三家羊乳粉厂采集婴幼儿配方粉各生产环节及工厂周边土壤样共计970 份,聚合酶链式反应(polymerase chain reaction,PCR)分子鉴定得到B. cereus分离株350 个,保存于-80 ℃冰箱备用。
本实验的质控菌株为B. c e r e u s标准菌株CGMCC1.1846。
1.1.2 MLST分型菌株的来源
采用RAPD技术对350 株阳性菌初步分型,聚类分析后得到8 个独立株和12 簇(相似度≥95%),将所有独立株(8 个)和随机选取各簇的3 株菌(34 个)进行MLST基因分型。本研究所用的分离株是经RAPD初步分型得到的。
1.1.3 培养基与试剂
胰酪胨大豆多黏菌素肉汤基础、甘露醇卵黄多黏菌素(MYP)琼脂基础、胰蛋白胨大豆琼脂(TSA)、脑心浸液肉汤(BHI) 北京陆桥技术有限公司。
多黏菌素B、50%卵黄液 北京陆桥技术有限公司;乙二胺四乙酸、Tris 美国Sigma公司;琼脂糖美国HydraGene公司;PCR Premix Taq、引物 日本Takara公司;DuRed核酸染料 北京泛博生化有限公司。
1.2 仪器与设备
T100TMThermal Cycler PCR仪、GEL DOC XR凝胶成像仪 美国Bio-Rad公司;SB4200DT移液器 德国Eppendorf公司;SW-CJ-2D超净工作台 苏州净化设备有限公司;DH-500电热恒温培养箱 北京科伟永兴仪器有限公司;DYY-6C电泳仪 北京市六一仪器厂。
1.3 方法
1.3.1 分离株DNA的提取
将保存的B. cereus分离菌株接种于BHI培养基于30 ℃过夜振荡培养(转速180 r/min),取2 mL培养好的菌悬液于无菌离心管以5 000×g离心5 min,弃上清液,加1 mL TE缓冲液重悬,将重悬液以5 000×g离心5 min,弃上清液后再取100 μL TE缓冲液重悬,100 ℃热裂解20 min,裂解后立即冰浴10 min,再以13 000 r/min的转速离心10 min,收集上清液即为DNA模板,于-20 ℃保存备用[25]。
1.3.2 MLST基因分型
根据PubMLST Databases中B. cereus的MLST方案(http://pubmlst.org/bcereus/info/primers.shtml),对初步分型得到的42 株目标菌的7 个管家基因进行扩增测序,从而得到相应的序列类型。
1.3.2.1 管家基因片段扩增
B. cereus的7 个管家基因的扩增引物如表1所示。

表1 B. cereus管家基因Table1 Seven house-keeping genes of B. cereus
反应体系5 0 μ L:D N A模板5 μ L,PCR Premix Taq 25 μL,正向引物和反向引物各1 μL(终浓度0.2 μmol/L),超纯水18 μL。扩增反应条件为:95 ℃预变性3 min;95 ℃变性30 s,56~59 ℃退火1 min,72 ℃延伸30 s,共35 个循环;72 ℃延伸10 min,终产物4 ℃保藏。取扩增产物于1.5%的琼脂糖凝胶进行110 V恒压电泳35 min,在凝胶成像系统中得到DNA指纹图谱,将成像结果是目标条带单一清晰且无非特性杂带的扩增产物送至生工生物工程(上海)有限公司进行双向测序。
1.3.2.2 等位基因及基因序列的上传比对
将7 个管家基因的正反双向引物扩增产物的测序结果进行拼接并上传至PubMLST Database进行基因序列比对,得到相应的Aelle ID,将比对过的7 个等位基因序列号上传后得到相应的序列类型MLST profiles。对于有基因变异和多态性位点变异的序列,向数据库提交新序列分离株的信息并申请分离株号(PubMLST ID),申请并提交相应的新型基因的验证信息,得到新型的等位基因和序列类型。
1.3.2.3 MLST克隆复合物(clonal complex,CC)的聚类分析
使用BioNumerics vision 7.6处理42 株分离株的等位基因和序列类型,建立最小生成树,同时按照UPGMA算法构建聚类树,分析其遗传进化关系。
1.4 数据处理
使用BioNumerics version 7.6完成序列的拼接和与已上传数据的序列比对,得到不同的ST型,以UPGMA法建立不同ST型的聚类树;将本研究得到的分离株基因序列与国际数据库PubMLST Database中的基因序列比对分析,采用在线BURST(n-4)算法进行分离株CC的聚类分析,使用Phylo Tree建立系统进化树。
2 结果与分析
2.1 管家基因PCR结果

图1 B. cereus七个管家基因的凝胶成像图Fig.1 PCR amplif i cation of house-keeping genes from B. cereus isolates
不同管家基因的特异性引物进行PCR反应后的产物凝胶成像如图1所示,特异性引物均能扩增出单一清晰的目标条带。MLST方案中有3 个备选引物,刘勇[15]使用备选引物ilvD_2(F:5’-AGATCGTATTACTGCTACGG-3’;R:5’-GTTACCATTTGTGCATAACGC-3’)对大米中致吐型B. cereus进行MLST分型扩增,而本研究只使用基于基本方案的引物进行扩增,主要原因可能是前者研究的目标基因是呕吐型毒素,而ilvD_2是针对产呕吐毒素分离株设计的特异性引物。Li Fan等[25]研究表明不同的食物得到的分离株具有不同的毒力基因,而我国食源性B. cereus分离株的毒力基因主要是肠毒素基因。由此初步推断陕西省婴幼儿配方羊乳粉生产链中的B. cereus分离株没有产呕吐素的典型基因。
2.2 MLST分型结果

图2 42 株B. cereus分离株ST型聚类树Fig.2 Clustering dendrogram of 42 B. cereus isolates
42 株分离株MLST分型的结果如图2所示,共7 个ST型,分别为ST-1348、ST-1349、ST-1350、ST-1351、ST-1084、ST-1000和ST-770,其MLST CC有142、205和23三种。4 个成品粉分离株的基因型为ST-1084,其余2 个为ST-1000。Yang Yong等[16]采用MLST技术对中国婴幼儿食品B. cereus分离株分型,得出ST-1062的菌株为中国羊乳特征分离株,而本研究的分离株并没有得到具有此基因型的菌株;与此同时,本实验所用的原料羊乳样品经分离鉴定后,发现其污染率为0%(0/15),因此可排除原料羊乳是婴幼儿配方羊乳粉污染B. cereus源头的可能。Kovac等[26]将乳源分离株通过MLST分析分为21 个不同的ST型,其中有16 个新的基因型,本研究将得到的婴幼儿配方羊乳粉生产链分离株分为7 个ST型,其中ST-1348、ST-1349、ST-1350、ST-1351为4 个新型ST型,glp-253、glp-254、ilv-277、pyc-199为4 个新型等位基因;此外,PubMLST Database数据显示[27],从2015年我国乳制品分离株首次上传至今已有70 个乳源分离株在库,分为68 个ST型(图3),本研究得到的ST-1348、ST-1049、ST-1051包含在内,表明乳制品分离株具有遗传多样性。因此,本研究基因序列的进化关系需要进行进一步BURST(n-4)和MLST CC分析。
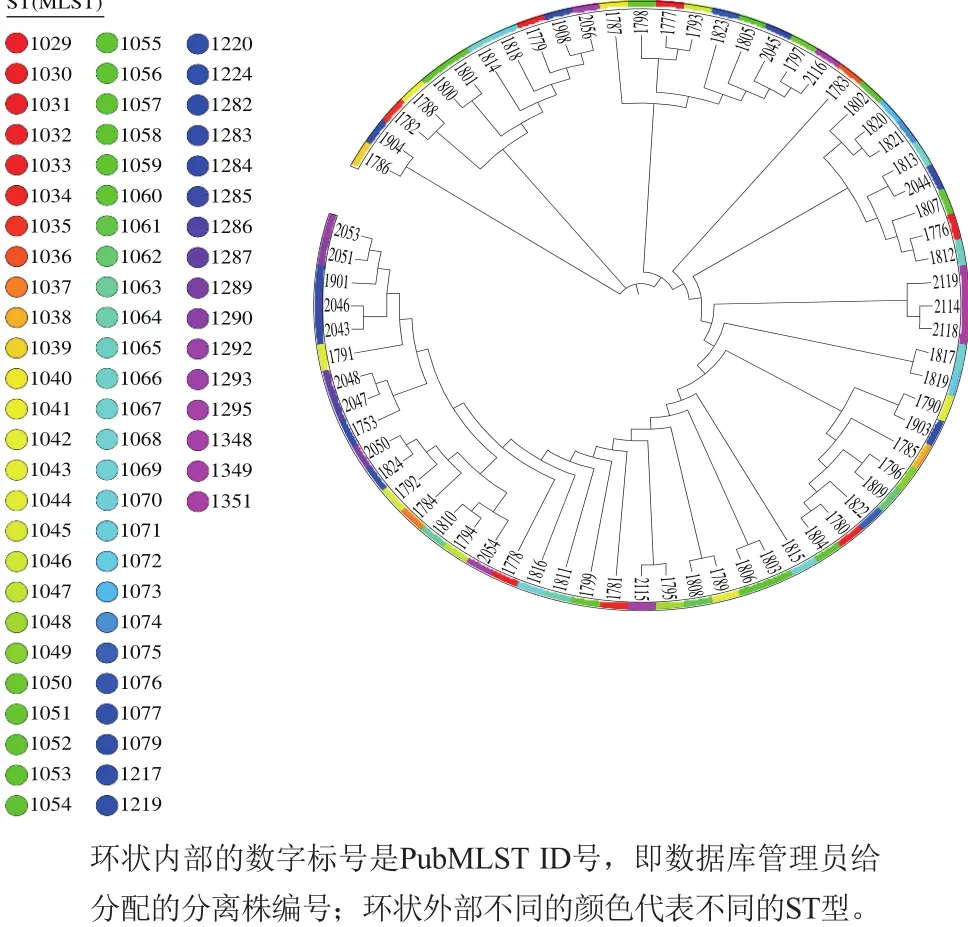
图3 我国乳制品B. cereus分离株[28]的ST型及进化树Fig.3 Sequence types and phylogenetic tree of B. cereus strains isolated from milk products in China
2.3 MLST CC分析结果
将42 株分离株的ST型及其CC建立最小生成树,如图4所示,ST-1000隶属CC 142,ST-1084隶属于CC 205,ST-770与ST-1084与其他ST型相比具有较近的亲缘关系,ST-1348隶属于CC 23。
将本研究得到的ST-770、ST-1000、ST-1084、ST-1348、ST-1349、ST-1350、ST-1351与其CC ST-142、ST-23运用数据库在线BURST(n-4)工具分为3 组(Group)和3 个独体,ST-23和ST-1348同属Group 1,ST-142、ST-1000同属Group 2,ST-770、ST-1084、ST-205同属Group 3,独体ST-1349和独体ST-1350分别是上粉器内壁分离株3L33和土壤分离株3L47的基因型,独体ST-1351是纯羊奶粉分离株1Y55、乳糖粉分离株1Y58、辅料室地面分离株5L45的基因型。BURST的结果与最小生成树的结果一致,相互验证分离株的亲缘进化关系。Dohmae等[28]的研究阐明B. cereus食源性分离株的基因型主要为ST-26、ST-142、ST-381,本研究得到的ST-1000(与ST-142基因型同属)与其基因型一致。张翼[29]采用MLST技术将11 株产呕吐毒素的分离株的基因型分为ST-26和ST-989,并使用BURST工具探究其亲缘关系,其与本研究使用的分析方法相同,但没有得到相同的ST型,这可能是因为婴幼儿配方羊乳粉生产链的分离株不表达致呕吐毒素的基因[21]。
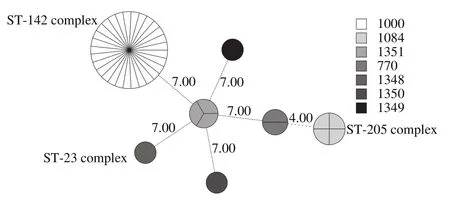
图4 42 株B. cereus分离株的最小生成树Fig.4 Minimum spanning tree of 42 B. cereus isolates
2.4 不同来源分离株ST型的比对分析
我国已上传至PubMLST Database的B. cereus分离株共153 个,与之对应的基因型有126 个,其中包括本研究得到的ST-1348(分离株3L4)、ST-1349(分离株3L33)、ST-1350(分离株3L47)、ST-1351(分离株1Y55、5L45、1Y58)4 个基因型,使用n-4的BURST将我国不同来源B. cereus分离株的ST型分为10 个组和12 个独株。Group 1是以ST-26为祖先克隆的主体群属(72.2%,91/126),Vassileva等[7]研究发现ST-26为典型的产呕吐毒素的基因型,此基因型与本研究得到的ST型无重叠,验证了本实验2.1节的初步推断。ST-1048与ST-1348同属Group 5,均为ST-23的克隆复合物,其分离株的来源均为中国乳制品,后者采自陕西省婴幼儿配方羊乳粉生产链的浓缩车间,Barker等[30]探究了临床分离株的致病性与MLST的关系,研究发现诱发菌血症的B. cereus分离株的ST型与B. thuringiensis的ST型具有同源性,本研究得到的MLST CC 23是B. thuringiensis的ST-23,其分离株3L4(浓缩车间平皿沉降样)有可能是诱发菌血症的菌株;ST-1140和ST-1350同属Group 7,其分离株来源均为陕西省土壤样,后者采自陕西省羊乳粉生产工厂周边的土壤;ST-1227、ST-1311、ST-1351同属Group 10,其分离株来源分别为食品包装、陕西省土壤样、婴幼儿羊乳粉生产链分离株;ST-1349是独株,其分离株3L33采自婴幼儿配方羊乳粉生产链的上粉器内壁。
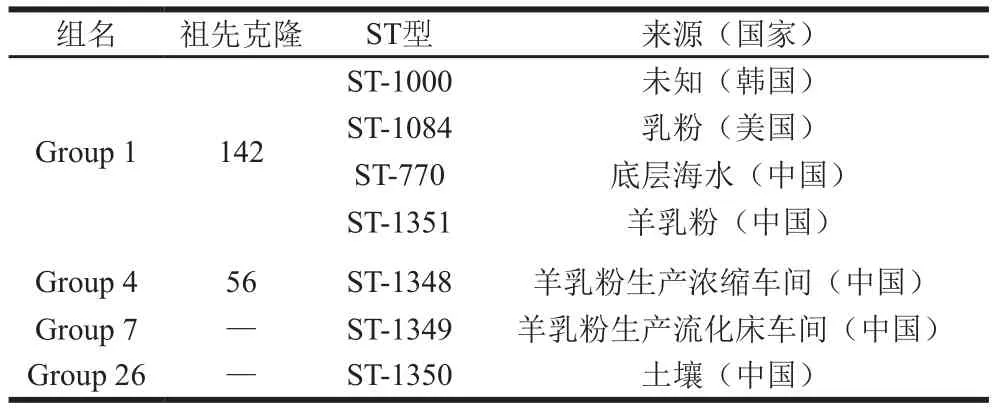
表2 婴幼儿配方羊乳粉生产链B. cereus分离株ST型的同源关系[28]Table2 Evolutionary relationships of STs for B. cereus strains isolated from goat milk infant formula processing plants
用BURST(n-4)比对了全世界B. cereus分离株,得到27 个组和33 个独株,进一步分析本研究所得的所有基因型的同源关系,如表2所示。ST-1000、ST-1084、ST-770、ST-1351同属以ST-142为祖先克隆Group 1,其中ST-1084从属以ST-205为首的亚克隆复合物;ST-1348从属以ST-56为祖先克隆的Group 4(图5);ST-1349与ST-57、ST-76同属Group 7。
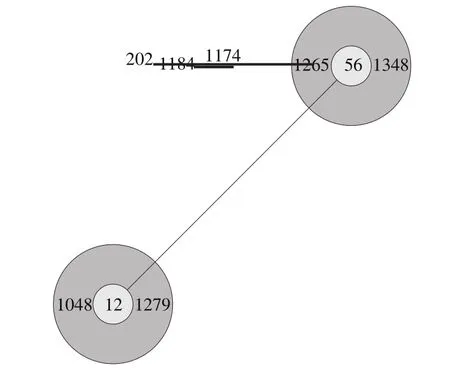
图5 ST-1348的进化关系及其所属Group 4的2 个亚克隆复合物Fig.5 Evolutional relationship of STs in Group4 isolated from different sources around the world and its2 sub-clonal complexes
3 结 论
婴幼儿配方羊乳粉生产环节的B. cereus分离株共分为7 个ST型,分别为ST-770(4.8%,2/42)、ST-1000(71.4%,30/42)、ST-1084(9.5%,4/42)、ST-1348(2.4%,1/42)、ST-1349(2.4%,1/42)、ST-1350(2.4%,1/42)和ST-1351(7.1%,3/42),其中ST-1000是婴幼儿配方羊乳粉生产环节分离株的主要ST型;发现了4 个新的ST型和4 个新的等位基因,上传至PubMLST Database得到新的序列号和等位基因号,分别是ST-1348、ST-1349、ST-1350、ST-1351和glp-253、glp-254、ilv-277、pyc-199。婴幼儿配方羊乳粉生产环节B. cereus分离株的基因具有多样性;婴幼儿配方羊乳粉生产环节分离株的ST型被识别为205、142、23三个不同克隆谱系,2 个单态群(ST-770和ST-1351)和2 个独株(ST-1348和ST-1349),其祖先克隆复合物为142,没有得到典型致呕吐基因型ST-26或其同源克隆复合物,而可能引起菌血症的基因型ST-1348在浓缩车间的空气样中检出。新的ST-1349、ST-1350无祖先克隆复合物,表现出进化变异。

