发酵过程中鲊鱼的细菌群落动态和品质特征变化
于美娟,杨 慧,谭 欢,刘学文,马美湖,李高阳
(1.湖南省农业科学院 湖南省农产品加工研究所,湖南 长沙 410125;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
我国淡水鱼资源丰富,2015年我国淡水产品产量3 290万 t,同比增长3.94%。其中用于加工的淡水产品561.9万 t,占加工水产品总量的24.7%[1]。伴随着加工业的进步,淡水产品加工比率的增长超过海水[2]。在淡水鱼众多加工产品中,固态发酵鱼制品是一类能提供优质蛋白质资源、深受人们喜爱的传统发酵食品。鱼固态发酵也是热带或亚热带地区的人民为了在高温、高湿度条件下保存鱼肉的一种方式,在日本、东南亚和非洲等地常见这种产品销售[3-5]。我国传统固态发酵鱼制品因地域、民族、加工方式不同而产生口味各异的品种。
传统固态发酵鱼制品主要采用传统的自然发酵制作,发酵时间长,发酵条件难以控制,只能在秋末、冬季生产。为缩短发酵时间,防止产品的随机性,国内不少学者对定向分离筛选、接种发酵进行了研究探讨[6-9],但得到的产品口感不如传统加工的产品。因为传统固态发酵鱼制品属自然发酵,微生物组成复杂多样[10]。微生物菌群结构往往也对产品的色泽、质构、质量安全等起着至关重要的作用[11]。同时,在发酵过程中,伴随着菌体生物量的增加,蛋白质、脂肪和碳水化合物等生物大分子化合降解成小分子代谢产物,对最终风味品质的形成产生直接作用[12]。因此,了解发酵过程中微生物群落结构动态是调控和提升产品质量的关键。
国内对发酵鱼肉中微生物的动态研究较少,而且主要以传统培养和克隆分析进行探讨[8,10],但这些方法在探讨微生物数量和动态变化上是有限的,不能完全反映整个微生物多样性的真实状态。随着现代分子生物学的发展,第2代高通量测序技术能够全面而准确、直接地反映微生物的群落构成、功能特性、变化演替和多样性,而且具有检测通量更高、用时更少的优点[13],避开了微生物培养法的局限性和其DGGE/TGGE等非培养技术耗时、检测费用高等问题。目前在其他发酵食品的微生物生态学上得到应用[14-17],笔者也应用此方法揭示了不同工艺传统发酵鱼的微生物多样性及品质特征差异[18]。但是运用高通量测序技术并结合质构仪、氨基酸自动分析仪和气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用仪分析传统固态发酵鱼发酵过程中的细菌群落结构动态演变及品质特征变化还鲜见报道。
本研究拟取同条件下发酵0~180 d的传统固态发酵鲊鱼样品,采用溴化十六烷三甲铵(cetyltrimenthyl ammonium bromide,CTAB)法提取总细菌DNA,根据所扩增的16S rDNA区域特点,基于Illumina HiSeq高通量测序平台双末端测序,揭示其发酵过程中细菌群落结构及动态变化,同时结合质构分析仪、全自动氨基酸分析仪、GC-MS等分析手段,提示其发酵过程中质构变化、氨基酸组分的降解、脂肪酸组分的降解及与时间的相关性,进一步加深对传统固态发酵鲊鱼发酵机制的认识,较全面地掌握发酵过程,从而为利用微生物资源、改善传统发酵工艺和控制产品质量安全提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜草鱼购于湖南省农业科学院生鲜农贸市场;调味料、香辛料购于大型超市。
17 种氨基酸标准溶液 美国Sigma公司;DNA凝胶回收试剂盒 德国Qiagen公司;TruSeq文库构建试剂盒、MiSeq测序试剂盒 美国Illumina公司;溶菌酶美国BBI公司。
1.2 仪器与设备
7890-5975C GC-MS联用仪 美国安捷伦公司;L-8900全自动氨基酸分析仪 日本日立公司;CT3质构仪 美国Brookf i eld公司;Illumina HiSeq测序仪 美国Illumina公司;Flx800酶标仪 美国BioTek公司;AL204电子天平 美国Mettler-Toledo公司;101-1AB电热鼓风干燥箱 天津市泰斯特仪器有限公司;FJ200高速分散匀质机 上海圣科仪器设备有限公司;Avanti J-26XP高效冷冻离心机 美国贝克曼库尔特有限公司。
1.3 方法
1.3.1 样品制作与采集
取2~4 kg的大小草鱼15 条,去内脏、骨,切块,每100 g鱼肉加入2~3 g食盐,低温5~10 ℃腌制12 h,烘箱40 ℃条件下烘至鱼块含水质量分数为35%~45%,然后加香辛料装坛密封,20 ℃左右发酵,发酵0、10、20、30、50、70、90、120、150、180 d取样,样品一式3 份,每份1 kg。每份样品取100 g置于-80 ℃冰箱保存用于高能量测序等,质构直接取样测定,其余样品置于-20 ℃冰箱保存。
1.3.2 DNA提取、聚合酶链式反应(polymerase chain reaction,PCR)扩增及高通量测序分析
DNA提取:取样品各10.00 g加入至100 mL灭菌生理盐水中,均质拍打2 min后,至4 ℃摇床30 min,静置10 min,取上清液离心后采用CTAB方法对样本的基因组DNA进行提取[19]。之后利用琼脂糖凝胶电泳检测DNA的纯度和浓度,检测合格后将3 份平行样品的DNA合并混合均匀备用。
PCR扩增及测序:所有样品的细菌16S rDNA V4区扩增用引物515F(5’-GTGCCAGCMGCCGCGG-3’)和引物806R(5’-GGACTAHVGGGTWTCTAAT-3’)进行扩增。PCR扩增产物使用Illmina Miseq PE250测序平台进行高通量测序(北京诺禾致源生物科技有限公司)。
数据分析:利用Uparse软件[20]对所有样品的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),用RDP Classif i er[21]方法与GreenGene数据库[22]进行物种注释分析,用Qiime软件(Version 1.7.0)对Chao1、Shannon多样性指数和Goods Coverage指数进行计算。
1.3.3 质构分析
采用物性测试仪CT3测定发酵后鲊鱼样品的硬度、黏性、弹性、咀嚼性等。分别取不同发酵时间段的鲊鱼块,将其切成10 mm×20 mm×20 mm的方块,在室温下进行物性测试。测试条件为:探头TA44,目标2 mm,触发点负荷30.0 g,预测试速率2 mm/s,测试速率2 mm/s,返回速率2 mm/s,数据频率20 点/秒,循环次数2。每个样品进行6 次以上的测试,结果取 ±s。
1.3.4 氨基酸组分分析
参考李春萍[23]的方法并略作修改:准确称取样品0.500 0 g于酸解管中,加入10 mL6 mol/L盐酸溶液,抽真空密封,于110 ℃水解24 h。水解结束后超纯水定容至50 mL,用定性滤纸过滤,吸取1 mL于20 mL烧杯中真空干燥1 h,加入0.02 mol/L盐酸溶液10 mL,过0.22 μm水系滤膜,采用全自动氨基酸分析仪测定。
1.3.5 脂肪酸组分分析
脂肪酸的提取和甲酯化参照GB/T 9695.2—2008《肉与肉制品 脂肪酸测定》,使用GC-MS测定,用峰面积归一法确定各种脂肪酸的相对含量。
1.4 数据处理
利用Excel 2010、Origin 9.1、SPSS Statistics 20.0等统计软件进行数据处理和分析。
2 结果与分析
2.1 发酵过程中细菌多样性变化
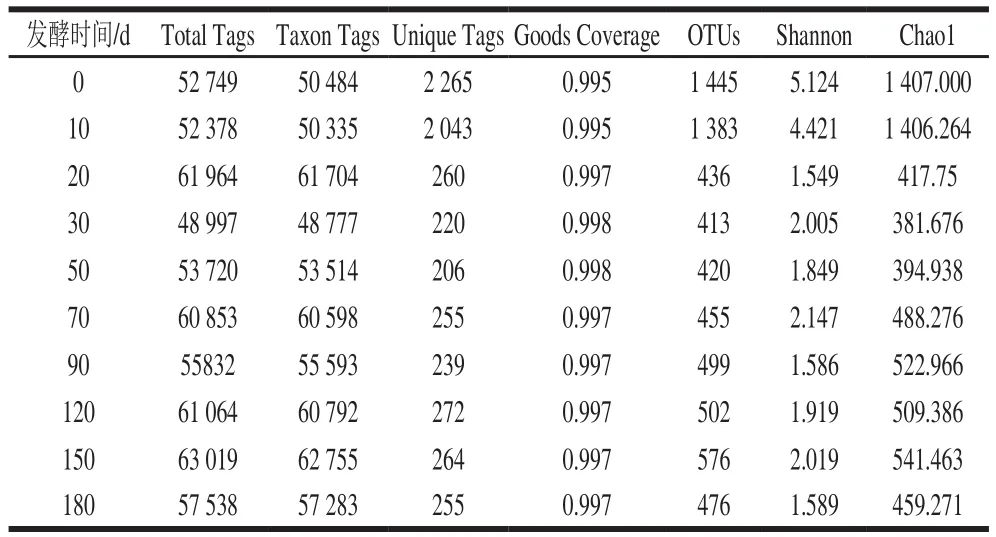
表1 不同发酵时间传统固态发酵鲊鱼样品序列信息和注释统计分析Table1 Summary of the sequencing data sets and statistical analysis of solid-state fermented Zhayu samples
对传统固态发酵鲊鱼不同发酵时间的样本提取总细菌DNA,经过一系列处理后运用Illumina Hiseq PE250平台进行测序分析,结果如表1所示,共得到568 114 条有效序列,平均每个样品含有56 811 条序列(48 997~63 019条),有效序列越多,进入分类的序列(Taxon Tags)也越多。独特序列(Unique Tags)除发酵0~10 d样品在2 000以上外,其他时间段的样品大致多在200~300之间。另外,各样品的Goods Coverage指数均在0.995以上,说明本实验的测序量已经达到饱和,测序结果基本能够反映传统固态发酵鲊鱼发酵过程中微生物菌群多样性组成,测序深度已基本覆盖样品中所有微生物,更多的数据量对发现新的OTUs的边际贡献很小。
微生物菌群生态学可通过样品的OTUs、Chaol和Shannon等多样性指标来反映微生物群落的丰度和多样性。OTUs数值越大表示物种多样性越丰富;Chaol数值越大,则表示样品复杂度越高;Shannon数值越大,则表示该样品中的物种越丰富。从表1可知,随着发酵时间的延长,样品中的细菌多样性总体呈现迅速下降然后缓慢上升再下降的趋势。如在发酵初期(0~10 d),OTUs值在1 383~1 445之间,Shannon为4.421~5.124,Chaol为1 406.264~1 407.000,表明样品中初始细菌物种丰富、种类繁杂。但在发酵10~20 d期间,随着发酵时间的延长,细菌种类下降明显,OTUs值从1 383降至436,Shannon从4.421降至1.549,Chaol从1 406.264降至417.75。而在发酵20~180 d,其OTUs值、Chaol、Shannon等多样性指数上升和下降浮动趋势不大,表明能够适应新生长环境的微生物数量逐渐处于平稳。
2.2 发酵过程中细菌群落结构变化
根据RDP数据库同源性序列比对与聚类相结合的方法对序列进行鉴定,发现所有样品中可以确认的有10 个门类群、30 个纲类群、60 个目类群、90 个科类群、130 个属类群。
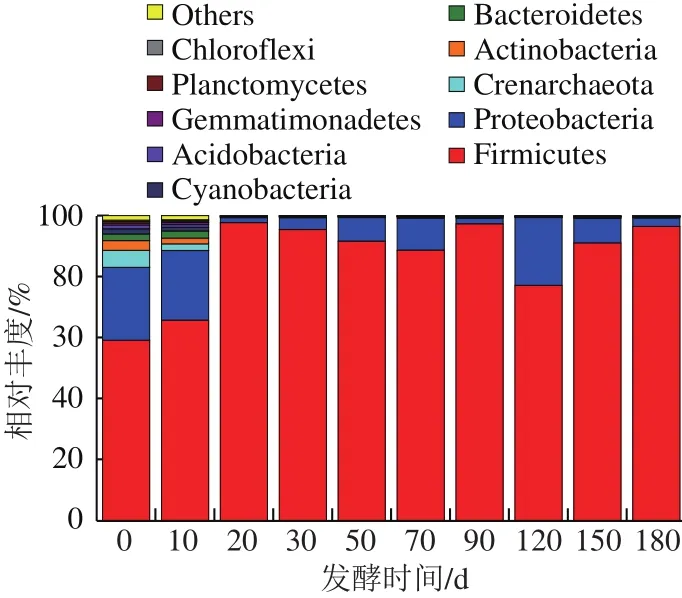
图1 门水平上的物种相对丰度Fig.1 Phylum-level community structure of bacteria in Zhayu
如图1所示,在发酵0~180 d期间,各阶段的发酵鲊鱼所含细菌门水平类基本相似,主要有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、泉古菌门(Crenarchaeota)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、酸杆菌门(A c i d o b a c t e r i a)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)、绿弯菌门(Chloroflexi)10 个门类。随着发酵时间的延长,厚壁菌门(Firmicutes)的相对丰度值整体显增加的趋势,在发酵的整个阶段占有绝对优势,与朱雯娟[24]分析发酵梅香鱼中微生物种群的结果一致;变形菌门(Proteobacteria)在发酵初期,下降缓慢,发酵10~20 d,相对丰度值迅速下降,之后又慢慢回升,显波浪形变化;其他几个菌门随着发酵时间的延长,逐渐减少,而且减少的速率比较明显,有的接近于零。
如图2所示,相对丰度排名前10的有芽孢杆菌目(Bacillales)、肠杆菌目(Enterobacteriales)、乳酸杆菌目(Lactobacillales)、餐古菌目(Cenarchaeales)、假单胞菌目(Pseudomonadales)、海洋螺菌目(Oceanospirillales)、黄单胞菌目(Xanthomonadales)、红细菌目(R h o d o b a c t e r a l e s)、酸微菌目(Acidimicrobiales)、红螺菌目(Rhodospirillales)。随着发酵时间的延长,细菌的多样性逐渐减少,主要以芽孢杆菌目为主,其相对丰度值呈增加趋势;其次是乳酸杆菌目,相对丰度值上下波动,不稳定;但值得注意的是,在发酵70 d和120 d阶段,肠杆菌目相对丰度值有明显上升趋势,原因有待于下一步实验进行验证。
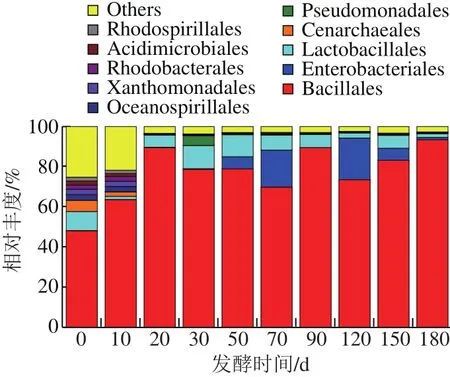
图2 目水平上的物种相对丰度Fig.2 Order-level community structure of bacteria in Zhayu
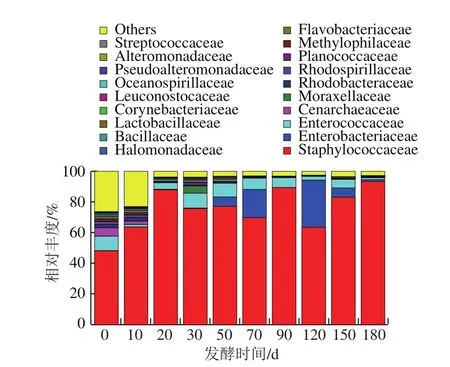
图3 科水平上的物种相对丰度Fig.3 Family-level community structure of bacteria in Zhayu
为进一步对不同发酵阶段微生物菌群结构的动态进行分析,更深入地了解发酵时间对细菌组成和数量的影响情况,在科水平对其相对丰度排名靠前的进行归类,如图3所示,其菌属的动态变化如下:在发酵初期(0~10 d),细菌群落多样性丰富,相对丰度大于0.1%的科水平达40多个,其优势为葡葡萄球菌科(Staphylococcaceae)(48%)、肠球菌科(Enterococcaceae)(9.46%)、餐古菌科(Cenarchaeaceae)(5.57%)、红细菌科(Rhodobacteraceae)(2.12%)。随着发酵时间的延长(10~50 d),因大部分葡萄球菌具有蛋白酶活性,降解蛋白成小分子肽和游离氨基酸,为乳酸类细菌的生长繁殖提供了营养因子[25],使一些细菌迅速增长,芽孢杆菌科(Bacillaceae)相对丰度值由0.017%上升为1.35%、乳杆菌科(Lactobacillaceae)由0.018%上升为0.88%、明串珠菌科(Leuconostocaceae)由0.0%上升为0.61%、链球菌科(Streptococcaceae)由0.002%上升为0.32%、莫拉菌科(Moraxellaceae)由0.006%上升为0.31%;而黄杆菌科(Flavobacteriaceae)、海洋螺菌科(Oceanospirillaceae)、假交替单胞菌科(Pseudoalteromonadaceae)、交替单胞菌科(Alteromonadaceae)等却随着发酵时间的延长快速下降,餐古菌科(Cenarchaeaceae)下降为0%,其优势菌转变为葡萄球菌、肠球菌和乳酸类细菌。发酵70~180 d,乳酸类细菌的相对丰度值下降,葡萄球菌上升,但是应引起重视的是随着发酵时间的延长,肠杆菌也慢慢生长起来,与目水平相似。
2.3 发酵过程中质构变化
从表2可知,在发酵0~10 d,除黏性外,各指标差异不显著(P>0.05),在发酵10~120 d之间,硬度、胶着性、咀嚼性差异显著(P<0.05),数值下降明显。在120~150 d,除黏性外,各指标数值保持相近,没有差异(P>0.05),在150~180 d,各指标差异显著(P<0.05)。并且时间与质构指标在0.01水平(双侧)上除黏性没有相关性外,其他都存在显著负相关。这是因为鱼制品在发酵过程中往往伴随着一系列复杂的生理生化变化,随着发酵时间的延续,鱼肉中微生物的蛋白酶和脂肪酶活性以及鱼肉的自身酶活性能使大分子的蛋白质和脂肪降解为小分子的肽、氨基酸和游离脂肪酸等化合物,这些生化变化除了形成产品独特的风味外,同时也导致了发酵鱼制品质构疏松,组织松软[26]。

表2 固态发酵鲊鱼在发酵过程中质构的变化Table2 Changes in texture prof i le of Zhayu during fermentation
2.4 发酵过程中氨基酸组分变化
氨基酸是传统固态发酵鲊鱼中主要的代谢产物,从表3可知,在不同发酵时间段,17 种氨基酸含量总的变化趋势是先升后降,其主要氨基酸为谷氨酸、赖氨酸、亮氨酸和天冬氨酸。而且各氨基酸组分与时间的相关系数在0.01水平(双侧)上除胱氨酸没有显著相关性外,其他都存在显著负相关。主要原因是在发酵起始阶段,在微生物蛋白酶的作用下,大分子蛋白降解成多肽以及氨基酸分子,从而氨基酸含量增加,而后期进一步降解,参与风味物质的形成以及生成小分子含氮化合物,从而氨基酸含量降低[27-28]。根据氨基酸的显味特征,分为鲜味、甜味和苦味氨基酸,其中鲜味和甜味氨基酸含量之和大于苦味氨基酸的量。
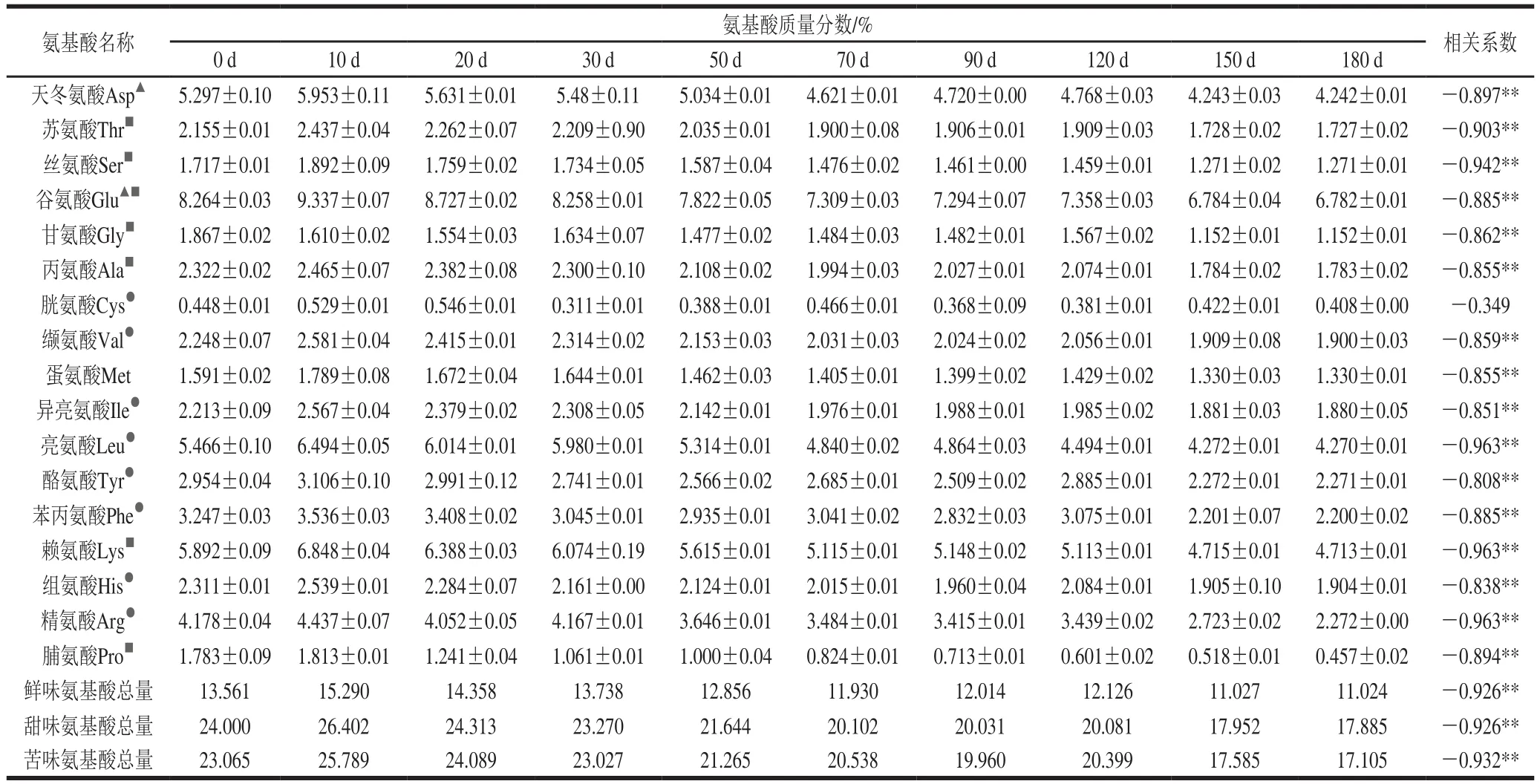
表3 固态发酵鲊鱼发酵过程中氨基酸含量的变化Table3 Changes in amino acid contents of Zhayu during fermentation
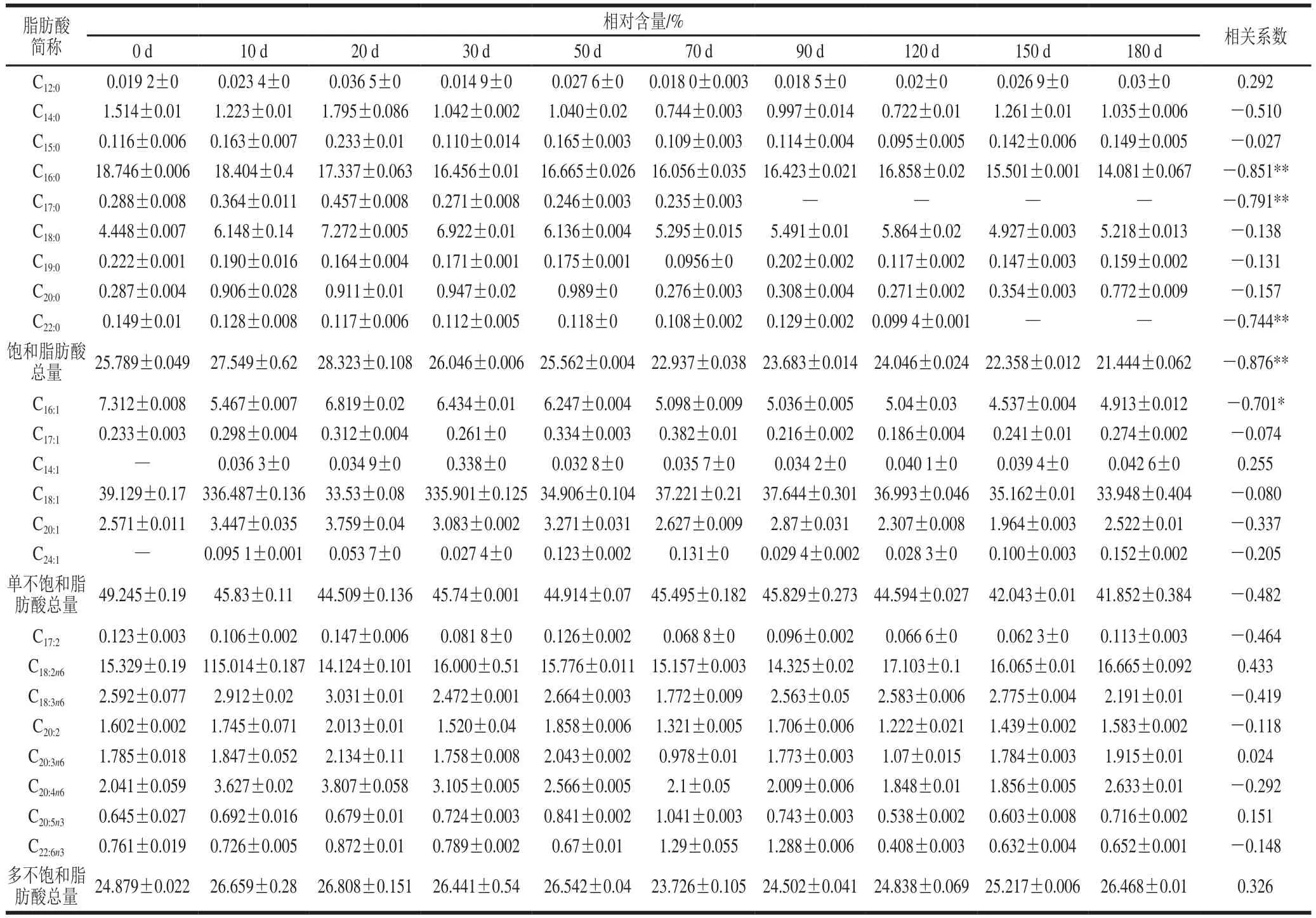
表4 传统固态发酵鲊鱼发酵过程中脂肪酸的组成和变化(以脂肪酸甲酯计的峰面积相对含量)Table4 Change in fatty acid composition of Zhayu during fermentation
2.5 发酵过程中脂肪酸组成变化
由表4可知,鲊鱼在发酵过程中于共检出23 种脂肪酸:饱和脂肪酸9 种,单不饱和脂肪酸6 种和多不饱和脂肪酸8 种。饱和脂肪酸中棕榈酸(C16:0)和硬脂酸(C18:0) 的含量较高,饱和脂肪酸总含量与发酵时间在0.01水平(双侧)存显著负相关。单不饱和脂肪酸中以棕榈油酸(C16:1n7)和油酸(C18:1n9)为主,相对含量与发酵时间显负相关。多不饱和脂肪酸中以亚油酸(C18:2n6)、亚麻酸(C18:2n6)和花生四烯酸(C20:4n6)为主,其相对含量随着发酵时间的延长,呈增加趋势,这与李春萍[23]在臭鳜鱼发酵中分析单不饱和脂肪酸和多不饱和脂肪酸的结果一致。不饱和脂肪酸对人体有益,有研究表明,油酸和亚油酸能抑制胆固醇在小肠中的吸收,促进肝脏内胆固醇的降解和排除,改变体内胆固醇的分布[29]。从3 种脂肪酸所占的比例来看,不饱和脂肪酸的比例远远大于饱和脂肪酸的比例,这有利于抑制不饱和脂肪酸的氧化酸败。
3 讨 论
3.1 发酵过程中细菌多样性和群落变化与品质的关系
与传统方法比,本研究采用Illumina HiSeq平台测序得到微生物种类更多,更能接近于样品的微生态,其共测出10 个门类、30 个纲类群、60 个目类群、90 个科类群、130 个属类群。在整个发酵过程中,主要以厚壁门为主。发酵初期,在科水平相对丰度值排前的是葡萄球菌科和肠球菌科,其归属于厚壁门也占优势地位;随着发酵时间的延长(10~50 d),乳杆菌、魏斯氏菌、明串珠菌、链球菌、四联球菌显著上升,而淡水鱼中最常见的细菌种类,如海洋中螺菌属、假单胞菌属、弧菌属、黄杆菌属、莫拉克斯氏菌属等却随着发酵时间的延长快速下降,其主要优势菌为葡萄球菌、肠球菌和乳酸类细菌。但是发酵70 d后,有部分腐败菌,如特布尔西式菌属、埃希氏菌属等肠杆菌科有缓慢生长的趋势。这说明发酵过程中微生物菌群结构随时间推移存在一个动态变化。
同样通过高通量Illumina平台测序分析发酵鱼制品中细菌结构,本研究结果与其朱雯娟[24]测定梅香鱼和蔡瑞康[30]测定糟制大黄鱼中细菌菌群有一定的异同点。本研究通过Illumina平台测序,发酵初期,科水平相对丰度值排前的是葡萄球菌科和肠球菌科;发酵10~50 d,其主要优势菌为葡萄球菌、肠球菌和乳酸类细菌。发酵70 d后,肠杆菌科有缓慢生长的趋势。而朱雯娟[24]对梅香鱼 的Illumina测序,得出细菌共有8 个门,其中优势菌门是厚壁菌门。在厚壁菌门中,相对丰度值最高的菌属分别是乳杆菌属(25.36%)、葡萄球菌属(19.27%)和四联球菌属(14.62%),可被认为是参与发酵过程的优势菌属。蔡瑞康[30]采用Illumina测序对大黄鱼糟制过程中细菌,得出糟制前期的优势菌为芽孢杆菌属、弧菌属和涅瓦菌属;随着糟制时间的延长芽孢杆菌属比例逐渐下降,弧菌属比例先上升后大幅下降,而前期比例较小的魏斯氏菌属、乳杆菌属和肠球菌比例逐渐增加成为优势菌,糟制后期优势菌为魏斯氏菌属,涅瓦菌属、芽孢杆菌属和乳杆菌属。有研究表明,发酵产品中优势微生物的种类和数量差异可能是由于食物基质的组成和发酵参数不同[31],上述3 种不同发酵鱼制品的差异正好证明这一观点。
在本研究高通量测序中,葡萄球菌、乳酸菌是主要的优势菌。有研究表明,葡萄球菌不仅对产品色泽有贡献[32];而且葡萄球菌还有降解生物胺的能力,如木糖葡萄球菌(Staphylococcus xylosus)不仅能够大幅度地降解组胺,还具有良好的降解酪胺的能力[33]。乳酸菌可将氨基酸在转氨酶作用下转化为相应的α-酮酸,而α-酮酸则可进一步转化为酸类、醇类化合物[34];从发酵鱼中分离的乳酸菌还能有效抑腐败菌[35]。这表明,在传统发酵鱼的发酵过程中,优势益生菌活动对产品风味品质具有直接的影响。
在本研究高通量测序中,肠球菌在各个时期都保持着较高的相对丰度,是人类和动物肠道中正常的菌群。肠球菌中某些种如海氏肠球菌、粪肠球菌和尿肠球菌等因具有良好的生物安全性和优良的益生特性,常作为益生菌被应用于发酵食品的生产[36]。虽然高相对丰度值的杆肠菌科是肠道细菌中常见的条件致病菌,但由于部分种群与致病菌沙门菌十分相似,故对其进行分类鉴定非常重要。另外其他占有比例比较少的菌群,对整个产品的风味是否有影响,还需在以后的实验中加以验证。
3.2 发酵过程中质构变化与品质的关系
鱼制品在发酵过程中由于鱼肉体中自身酶、添加的盐及其他辅料及微生物酶的共同作用,发生一系列复杂的生理生化变化,从而也导致了发酵鱼制品的质构发生改变,使得质构疏松,组织松软。本研究用质构分析仪测定了不同发酵时期鲊鱼的质构指标,不仅能消除人为和个人感官的主观性影响,而且还能对样品的质构特性做出准确的定量表述。如表3所示,随着发酵时间的延长,硬度、内聚性、弹性、胶着性、咀嚼性等质构指标数值显下降趋势,与时间存在显著负相关(在0.01水平,双侧),随着发酵时间的延长,其质构指标的如硬度、咀嚼性等指标的下降,从而影响了产品的口感品质。
3.3 发酵过程中氨基酸组分的变化与品质的关系
氨基酸是发酵鱼制品中主要的代谢产物,与滋味、风味密切相关,有研究表明,天冬氨酸、谷氨酸与甘氨酸、丙氨酸的含量决定了鱼肉的鲜味[37]。在发酵过程中,引起氨基酸含量变化的主要因素有:一方面为鱼自身酶和微生物蛋白酶的作用下发生一系列生化变化,如李改燕等[10]在糟鱼加工中发现,在蛋白酶的作用下,先增加的氨基氮经进一步降解,参与风味物质的形成以及生成小分子含氮化合物,而使氨基态氮含量降低;Córdoba等[28]发现在火腿加工后期,精氨酸、天冬氨酸这些氨基酸因参与美拉德反应而使含量下降。另一方面,食盐的添加使鱼体内一部分氨基酸等物质经渗透迁移,如陈学云等[38]在糟制带鱼加工中发现由于渗透作用,氨基氮含量下降,多肽氮下降。综合酶降解和渗透作用,在本研究传统固态发酵鲊鱼发酵过程中,主要以微生物蛋白酶降解为主,也证实了各组分氨基酸的含量是先增加后减少的趋势,其中谷氨酸含量最高,赖氨酸、亮氨酸、天冬氨酸次之,丝氨酸、甘氨酸、脯氨酸含量最低。
3.4 发酵过程中脂肪酸组分的变化与品质的关系
脂肪水解跟蛋白水解一样被认为对产品风味的形成起着关键性的作用,其中,中链和长链的脂肪酸一般是风味化合物的前体物质,如具有脂肪酶活性的葡萄球菌(S. xylosus、S. carnosus)能降解脂肪,形成大量的醛、酮、醇、烯烃、烷烃等风味小分子,从而改善产品的风味[39],而短链脂肪酸(C<6)通常具有浓郁的奶酪味[40]。有研究表明,油酸和亚油酸能抑制胆固醇在小肠中的吸收,促进肝脏内胆固醇的降解和排除,改变体内胆固醇的分布;二十碳五稀酸和二十二碳六稀酸对人体十分有益,能够降血脂、降血压、抗血栓、防治动脉粥样硬化等。本研究得到的脂肪酸主要是以中长链为主,具有改善产品整体风味的作用;单不饱和脂肪酸中以油酸为主,多不饱和脂肪酸中以亚油酸为主,可抑制对胆固醇的吸收和促进胆固醇的降解。

