糖尿病足溃疡感染患者病原菌特点及其与下肢血管病变程度的关系
胡敬梅,银 玲,邓 蓉,唐秀英,徐 辉,高志文
(1.四川大学华西医院感染科,四川 成都 610041;2.四川省三台县人民医院感染科,四川 三台 621100)
长期高血糖可引起大血管、微血管、神经等多系统功能损害,从而导致多种并发症,尤其是足部并发症。糖尿病足(DF)是糖尿病(DM)患者最常见的并发症之一,主要表现为缺血性静息痛、间歇性跛行、坏疽、溃疡等;由于其主要与患者血糖水平、免疫、抗感染能力等密切相关,DF好发于DM病程较长的老年患者[1,2]。随着人们生活饮食习惯的改变以及我国人口老龄化进程的加快,DM的发病率不断上升,成为临床最常见的慢性疾病之一,临床因DF再次入院就诊的患者不断增多,治疗费用也不断增加[3]。临床调查[4]显示,约40%的DM患者在病情恶化情况下会引起DF溃疡感染,是导致临床下肢截肢且致残的主要原因之一。故DF的预防、诊断及治疗仍是亟待解决的重要难题。本研究重点分析DF溃疡感染患者病原菌特点及其与下肢血管病变程度的关系。
1 资料与方法
1.1一般资料2015年1月至2017年8月四川大学华西医院收治的140例DF溃疡感染患者,其中男64例,女76例,年龄44~75岁[(63.50±6.87)岁],DM病史1~22年[(11.70±5.19)年],DF病程2~11月[(7.57±3.05)月],右足感染50例、左足感染57例、双足感染33例。入选标准:①性别、年龄不限;②明确DM病史或新诊断DM患者;③口服葡萄糖耐量试验(OGTT)结果符合《中国2型糖尿病防治指南(2014年版)》[5]中DM诊断标准;④空腹血糖(FPG)≥7.0 mmol/L或餐后2 h血糖(2 hFPG)≥11.1 mmol/L(非同日2次检测);⑤糖化血红蛋白(HbAlC)>9.0%;⑥病原学鉴定结果符合1995年中华医学会第一届全国糖尿病足学术会议[6]制定DF溃疡感染标准;⑦均行下肢动脉造影检查、下肢血管CT血管造影(CTA)明确下肢血管病变情况;⑧对本研究的目的和意义知情,且获取医院伦理委员会审核通过。排除标准:①DM病足溃疡但局部分泌物培养无真菌或(和)细菌生长;②诊断为自身免疫性皮肤病变或静脉曲张引起的溃疡;③近3个月内伴发过DM酮症、酮症酸中毒;④非DM并发的下肢动脉硬化闭塞症及其他下肢血管病;⑤多种因素引发的神经、血管病变;⑥依从性差及病历资料不全。
1.2细菌学检测①溃疡分泌物采集:入院第1次伤口清洗及清创干预后,以无菌器械切除深部感染组织,将其置于灭菌加盖容器内,并在1 h内送病理性检查。②病原学鉴定:严格遵照《全国临床检验操作规程》进行病原学培养,对发现的菌落给予微量生化稀释法进行菌型鉴定,全自动病原菌鉴定仪产自安麦格公司。分泌物培养出一种细菌或真菌为单一感染;若培养出≥2种细菌及(或)真菌为混合感染。
1.3DF溃疡感染程度分级由我院资深医师依据相关标准[7]完成评估。①轻度:足部疼痛、局部皮肤温度升高、感觉过敏,可见化脓、结节、皮肤或皮下表浅组织感染、足部溃疡周围蜂窝组织炎症或出现红肿(但直径≤2 cm),未见其他局部并发症。②中度:患者当前各项代谢功能正常,存在淋巴管炎,足部周围组织蜂窝组织炎及红肿(直径>2 cm),且下肢出现脓肿,足部可见坏疽。③重度:除①②表现外,患者还出现全身感染症状或代谢功能紊乱,可伴寒战、发热、意识不清等。
1.4下肢血管病变程度分级均行下肢动脉造影检查、下肢CTA检查(飞利浦Brilliance 256层CT)明确下肢血管病变情况,患者保持俯卧,足部适当垫高,足背伸直,检查足背动脉,重点检查腘动脉、胫后动脉及血管壁的情况。参考泛大西洋学会联盟(TASC)分级标准[8]将病变程度分为A级(单发狭窄<10 cm或单发闭塞<5 cm)、B级(多发病变时每个狭窄<5 cm,或单发病变时闭塞<15 cm,均不累及腘动脉)、C级(多发病变≥15 cm)、D级(股动脉或股浅动脉闭塞>20 cm,累及腘动脉或完全闭塞)。
1.5统计学方法选用统计学软件SPSS 19.0分析和处理数据。计数资料比较采用χ2检验;等级资料比较采用秩和检验;计量资料比较采用t检验;影响因素分析采用Logistic回归分析。P< 0.05为差异有统计学意义。
2 结果
2.1病原菌特点140例患者共培养出病原菌172株,排名前三位的病原菌为金黄色葡萄球菌(25.58%)、铜绿假单胞菌(15.12%)、粪肠球菌9株(13.95%),见表1。溃疡感染程度包括轻度48例(34.29%)、中度60例(42.86%)、重度32例(22.86%);单一感染105例(75.00%)、混合感染35例(25.00%),不同感染程度患者感染类型比较差异有统计学意义(χ2=16.200,P< 0.05),见表2。
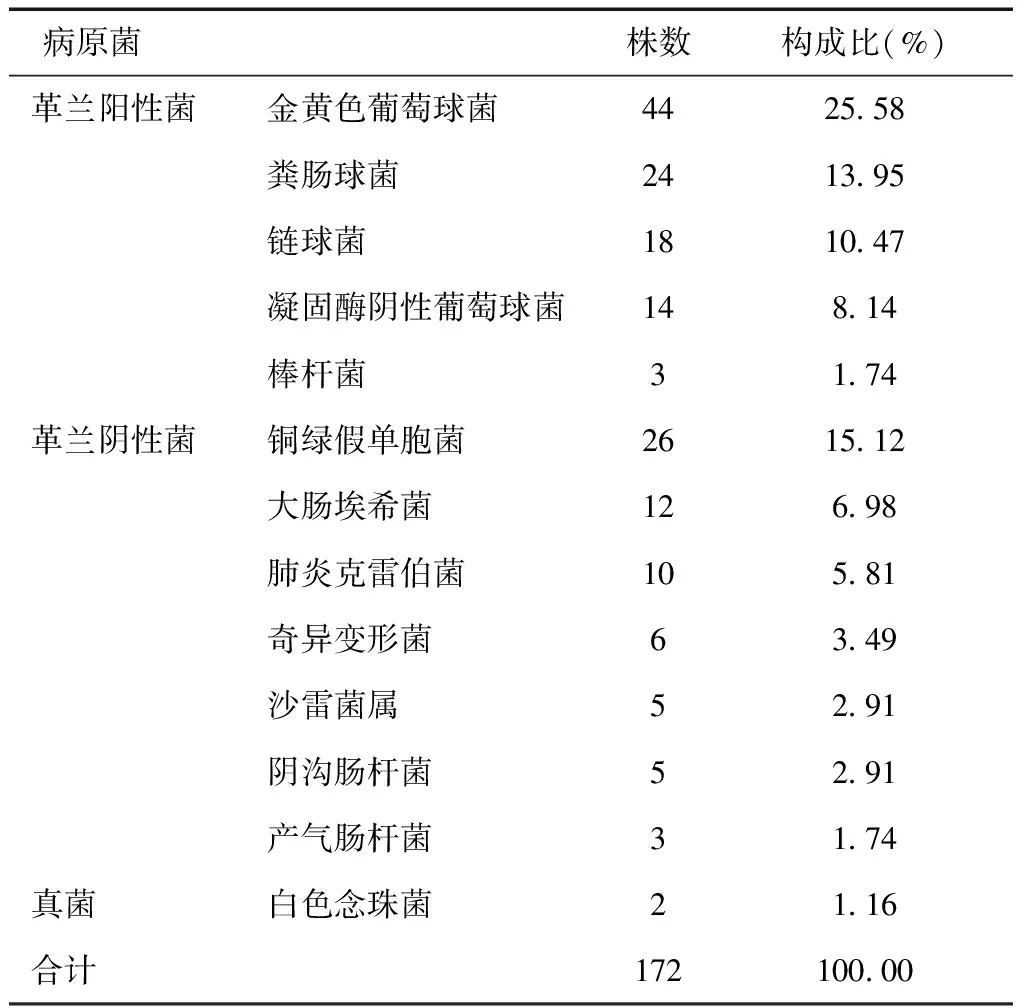
表1 DF溃疡感染患者病原菌分布
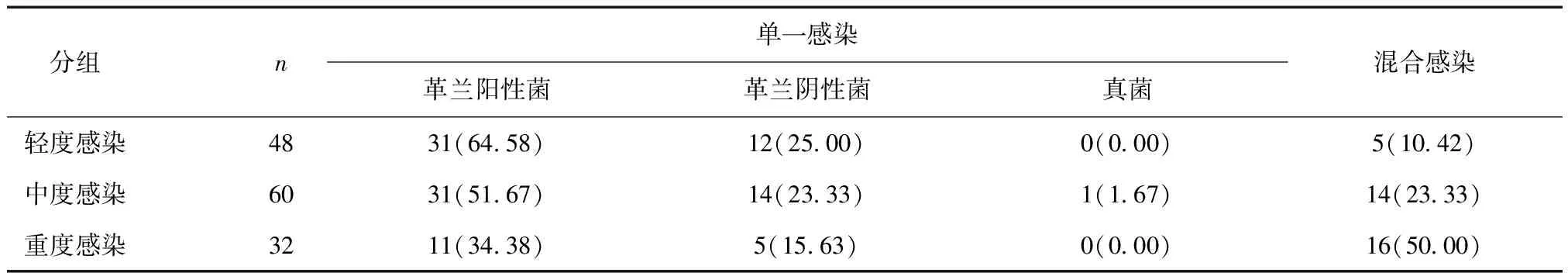
表2 不同感染程度患者感染类型比较 [n(%)]
2.2下肢血管病变程度评估结果不同感染程度患者TASC分级比较差异有统计学意义(Z=16.805,P< 0.05),见表3。以TASC分级为应变量,DF溃疡感染程度为自变量进行赋值(轻度、中度、重度感染分别为0、1、2),Logistic回归分析结果显示感染程度是TASC分级的影响因素(OR=4.117,95%CI=1.063~9.265,P< 0.05)。
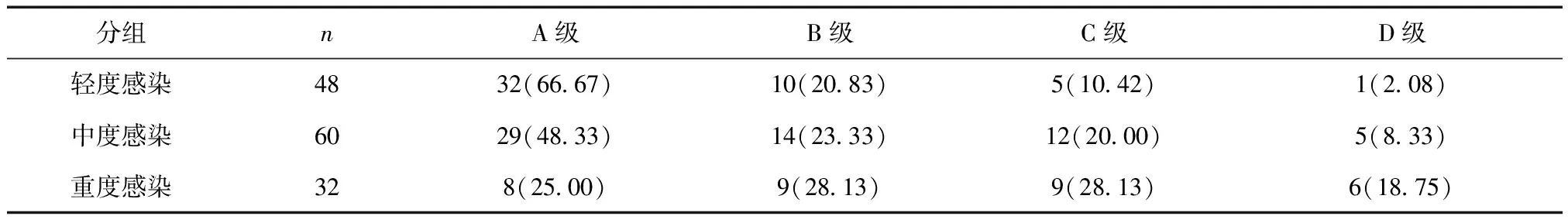
表3 不同感染程度患者TASC分级比较 [n(%)]
3 讨论
本组140例患者共培养出病原菌172株,排名前三位分别为金黄色葡萄球菌、铜绿假单胞菌、粪肠球菌;此外,链球菌、凝固酶阴性葡萄球菌、大肠埃希菌及肺炎克雷伯杆菌等亦较常见。提示DF溃疡感染患者病原菌以金黄色葡萄球菌、铜绿假单胞菌、粪肠球菌常见,主要以细菌感染为主,革兰阳性菌、革兰阴性菌感染风险均较高,与Flamm等[9]、黄婵娟等[10]的报道一致。此外,林红等[11]的研究发现,由于免疫力下降,随着DF溃疡感染患者感染程度的不断增加,导致毒力相对较小的革兰阴性菌感染的机会增大,病原菌由革兰阳性菌向革兰阴性菌转变,最终变为主导菌群,本研究不同溃疡感染程度的患者单一感染情况差异无显著性,可能与研究样本量及个体差异性有关。但在感染类型方面,本研究140例患者单一感染105例(75.00%)、混合感染35例(25.00%),不同感染程度患者感染类型比较差异有统计学意义,提示DF溃疡感染患者感染程度越严重,混合感染率越高。彭红侠等[12]的分析结果显示伴随DF溃疡患者细菌感染程度、下肢血管病变程度的持续加重,其混合感染的比例也随之升高,尤其是TASC分级为D级的患者混合感染率达66.67%,与本研究结果相符。因此,在临床干预治疗中,应严格控制细菌感染类型,合理选择抗生素,并进行严格的耐药监测。
目前已证实DM血管病变机制主要包括血管内皮受损、血管再生修复的能力受损,两者共同作用可导致血管产生病变,加之DM患者尤其是老年患者常常合并有高血压、高血脂等慢性病,自身免疫系统防御机制降低,可加重全身代谢紊乱、加速血管病变进程及导致更易发生感染[13]。而对于DF溃疡感染患者而言,非特异性免疫主要依靠吞噬细胞,吞噬细胞吞噬细菌往往需要通过血液循环到达感染部位,此过程可能减影响局部血运,从而表现为溃疡部分的血管病变造成动脉供血不足,最终导致下肢血管病变程度加重[14]。本研究显示,DF溃疡感染程度越严重,TASC分级越高,不同感染程度患者TASC分级比较差异有统计学意义,Logistic回归分析结果显示DF溃疡感染程度是TASC分级的影响因素,表明DF溃疡感染程度与下肢血管病变程度有关,与宋蓓等[15]的观点一致。同时,由于感染类型尤其是混合感染与DF溃疡感染程度密切相关,推测混合感染与下肢血管病变程度亦有一定的相关性。因此,在抗感染治疗的同时应注重早期解除局部病变血运障碍以控制病情。

