5例性发育异常合并异位肾上腺组织的临床分析
史精华,黄禾,钟定荣,陈博,陈蓉,田秦杰
(中国医学科学院 北京协和医学院 北京协和医院妇产科,北京 100730)
性发育异常是一类因性染色体、性腺或性激素异常而性别表现不典型的先天性异常,虽为少见病,却对患者本人及家庭造成严重的身心压力[1]。对于含有Y染色体而社会性别为女性的患者有发育不良睾丸容易发生肿瘤或恶变,通常选择性腺切除。其性腺病理多表现为发育不良或合并发生肿瘤[2]。性发育异常的患者其性腺组织发现异位肾上腺组织罕见,国内外鲜有报道。我们对2007年8月至2017年8月收治的139例性发育异常患者的临床资料进行回顾分析,发现有5例合并异位肾上腺组织,现报道如下。
临床资料与结果
病例1 患者女,23岁,因附件区包块于2014年8月入院。既往因“身高低于同龄儿”于9岁就诊我院内分泌门诊。查体发现发际低,内眦赘皮,肘外翻,染色体提示:45,X,诊为Turner综合征。予生长激素治疗8年后身高为158 cm,一直无月经来潮,以后转妇科内分泌门诊就诊,查乳腺发育I级,阴毛III级,口服结合雌激素(倍美力,惠氏制药有限公司,美国)0.625 mg qd,第15天开始加用甲羟孕酮(安宫黄体酮,上海信谊)4 mg×14 d,无月经来潮,检查骨龄,骨骺未愈合,行利维爱1.25 mg qd治疗,骨骺愈合后改为戊酸雌二醇片/雌二醇环丙孕酮片复合片(克龄蒙,先灵药业,德国)1片qd,可有撤退出血。2011~2014年周期性使用雌二醇片/雌二醇地屈孕酮片复合片(芬吗通,苏威制药,荷兰),月经为5~6/28 d;用药期间监测乳腺及盆腔B超,2013年7月23日B超:右附件区见中高回声,范围约1.7 cm×1.8 cm;无自觉症状,肿瘤标记物阴性;随诊中发现包块增大、查人类性别决定基因(SRY)(+)。于2014年8月15日于我院行腹腔镜双侧附件切除术,术后病理:(右侧性腺)恶性肿瘤,结合形态及免疫组化,符合无性细胞瘤;(左侧性腺)少许肾上腺皮质结构及散在午菲氏管残余,卵管未见特殊。术后予以顺帕+博莱霉素+依托泊苷(PEB)化疗两程,术后1年应用芬吗通规律撤退出血;随访36个月,子宫4.3 cm×3.7 cm×2.7 cm,月经周期规律,肿瘤无复发,余无特殊。
病例2 患者社会性别女,8岁,因有家族17α羟化酶缺乏病史,该患儿查染色体为46,XY,遂就诊我院内分泌科及妇科内分泌。监测血压140~150/80~90 mmHg;化验结果显示:促肾上腺皮质激素(ACTH)28.19 pmol/L,皮质醇23.17 nmol/L,24 h尿皮质醇(urine free cortisol,UFC)0 nmol/24 h,醛固酮(aldosterone,ALDO) 0.47 nmol/L(卧位),血浆肾素活性(Plasma renin activity,PRA) 0.45 μIU/ml(立位),17α羟孕酮(17a-OHP)1.60 nmol/L,孕酮高,睾酮低,高血压,低血钾;临床表现无第二性征发育,阴道呈盲端;B超未见子宫及卵巢,CT双侧肾上腺结节样增粗,考虑17α羟化酶缺乏。2015年7月腹股沟区超声:双侧腹股沟区低回声,不除外睾丸,为行腹腔镜性腺切除入院。入院查体身高150 cm,体重52 kg;外阴幼稚女性型,无阴毛,阴蒂不大,阴道与尿道分别独立开口,阴道深约4 cm。术前调整至血钾正常,术中未见子宫及输卵管,附件区各可见直径1.5 cm大小性腺,切除病理提示:(左右性腺)发育不良的睾丸组织,未见附睾;其中(右侧性腺)可见少量异位的肾上腺组织。术后复查:ACTH 6.78 pmol/L,ALDO 0.19 nmol/L(卧位),PRA 0.11 μIU/ml(立位);予以泼尼松 5 mg qd,随诊15个月,骨龄与年龄大致相当;激素水平LH 27.03 U/L,FSH 89.96 U/L,E2<19 pmol/L,P 15.42 nmol/L,T<0.35 nmol/L,因年龄小,暂时未用性激素补充治疗。
病例3 患者社会性别女,13岁,2017年1月上感恶心呕吐,伴四肢搐搦、强直、乏力,可自行缓解,同时出现烦渴、多饮多尿,当地测血压正常(具体不详),血钾 1.7 mmol/L,考虑“低钾血症”。予枸橼酸钾口服后体温恢复正常,恶心呕吐、四肢搐搦好转,停止补钾后再次出现恶心呕吐。1月23日转诊至市中心医院,查血钾低、尿钾升高,ACTH 52.85 pmol/L,皮质醇<13.79 nmol/L,24 UFC 103.22 nmol/24 h,ALDO 0.23 nmol/L(卧位),PRA 0.11 μU/ml(立位);FSH和LH升高、雌雄激素水平低、孕激素水平增高;影像学提示双肾上腺增粗,盆腔超声未见子宫或卵巢,核型为46,XY;左手腕骨骨龄片:相当于4岁女孩(实际年龄13岁);儿时有腹股沟包块手术史;经腹妇科超声:未见子宫、卵巢结构;双侧腹股沟超声:未见包块;查体:身高 150.5 cm,体重 39 kg,血压100/73 mmHg,全身肤色较深,双乳I期,幼女型外阴,阴毛I期,腹部、腹股沟未触及包块。考虑先天性肾上腺皮质增生(congenital adrenal hyperplasia,CAH),予氢化可的松早5 mg、晚7.5 mg和补钾治疗,用药后上述症状逐渐好转,每周监测血钾水平正常。7月12日考虑“CAH、17α羟化酶缺乏”收入我院。术前予以氢化可的松早5 mg,中5 mg,晚10 mg,腹腔镜探查见双附件区附睾及睾丸样结构2 cm×3 cm大小,无子宫;切除性腺病理回报(左右性腺)发育不良的睾丸组织,其中(右性腺)可见少许肾上腺皮质组织。术后予以戊酸雌二醇(补佳乐,拜耳医药,德国)1 mg qd+氢化可的松 5 mg tid,辅以补钙,复查ACTH 37.44 pmol/L,ALDO 0.23 nmol/L(卧位),PRA 0.11 μU/ml(立位),随诊3个月无特殊。
病例4 患者社会性别女,12岁,因“出生后阴蒂增大,体毛增多3年”就诊于我院。自出生即阴蒂大小约1.0 cm×0.5 cm,逐渐增长。2010年(6岁)外院查染色体46,XY;查体双侧腹股沟似可触及0.5 cm×0.5 cm大小肿物,可活动,大阴唇发育好,小阴唇发育差,阴蒂肥大,长约2.5 cm,似阴茎,可见正常尿道外口及阴道外口;盆腔B超提示可见片状子宫11 mm×5 mm×4 mm,未见明显卵巢,双侧腹股沟区未探及明确睾丸样回声;遂行腹腔镜探查+疝囊高位结扎+肥大阴蒂切除术,术中可见发育不良子宫及“双侧卵巢”,“右卵巢”发育差,与输卵管伞分离,双侧内环口未闭,内未探及睾丸及输精管,予以环扎;保留阴蒂头切除阴蒂体直至海绵体脚,阴蒂切除后送检病理示符合阴蒂组织学改变;术后患者阴蒂继续增大,体毛渐增多(胡须、腿毛),皮肤粗糙,音色改变。遂于2016年(12岁)就诊我院,查体:身高156 cm,体重53 kg,双乳房1级无腋毛,大阴唇着色有皱褶,阴蒂长约2 cm,阴毛女性分布,4级;骨龄相当于11~12岁;ACTH 6.98 pmol/L,皮质醇 427.59 nmol/L,甲功、空腹胰岛素、AFP、CEA、GH、17α-OHP 均正常,胰岛素样生长因子1(insulin-like growth factor1,IGF1)升高 78.05 nmol/L;FSH、LH及 T 明显升高;2016年1月超声:盆腔见子宫大小1.9 cm×0.8 cm×1.5 cm,未及确切卵巢回声,右侧肾上腺前支走形稍迂曲欠均;Y染色体微缺失基因检测:没有无精子因子(AZF)缺失;腹腔镜探查见盆腔偏左幼稚子宫,左侧可疑条索样性腺,右侧小睾丸样性腺直径约2 cm。行双侧性腺切除+保留血管神经的阴蒂缩短术,术后病理:(左侧性腺)输卵管组织,系膜可见小灶肾上腺组织;(右侧性腺)输卵管组织及发育不良的睾丸组织;(海绵体)符合海绵体组织。术后诊断部分型46,XY性腺发育不全,予以雌二醇片/雌二醇地屈孕酮片复合片治疗,3个月后月经初潮,随诊半年无不适。
病例5 患者社会性别女,13岁,因“间断头晕、乏力3年,发现血压升高8月”就诊于我院内分泌科。10岁起无明显诱因出现间断头晕、乏力;12岁6个月查体发现血压升高150~170/110~120 mmHg,血钾3.25 mmol/L,肝肾功无异常,尿蛋白(±),24 h尿蛋白 0.4 g;ACTH 28.76 pmol/L,皮质醇14.07 nmol/L,24 UFC低于可测值,ALDO 0.66 nmol/L卧位),PRA 0.34 μU/mL(立位);FSH和LH升高、雌激素水平低;染色体核型46,XY;基因检测提示CYP17A1纯合突变;给予卡托普利(开博通,百时美施贵宝,美国)12.5 mg tid、螺内酯(杭州民生药业)20 mg qd、补达秀(广州迈特兴华制药)0.5 g tid降压补钾,氢化可的松早10 mg、晚20 mg治疗,控制欠佳入院。入院查体:身高162 cm体重56 kg,体重指数(BMI)23.01 kg/m2;外阴幼女型,阴道与尿道口分开,可见阴道开口,无阴蒂肥大,阴毛I期;双侧腹股沟未触及包块;双乳I期,骨龄相当于8岁(实际年龄13岁);既往:母亲孕期曾服“转胎丸”;1岁半时因“肠套叠”行手术,5岁时发现右腹股沟肿物,当地医院考虑“腹股沟疝”行手术治疗。入院后改用地塞米松0.75 mg qn,并转入妇产科,术中见左侧睾丸与附睾位于腹股沟管内口处,右侧性腺粘连于盆壁,子宫缺如。术后病理回报:(左右)发育不良的睾丸组织,另见异位的肾上腺组织。术后地塞米松减至0.375 mg qn,血钾正常。术后予以补佳乐1 mg qd补充治疗促进发育。
5例患者术前血清性激素水平测定结果见表1。
表15例患者术前血清性激素水平测定结果(为早卵泡期参考范围)
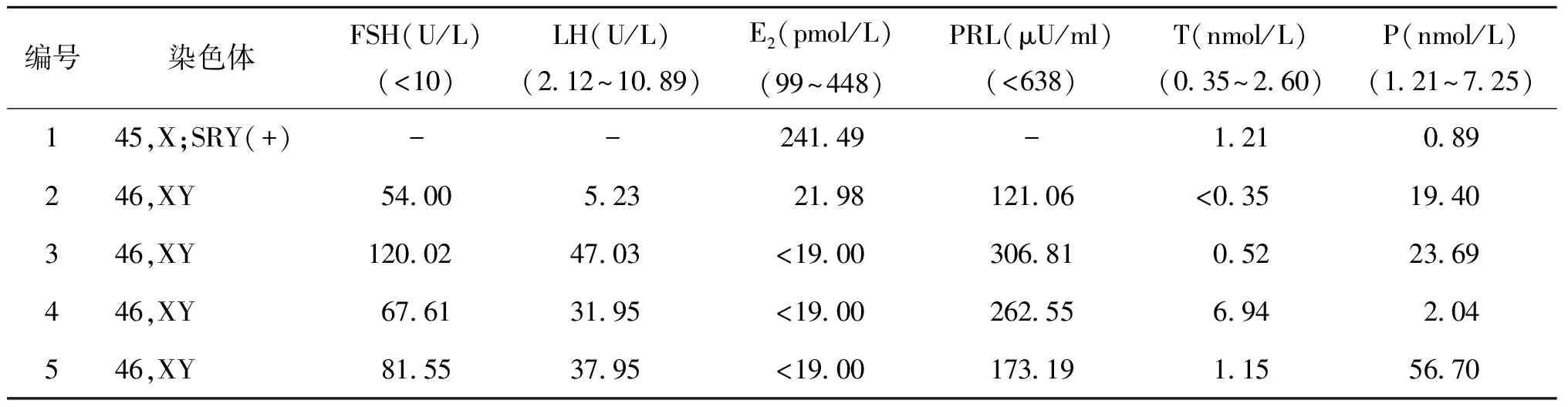
编号染色体FSH(U/L)(<10)LH(U/L)(2.12~10.89)E2(pmol/L)(99~448)PRL(μU/ml)(<638)T(nmol/L)(0.35~2.60)P(nmol/L)(1.21~7.25)145,X;SRY(+)--241.49-1.210.89246,XY54.005.2321.98121.06<0.3519.40346,XY120.0247.03<19.00306.810.5223.69446,XY67.6131.95<19.00262.556.942.04546,XY81.5537.95<19.00173.191.1556.70
表25例患者术后血清性激素水平测定结果
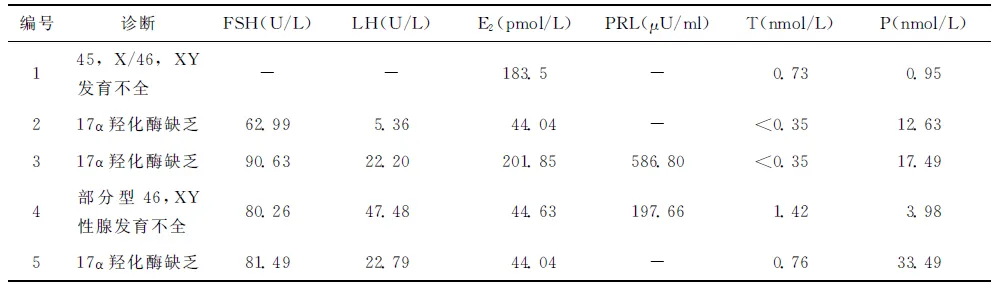
编号诊断FSH(U/L)LH(U/L)E2(pmol/L)PRL(μU/ml)T(nmol/L)P(nmol/L)145,X/46,XY发育不全--183.5-0.730.95217α羟化酶缺乏62.995.3644.04-<0.3512.63317α羟化酶缺乏90.6322.20201.85586.80<0.3517.494部分型46,XY性腺发育不全80.2647.4844.63197.661.423.98517α羟化酶缺乏81.4922.7944.04-0.7633.49
注:“-”表示未查
附:发育不良睾丸合并异位肾上腺皮质病理图
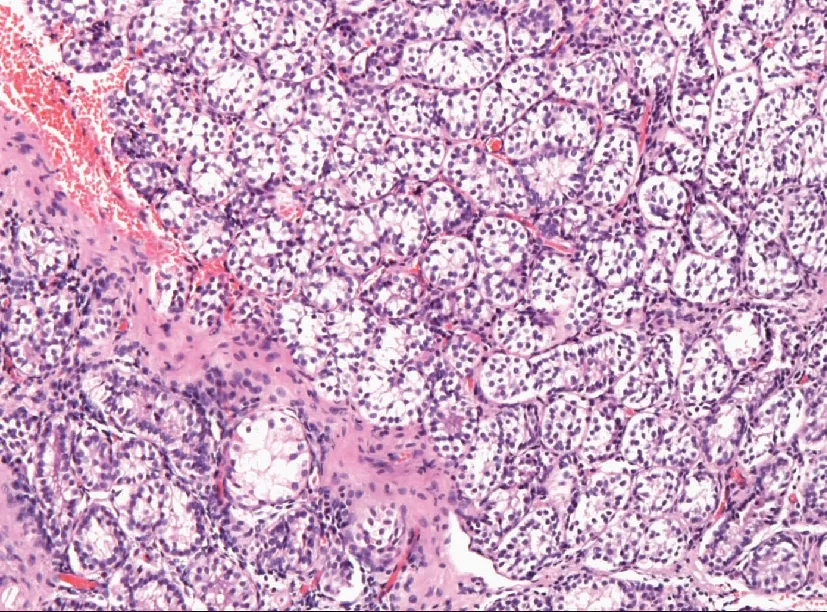
大部分曲细精管都只见支持细胞,仅罕见间质细胞,并且管腔大部分未打开,少数打开的管腔中仅极少数含有生精细胞,且生精细胞并不处在发育的各个阶段图1 发育不良的睾丸组织(HE染色 ×100)
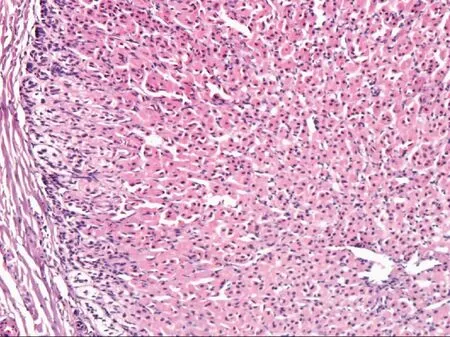
可见肾上腺皮质结构,球状带、束状带、网状带结构依次存在,细胞形态和排列,与正常的肾上腺皮质一致,未见肾上腺髓质结构图2 异位的肾上腺皮质(HE染色 ×100)
讨 论
一、异位的肾上腺组织
异位肾上腺组织并非罕见,主要见于靠近肾上腺的腹膜后,也较常见于肾脏、睾丸、精索、附睾及阴囊。此外,在颅脑、脊柱[3]、肝胆胰[4]、胎盘、阑尾、横结肠、阔韧带、卵巢[5]、腹膜、疝囊、肺部和心包膜等部位也有报道。多无功能且无明显症状,于手术治疗时才在手术部位意外发现[6]。无病变的异位肾上腺组织表现为黄色圆形或卵圆形结节,与周围组织界限清晰,直径1~5 mm不等。病理上应与发育不良的曲细精管、透明细胞转移肿瘤、脂肪母细胞瘤等相鉴别。一旦发现应予以完整切除,但无需术中常规探查[7]。
肾上腺组织异位于性腺多见于小儿泌尿外科手术,有报道至少50%的新生儿和婴儿可发现异位肾上腺组织。Dobanovacki等[8]报道了3 028例1~17岁患儿行腹股沟手术,术中及术后发现异位肾上腺组织在隐睾、鞘膜积液和腹股沟疝,发生率分别为2.4%、2.3%和2.0%。但妇科报道罕见。由于正常肾上腺的存在,随着年龄的增长绝大多数异位肾上腺组织将发生萎缩直至消失,只有少数得以残留,又被称为副肾上腺组织或肾上腺残余。异位肾上腺大多数只有皮质成分,少数既有皮质又有髓质。同原位肾上腺一样有增生或肿瘤的可能,因而如术中发现异位的肾上腺成分应同时切除[9]。
究其肾上腺组织异位原因,目前较为认可的为胚胎缺陷学说[10]:肾上腺发生于生殖腺附近,由共同原基形成。其皮质由位于后腹壁肠系膜根部与尿生殖嵴之间的间皮细胞群发生而来,而髓质由交感神经嵴衍生而来。随着髓质细胞向皮质区域迁移,肾上腺组织的碎片,尤其是肾上腺皮质的碎片可能被分裂开来。大多数碎片停留在正常肾上腺附近,少数与尿生殖嵴关系较为紧密的碎片则可能随着性腺迁移而异位。器官培养研究[11]表明,ACTH反应性细胞存在于生殖腺/中肾的边界,同时肾上腺类固醇细胞可以转移到XY性腺,我们的报道也与其相符,5例异位患者,4例染色体为46,XY,剩余一例虽未见Y染色体但SRY基因阳性,合并有无性细胞瘤。MacMahon等[12]报道了一例45,X/47,XY,+18染色体嵌合型的性腺发育不全患者考虑双侧性腺肿瘤,术中切除性腺的病理提示有异位的肾上腺组织,但文章并未解释这一现象。
二、先天性肾上腺皮质增生对异位肾上腺组织的影响
CAH是一种肾上腺激素合成紊乱的遗传性疾病。CAH合并睾丸肾上腺残余肿瘤(Testicular adrenal rest tumour,TART),又称为肾上腺生殖综合症,自从1940年报道以来陆续增多,发病率差异大,介于0~94%之间[13]。正常儿童性腺内肾上腺残余组织约1岁左右自然退化,CAH患者在控制不佳时,ACTH和血管紧张素Ⅱ增高,可能会刺激这些残余细胞增生,发生肾上腺残余瘤。年龄越大,CAH控制越差,TART发病率越高[11]。本文中一半以上(3/5)的患者均是由17a-羟化酶缺乏所致CAH。分析垂体代偿性分泌ACTH引起异位和在位肾上腺皮质增生,阻碍了睾丸内异位残余肾上腺细胞的退化,故而在儿童期仍然发现有残存的肾上腺组织。两例患者手术时均为儿童,如果未能及早发现并控制CAH,待成人后很可能会进展为TART。CAH合并TART治疗的经验表明,术中如发现异位的肾上腺组织应予以切除(尤其是肿瘤形成),对于术后治疗CAH有显著的改善作用。
同为性腺组织,然而卵巢肾上腺残余肿瘤(ovarian adrenal rest tumor,OART)发病却很罕见,至今国内外均是散在的个案报道[14]。Boyer等[15]认为Wnt4可能是TART及OART发病率差别的原因之一。女性性腺发育过程中需要Wnt4阻止合成类固醇细胞从中肾迁移至发育中的卵巢,抑制CYPl7A1(Cytochrome P450 17A1,细胞色素17A1)及HSB3B2酶(type 2 gene of 3β-hydroxysteroid dehydrogenases,3β羟类固醇脱氢酶2型)的活性,抑制异位类固醇合成。因而对肾上腺原基细胞发育为OART或迁移至卵巢性腺均有抑制作用,仅当女性患者在ACTH的刺激下,且Wnt4的抑制作用不足才可发生OART,因而发病率低。此外,因为很少在年轻的女性患者中切除不发育的性腺,因此发现OART的机会更低。
关于性发育异常患者合并异位肾上腺组织国内尚缺少相关报道,我们对其发生的可能机制和治疗的原则多借鉴于睾丸异位肾上腺组织的情况。文献的回顾结合我们报道的5例患者,我们认为对于性发育异常尤其合并有CAH的患者,临床医生和病理医生应提高异位肾上腺组织的意识和加强对其诊治,一旦发现应予以切除并严密随诊。随着对该疾病的发现,也期待有更多的病例资料的报道,以总结经验提高对该疾病诊治的认识。

