生长激素应用于卵巢低反应患者的不同添加方案
朱芳芳,马瑞红,胡琮琦,夏天*
(1.天津中医药大学,天津 300192;2.天津中医药大学第一附属医院生殖中心,天津 300380)
卵巢低反应(POR)是指在控制性卵巢剌激(COS)过程中,卵巢对促性腺激素(Gn)反应不良的一种病理状态。在求助辅助生殖技术的不孕女性中,发生POR的概率约为9%~24%[1]。由于POR患者获卵数少,卵母细胞及胚胎质量较低,且周期取消率高,导致其妊娠率低至10%~20%[2]。因此,如何有效改善POR患者在促排卵过程中的卵巢反应性,提高获卵数及妊娠率,已成为国内外辅助生殖技术中亟待解决的瓶颈问题。
生长激素(GH)是一种由垂体前叶嗜酸性细胞分泌的多肽类激素,由191个氨基酸和2个二硫键组成,受下丘脑生长激素释放激素和抑制激素的双向调节,对组织和细胞具有广泛的生理作用。近年来研究发现,GH对生殖系统具有重要的调控作用,尤其是在卵泡发育及子宫内膜容受性的改善等方面起到积极作用,因此在POR患者进行IVF-ET治疗的过程中得到广泛应用。但何时添加GH以取得更好的临床疗效,以及GH的最佳使用剂量是多少,目前尚未有统一认识。本文将就以上问题作一综述。
一、GH对卵巢功能的调节
研究发现,在小鼠的卵泡膜细胞、颗粒细胞及卵母细胞中均存在生长激素受体(GHR)的广泛表达[3],而类似的研究结果也在母鸡、山羊、牛及灵长类动物实验中得到证实[4-6];Weall等[7]则通过对人卵母细胞GHR的免疫荧光定位,证实了GHR在人类卵母细胞内的存在。以上研究均为GH调节卵巢功能提供了作用基础。
目前认为,GH对卵巢的作用途径主要有两种:一是直接与卵巢上的GHR结合,发挥生物学效应;二是继发于其对类胰岛素样生长因子1(IGF-1)分泌调节功能。Hull等[8]提出肝源性IGF-1仅作为GH分泌的负反馈调节,卵巢颗粒细胞自身所分泌的IGF-1作用或许更为重要,其与颗粒细胞表达的IGFs受体和结合蛋白形成旁/自内分泌系统,共同促进卵巢类固醇的生成和卵泡的发育。
二、GH对不同阶段卵泡发育及胚胎质量的调控
研究显示[9],将小鼠GHR基因敲除后,初级卵泡、次级卵泡及窦卵泡数明显减少,始基卵泡比例增加,提示GH可直接或间接影响始基卵泡的募集;通过对山羊卵泡进行免疫组化分析[10],山羊窦卵泡的膜细胞和颗粒细胞中显示大量的GHR mRNA的表达,窦前卵泡周围的基质中也有部分GHR mRNA的表达,提示GH对维持窦前卵泡及窦卵泡的发育起重要作用;在对家犬窦前卵泡进行体外培养时,添加GH可通过影响颗粒细胞的增殖和分化,促进E2的分泌,影响窦前卵泡的发育,且发育速度具有GH剂量依赖性[11]。
另外,GH可通过上调自身受体的表达、提高卵母细胞内线粒体活性,直接改善卵母细胞的质量[7];GH可通过刺激增殖、抑制凋亡作用,调节卵丘细胞的扩张,激活多个信号传导通路,间接促进卵母细胞核成熟[12];而在卵母细胞体外培养基中添加GH,可提高卵母细胞发育为MII卵的潜能[13]。
COS过程中应用GH可使患者胚胎质量得到改善,提高临床妊娠率[14]。研究显示,移植前胚胎的各个阶段均可发现GHR mRNA的表达[15];Femandez等[16]对高龄反复助孕失败的女性应用GH后,使得患者优质囊胚形成率增加,并显著提高胚胎整倍体率,有效改善胚胎质量。这为GH在胚胎发育早期阶段的作用提供了直接证据。
三、GH在不同年龄POR患者中的应用
2011年欧洲人类生殖与胚胎协会(ESHRE)推出了POR诊断的博洛尼亚标准[17]:(1)高龄(≥40岁)或存在POR的危险因素;(2)前次常规刺激方案的IVF周期中获卵数≤3个;(3)异常的卵巢储备测试结果[基础窦卵泡(AFC)<5个~7个,或抗苗勒管激素(AMH)水平<0.5 mg/L~1.1 mg/L]。POR的诊断需符合以上3点中的至少2点。因此POR患者按年龄区分可分为高龄人群,和年轻而卵巢储备功能低下人群。而对于不同年龄段的POR患者,GH的添加方案和临床疗效有所差异。
郭莹等[18]的研究中,对不同年龄段的卵巢储备功能低下(DOR)患者应用GH,结果显示:年龄≥35岁的患者,添加GH可减少Gn用量,提高HCG日E2水平及获卵数;而对于年龄<35岁的患者,其卵巢反应性及IVF-ET结局均无显著改善。宋慧玲等[19]也得出相似结论。Du等[20]发现对于年龄≥35岁的卵巢储备功能正常的不孕女性,添加GH可将其胚胎种植率及临床妊娠率提高2倍以上。探寻为何应用同等剂量的GH,高龄女性似乎可以取得更好的临床疗效。从GH的分泌规律来看,自青春期后,随着女性年龄的增长,体内GH的分泌呈递减趋势,40岁以后,女性体内GH的分泌量仅为青春期时的35%~50%。因此对于不同年龄段的POR患者,所需外源性GH的剂量有所不同,GH的补充方案应该个体化制定。
四、GH的不同添加方案
最早于1988年,Homburg等[21]首次将GH应用于生殖领域,联合应用GH和Gn后,减少了低反应人群的Gn的用量和使用时间,改善了卵巢反应性。随后,证明GH可通过增加GHR的表达,改善线粒体活性,有提高高龄女性IVF-ET治疗后的优胚率和妊娠率的趋势[22];但将GH应用于促性腺激素正常的人群中却无获益[23];也有在临床试验中,添加GH未能有效改善POR患者的妊娠结局[24]。
GH的相关临床研究结果差异性较大,可能与受试者的年龄、代谢能力、GH不同的添加时机与使用剂量有关[25],基于目前的临床研究,在POR患者IVF-ET过程中,GH的添加方案主要有以下几种:Gn启动前4~6周、前一月经周期黄体期、Gn启动时和卵泡中期。使用剂量则从0.5 U/d到12 U/d不等(如表1所示)。
1.启动前4~6周:此时为小窦卵泡阶段,多采用小剂量、长疗程的治疗方式。在Femandez等[16]的研究中,32例POR患者取卵前至少5周开始使用GH 1 U/d,直至HCG注射日,将其常规促排卵获得的胚胎与应用GH后获得的胚胎进行自身前后对照,结果显示GH虽未能增加获卵数,但有效提高了优质囊胚率、胚胎整倍体率、胚胎种植率及妊娠率;在Keane等[26]的回顾性研究中,患者自IVF前一周期的2~3 d起,皮下注射GH 1.0~1.5 U/d,直至HCG注射日,总疗程约6周。尽管试验组的平均年龄较大,且AMH平均值偏低,仍获得了更高的胚胎种植率、临床妊娠率及活产率,但无法确认是胚胎介导还是子宫内膜介导的结果;并在 Logistic回归分析中得出结论:仅年龄、胚胎质量、添加GH是取得临床妊娠(OR:0.90、5.00、2.49,P<0.002)和活产(OR:0.91、3.90、4.75,P<0.014)的独立预测因素。
2.黄体期:一般于长方案GnRH-a降调节的同时加用。Kucuk等[27]对61例POR患者进行随机对照研究,试验组降调节的同时加用GH 4 mg/d(约为12 U/d)直至HCG注射日,结果显示试验组Gn用量及使用时间减少,HCG注射日E2水平、MII卵数、2PN率明显高于对照组(P<0.0001),临床妊娠率呈明显上升趋势(试验组11/31,对照组5/30),但由于样本量有限,差异无统计学意义(P>0.05);与Kucuk等[27]的大剂量GH添加方案相反,Lattes等[28]认为,临床上GH的常用剂量为GH缺乏患者的常用治疗量,POR患者并不完全等同于GH缺乏,因此提出了对体内GH正常的低反应人群采用低剂量的GH补充方案:自黄体期降调节第一天开始加用GH 0.5 U/d直至HCG日,自身前后对照结果显示:虽获卵数及Gn用量无显著差异,但增加了受试者的优胚数和冻存胚胎数,并将临床妊娠率提高到了34.4%。提示低剂量的GH也可有效改善卵母细胞质量,并降低不良反应的发生,为患者节约经济成本。而在另外3项临床试验中[24,29-30],黄体期添加GH并未能有效改善POR患者的妊娠结局。
3.Gn启动时:吴洪波等[31]的回顾性分析中,共纳入188例POR患者,试验组自Gn启动时即加用GH 4.5 U/d,至HCG注射日。结果显示试验组卵巢反应性相关指标有效改善,获卵数、MII卵母细胞数、优胚数均高于对照组,但对妊娠结局无显著改善,与林碎玲等[32]的研究结果相似;而在一项荟萃分析中显示[33],在Gn过程中加用GH可有效改善IVF-ET的临床妊娠率和活产率;黄体中期添加GH,则无显著差异。但是该Meta分析所纳入的黄体期添加GH的临床报道中,GH整体用量偏小,结论可能有所偏差。
4.卵泡中晚期:在Bassiouny等[34]及Bayoumi等[35]的两项临床试验中,均于拮抗剂方案Gn第6天开始加用GH 2.5 mg/d(约为7 U/d),直至HCG注射日。结果显示卵巢对Gn的敏感性增加,获卵数、可移植胚胎数及子宫内膜厚度提高,但妊娠结局却无显著改善。Tesarik等[36]对高龄不育患者于Gn使用第7天加用GH 8 U/d联合治疗,结果显示两组获卵数、胚胎数、临床妊娠率差异无统计学意义,但试验组流产率显著降低,因此活产率明显升高。其作用机制可能是由于GH提高了卵母细胞的发育潜能,但对子宫内膜的改善作用也不可忽视。
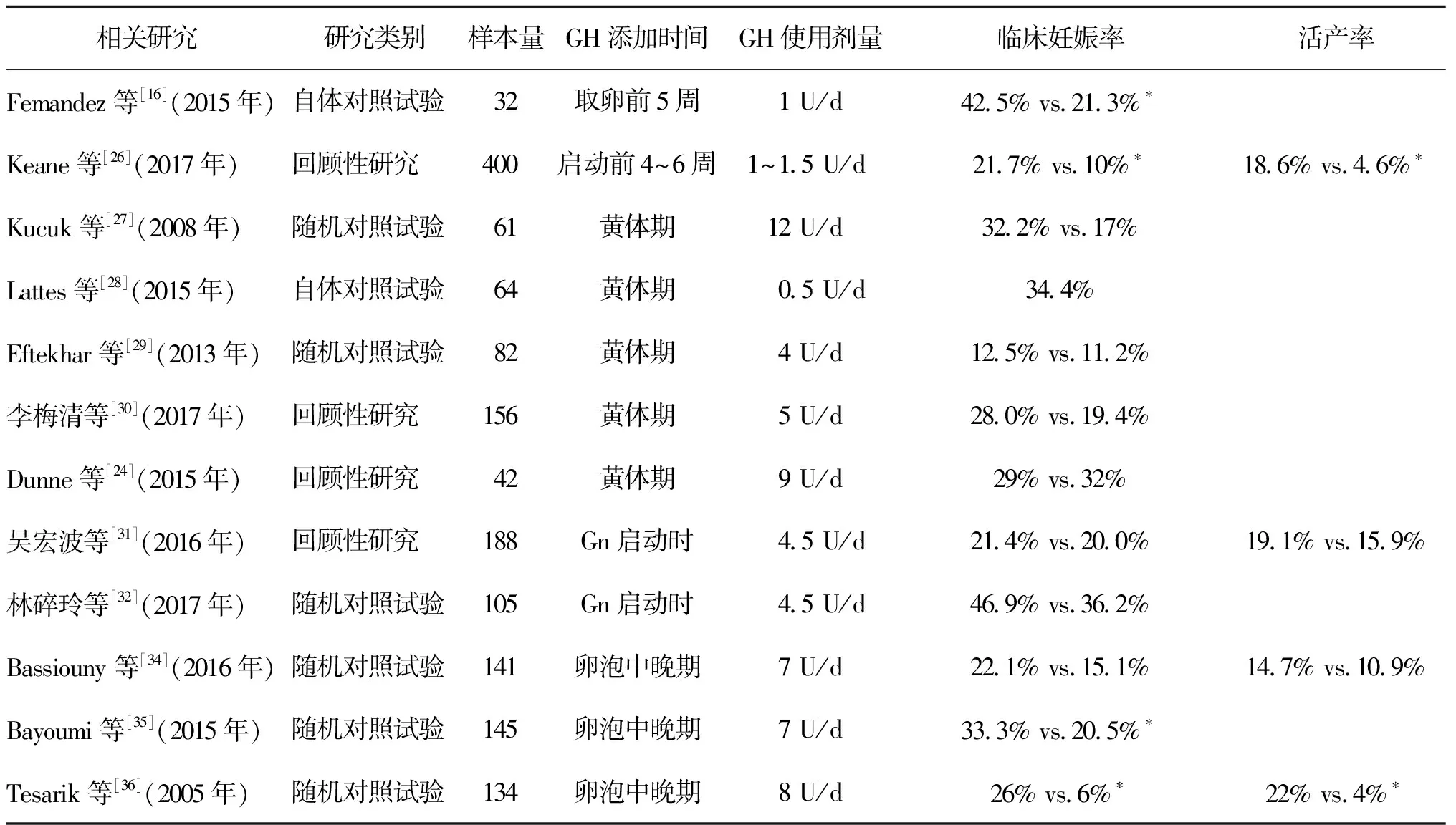
表1 相关临床试验
注:观察指标为试验组vs.对照组,*P<0.05
五、小结
综合以上数据,可以看出,当GH的预处理时间延长时,可能更有效改善POR患者的妊娠结局。从GH对不同阶段卵泡发育的影响机制分析,延长GH的添加时间,可更有效作用于窦前卵泡和小窦卵泡,通过上调GHR的表达,促进颗粒细胞的分化和增殖,帮助卵泡的募集并减少凋亡;促进类固醇的合成,改善线粒体功能,从而提高卵母细胞的质量,增加了其发育为胚胎的能力,提高了胚胎种植率,最终增加成功妊娠的可能性。当然这一过程也不能忽视GH对子宫内膜容受性的改善作用[37]。理论上说,随着患者年龄的增大,所需外源性GH的剂量相应增加,GH的添加时机及剂量应结合患者年龄及卵巢储备功能进行个体化调整,但最低有效剂量仍需进一步探索。
目前,关于GH改善卵泡发育及胚胎质量的研究多为动物试验,临床研究较少,且整体样本量偏小,部分试验未能采取随机对照研究方法,可能会造成偏倚较大,使得试验准确性降低。因此,如何添加GH以取得最佳的临床疗效,未来尚需要大样本的、随机、双盲的临床试验来证实。

