HPV E6/E7 mRNA与YAP在宫颈癌中的表达与相关性研究
李 娜,李洪林,尹利荣
(天津医科大学第二医院妇科,天津300211)
宫颈癌是全球妇女最常见的恶性肿瘤之一,仅次于乳腺癌,居世界第二位,严重威胁妇女的生命健康[1]。众所周知,宫颈癌由宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN) 发展而来,宫颈癌的发生发展是一个漫长的过程,宫颈上皮内瘤变(CIN)即为宫颈癌前病变[2],从CIN发展到宫颈癌大约是10年的时间。早期宫颈癌患者5年治愈率高达90%,因此,CIN的早期诊断治疗对降低宫颈癌的发生率和死亡率至关重要。目前,宫颈癌的发病机制越来越受到国内外学者的关注,成为研究热点。大量研究表明,人乳头状瘤病毒(human papillomavirus,HPV)感染是宫颈癌发生的主要原因,特别是高危型HPV感染。高危型HPV的E6、E7蛋白在肿瘤的发生发展中起重要作用。超过90%的浸润性宫颈癌都能检测到HPV感染,甚至95%的癌前病变患者携带HPV,HPV感染是宫颈癌的主要致病因素,但只有很少病例最终发展到浸润性宫颈癌。因此,HPV感染虽是细胞恶性转化的重要致病因素,但还有其它致病因素存在,才能最终发展到宫颈癌。近年来发现,Hippo信号通路与肿瘤的发生密切相关,YAP作为该通路重要的效应因子可以诱导细胞增殖并抑制凋亡。但目前在宫颈癌中关于HPV感染与YAP表达的相关研究报道较少,对于两者在宫颈癌的发生中是否存在协同作用尚不清楚,因此本文通过研究宫颈病变中HPV E6/E7 mRNA与YAP的表达情况,探讨两者在宫颈癌发生中的相关性。
1 资料与方法
1.1 一般资料 随机选取2014年6月-2015年6月在我院妇科就诊后行手术治疗的患者124例,其中将行宫颈锥切病理诊断为CINII-III的45例患者归为CIN组,将病理诊断为宫颈癌并行广泛全子宫切除+盆腔淋巴结清扫术的43例患者归为宫颈癌组。按WHO组织病理学分类,其中鳞癌29例,腺癌14例;宫颈癌分期采用国际妇产科联盟(FIGO)2009年的诊断标准,其中Ⅰ期25例,Ⅱ期18例;按肿瘤分化程度进行分级:高分化16例,中分化18例,低分化9例;盆腔淋巴结转移情况:有转移22例,无转移21例。对照组36例选自同时间段在我院因子宫良性病变(子宫肌瘤以及腺肌症后行宫颈活检的病例)行子宫全切术的正常宫颈标本,术后经病理证实无宫颈病变。对照组年龄26~56岁,平均年龄为(43.58±8.476)岁,中位年龄 45岁;试验组年龄18~72岁,平均年龄(46.65±11.623)岁,中位年龄46岁,两组年龄比较无统计学差异(P>0.05)。所有病例排除生殖道急性炎症,排除合并其他恶性肿瘤以及已行放化疗的宫颈癌组织标本,临床及病理资料完整。
1.2 试剂及仪器 宫颈稳态试剂盒及96孔检测板[科蒂亚(新乡)生物技术有限公司];Quanti VirusTM台式冷光仪;恒温箱(型号QS071);兔抗人YAP多克隆抗体(Santa Cruz Biotechnology);生物素标记的抗兔IgG(二抗)(北京中杉金桥生物技术有限公司);SP试剂盒和DAB酶底物显色试剂盒(北京中杉金桥生物技术有限公司)。
1.3 方法
1.3.1 HPVE6/E7 mRNA的检测 (1)标本采集:使用液基细胞学Autocyteprep系统专用刷插入受检者子宫颈旋转8~10圈,收集宫颈口及颈管脱落上皮细胞,然后将刷头部放入装有CytoRich保存液的小瓶内供HPVE6/E7 mRNA检测。(2)实验步骤:将液基细胞学标本放入离心管水平离心2次(3000r/min,5 min),使标本同质化。加入600 μL细胞裂解液和5 μL蛋白酶K,吹打混匀,放入65℃恒温箱1 h,中间取出标本管振荡2~3次,使细胞充分裂解,待测。按照宫颈稳态试剂盒说明书操作及配置相关溶液并布板,其中阳性对照液,空白对照液均做复孔。经过信号放大,加入标记荧光物质的底物后,在冷光仪上检测。检测结果为光子数,经计算软件转换为拷贝数。本研究以mRNA拷贝数≥1 copy/mL为阳性。
1.3.2 YAP的检测 通过预实验取最佳一抗工作浓度1:200进行试验,按常规步骤通过免疫组化SP法检测正常宫颈组织、宫颈上皮内瘤样病变和宫颈癌组织中YAP的表达情况。所有操作步骤依据产品说明书进行,二抗为生物素标记的抗兔IgG,用二氨基联苯胺(DAB)显色,苏木精复染,常规脱水、透明、干燥、封片,显微镜下观察分析结果。已知阳性组织片做阳性对照,用PBS代替一抗作为阴性对照。每例常规进行HE染色。
1.4 结果判读 所有切片的观察均经2~3名病理科医生独立在光镜下完成。YAP免疫组化染色结果判定:以胞浆和胞核中出现棕黄色颗粒或者棕褐色颗粒为阳性。每例均随机观察5个高倍视野(×400),用半定量积分法判断结果,染色阳性细胞所占比例按以下标准计分:阳性细胞≤5%为0分,6%~25%为 1分,26%~50%为 2分,51%~75%为3分,>75%为4分;染色强度计分以细胞显色反应程度计分:无着色0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;最后将阳性细胞所占的百分比分值和染色强度分值相乘为结果:0~2分为阴性,3分及以上为阳性。
1.5 统计学方法 所有实验数据资料均采用SPSS17.0统计软件进行分析,应用χ2检验分析HPV E6/E7 mRNA和YAP在不同宫颈组织中的表达情况,并分析YAP的表达与宫颈癌临床病理参数之间的关系,采用Spearman等级相关检验分析HPV E6/E7 mRNA与YAP的相关性,数据以检验水准α=0.05,P<0.05为差异具有统计学意义。
2 结果
2.1 不同宫颈组织中HPV E6/E7 mRNA的检出情况 HPV E6/E7 mRNA的阳性检出率随着宫颈病变程度的升高而逐级升高(正常组16.67%、CIN组82.22%、宫颈癌组88.37%),3组比较差异具有统计学意义(P<0.001)。正常组与CIN组、正常组与宫颈癌组组间差异具有统计学意义(P<0.05),CIN组和宫颈癌组,组间无明显差异(P>0.05),见表1。
2.2 不同宫颈组织中YAP的表达情况 免疫组化染色结果显示,YAP表达以胞核为主,在胞质中部分表达。YAP在正常组中的表达明显低于CIN组及宫颈癌组,3 组之间比较,χ2=66.193,P<0.001,差异具有统计学意义(P<0.001)。再两两之间进行比较,发现正常组与宫颈癌组、正常组与CIN组两两比较差异具有统计学意义(P<0.05),但CIN组与宫颈癌组之间比较无明显统计学意义(P>0.05),见表2、图1。

表1 各组HPV E6/E7 mRNA检出情况Tab 1 The positive rate of HPV E6/E7 mRNA in each group

表2 各组YAP的表达情况Tab 2 The expression of YAP in each group
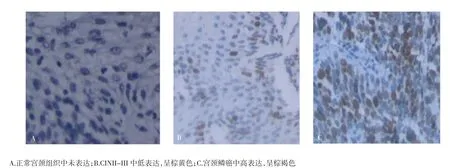
图1 YAP在正常宫颈、CINII-III、宫颈鳞癌组织中的表达(免疫组化法,×400)Fig 1 Expression of YAP in normal cervical tissues,CINII-III and cervical squamous cell carcinoma(IHC,×400)
2.3 YAP的表达与宫颈癌临床病理参数间的关系 在宫颈癌组织中,YAP在有淋巴结转移组中的表达明显高于无淋巴结转移组(P<0.05),而与宫颈癌的临床分期(I、II期)、组织学分级以及组织学类型无相关性(P>0.05),见表 3。
2.4 HPV E6/E7 mRNA与YAP表达的相关性分析 经Spearman等级相关分析,宫颈癌组织HPV E6/E7 mRNA和YAP表达具有正相关性,r=0.383,P=0.011,见表 4。
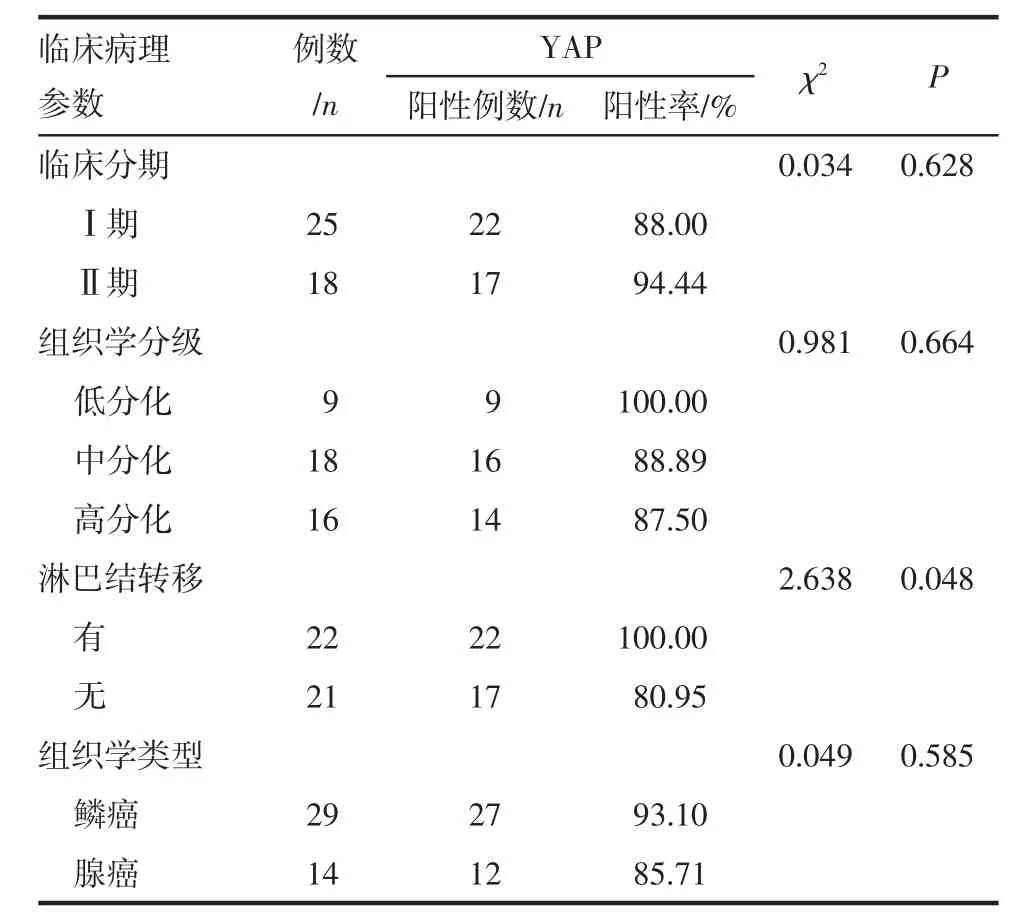
表3 YAP的表达与宫颈癌临床病理参数的关系Tab 3 The relationship between the expression of YAP and clinical pathological parameters of cervical carcinoma
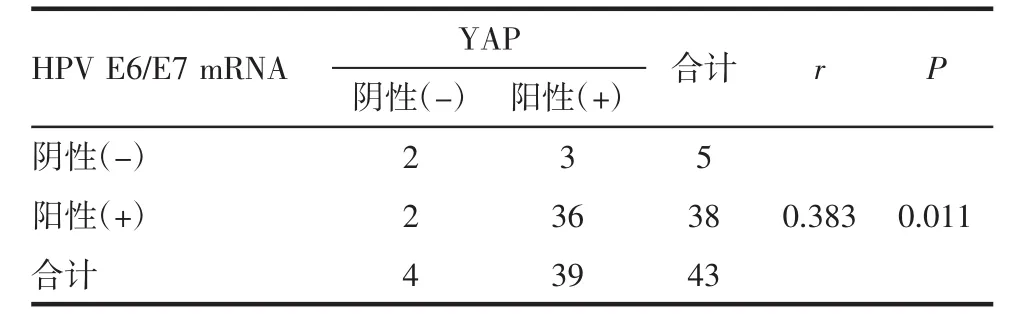
表4 HPV E6/E7 mRNA与YAP在宫颈癌中表达的相关性Tab 4 The correlation between the expression of HPV E6/E7 mRNA andYAPincervialcarcinoma
3 讨论
3.1 HPV E6/E7与宫颈病变的关系 HPV致癌的主要环节就是高危型HPV16、18编码的E6、E7致癌蛋白分别与抑癌基因p53和pRb结合,使p53通路和Rb通路失活,导致细胞周期调控异常,引起宫颈癌的发生。子宫颈的鳞状上皮和柱状上皮交界处是HPV的易感部位。HPV感染宿主后,HPV DNA与宿主染色体进行整合。HPV与宿主细胞染色体的整合是宫颈细胞永生化过程中的重要步骤,是导致宫颈上皮内瘤变向宫颈癌恶性进展的一个重要标志[3]。由于E2基因不稳定,HPV DNA与宿主细胞的整合常引起E2基因的缺失,E6、E7的转化作用受E2的调控,E2片段缺失可导致E6和E7基因表达失控,通过干扰细胞周期调节和有丝分裂,引起细胞转化和癌变发生。本研究结果提示,随着宫颈病变级别的升高,HPV E6/E7 mRNA的阳性检出率逐级升高,正常组、CIN组、宫颈癌组比较,差异有统计学意义(P<0.05),提示,HPV E6/E7 mRNA 是宫颈癌发生发展的重要因素。因此,HPV E6/E7 mRNA的检测,对于及时发现、干预宫颈癌的发展、协助临床诊断、指导预后均具有重要的意义。
3.2 YAP与宫颈病变的关系 Hippo通路在通过抑制细胞增殖和促进凋亡来调控器官大小和肿瘤的发生中起着关键的作用。YAP最初由Sudol[4]于1994年发现,是一种细胞内转录共激活因子和连接蛋白,参与调控细胞生长、增殖和凋亡。YAP基因定位于染色体11q22[5],编码相对分子量约65kda富脯氨酸的鳞蛋白,被认为是一种有效的致癌基因和Hippo信号通路的核效应器,通过增强转录因子的活性促进基因表达。YAP在正常组织中表达很低,可维持细胞生长、分化、凋亡的稳态平衡。如果任一环节突变,恶化的细胞表达过量的YAP,超过正常生理调控功能,导致YAP在胞质内异常聚集,并不断向核内转移,激活下游靶基因,有利于肿瘤的发展、恶化。大量研究表明,Hippo-YAP信号转导通路与人类肿瘤发生发展关系密切[6],许多肿瘤中染色体扩增区域都含有YAP基因,并且YAP在正常组织和恶性肿瘤中的表达存在明显差异,多数癌组织中的表达较对照组明显升高,并呈上升趋势。在胰腺癌[7]、胃癌[8]、肝癌[9]及非小细胞肺癌[10]中,YAP 表达量均明显高于正常组织,说明YAP在恶性肿瘤的发生、发展中发挥着重要的作用。Liu等[11]应用免疫组织化学方法检测120例鳞状细胞癌、42例腺癌、22例正常宫颈组织YAP的表达水平,并对细胞质与细胞核中YAP的表达单独分析,发现YAP在肿瘤中的表达水平明显高于正常组织。研究证明了YAP在宫颈癌的致癌潜能及其在鳞状细胞癌和腺癌中的独特功能。
本实验结果显示:YAP在正常组、CIN组以及宫颈癌组中的表达呈上升趋势,且差异具有显著性(P<0.05),可以推断出YAP的表达可能参与了宫颈癌的发生过程,并且YAP有可能在宫颈癌的临床诊断中具有重要价值。本实验的结果和YAP在其他大部分肿瘤中的报道是一致的。在宫颈癌组织中,YAP在有淋巴结转移组中的表达明显高于无淋巴结转移组(P<0.05),而与宫颈癌的临床分期(I、II期)、组织学分级以及组织学类型无相关性(P>0.05),提示YAP在宫颈癌的浸润转移中起着重要的作用。YAP可作为判断宫颈癌生长、浸润以及转移能力的指标,对肿瘤进展的辅助诊断以及预后评估是非常有帮助的,YAP的表达越高,宫颈癌的恶性侵袭性越强、病情进展越快,说明了YAP的扩增、突变可能促进了宫颈癌的侵袭和转移。
3.3 HPV E6/E7 mRNA与YAP的相关性 研究表明YAP与HPV都与p53家族相关联。P53是一种应激激活的转录因子,防止基因受损细胞的增殖。p53基因是一种调节细胞程序性死亡和细胞周期相关途径的关键调节因子,激活细胞周期检查点和促进细胞衰老,它已被认为是肿瘤抑制的主要参与者。p53损失或失活促使异常细胞克隆扩增,导致基因组不稳定。高危型HPV的癌蛋白E6和E7通过干扰p53途径实现宫颈细胞转化和永生化。YAP通过调节p53活性来控制转录。已发现YAP与p73和p63通过WW结构域和PPPY结构相结合,p73和p63为p53肿瘤抑制家族的新成员。此外,Xiao等[12]应用免疫组化的方法检测慢性炎症组、CIN组、宫颈癌组YAP的表达,用HPV基因检测试剂盒检测各组HPV的感染率,结果表明,YAP与HPV检测相结合,可以区别宫颈癌前病变和良性病变。
综上所述,本研究发现YAP可作为宫内上皮内瘤变和宫颈癌的预测标志物。联合检测HPV和YAP可以提高宫颈病变的诊断率,通过早期干预从而降低宫颈癌的患病率。

