茶树CsNCED2基因的克隆和表达分析
王 赞,陈 丹,岳 川,曹红利,郭雅玲
(福建农林大学 园艺学院,茶学福建省高校重点实验室, 福州 350002)
脱落酸(abscisic acid, ABA)作为一种重要的植物激素不仅在促进根系生长[1]、抑制萌发[2]、花芽分化及成花调控[3]、促进果实成熟和脱落[4]等重要植物生理活动中起作用,同时在植物逆境胁迫响应中发挥不可替代的生理效应。在高等植物中ABA主要以间接方式合成,包括在质体内C40的玉米黄质催化生成环氧类胡萝卜素[5],紧接着被9-顺-环氧类胡萝卜素双加氧酶(9-cis-epoxycarotenoid dioxygenase,NCED)裂解形成C15脱落醛,最后在细胞质中合成ABA[6-7]。环氧类胡萝卜素裂解氧化形成ABA重要前体物——脱落醛,该反应是此通路中的限速步骤,调控该反应的NCED则是公认的关键限速酶[8]。第一个NCED编码基因是在玉米中鉴定到[9],目前已经在拟南芥中鉴定出5条NCED家族基因[10],NCED表达水平与ABA信号转导通路[11]和ABA含量有着直接关系[12]。
大量研究显示,逆境胁迫能够诱导NCED表达进而调控内源ABA的合成,提高植物的抗性。例如将小麦NCED基因在拟南芥中过表达可以提高其对干旱胁迫的耐受性[13],而抑制该基因表达则导致上游类胡萝卜素积累,内源ABA含量降低,代谢通路阻塞[14]。5条NCED基因之一的NCED2在多种植物中被证明具有重要的抗逆作用。NCED2在叶片和根中的高表达而累积ABA,使得酸橘在田间缺水时具有良好的耐旱性[15]。NCED2上调表达诱导了黄瓜幼苗抗氧化酶活性,减少应激性氧化对光系统的损伤,增加胁迫耐受性[16]。
另外,转录因子MYB可直接与NCED2启动子位点结合调控ABA生物合成,影响种子新陈代谢促进休眠[17]。另一种转录因子NAC则诱导拟南芥NCED2过表达而导致叶片衰老[18]。
在茶树研究中,刘声传[19-20]克隆了CsNCED1、CsNCED4基因,分析其在茶树干旱和复水下的表达模式。Cho等[21]在研究‘东方美人’乌龙茶做青过程中发现NCED表达存在显著性差异,但NCED表达及内源ABA含量变化与茶叶香气品质的相关性还不明确。目前在不同胁迫条件下和其他茶类加工过程中,茶树CsNCED2基因表达模式分析报道比较少见。所以进一步探明茶树CsNCED2在多种胁迫的广谱表达模式,以及在不同加工过程中的胁迫应激表达分析有重要意义。
本研究以铁观音茶树品种嫩梢第二叶为供试材料,利用RT-PCR技术克隆了一条茶树CsNCED2全长序列。采用qRT-PCR技术检测该基因在茶树不同组织、闽南乌龙茶做青、白茶萎凋过程以及逆境胁迫中的表达模式,以期为明确CsNCED2参与茶树抗逆生理活动和加工应激响应方面提供理论依据。
1 材料和方法
1.1 试验材料与处理
2017年4月中旬至10月中旬,于福建农林大学南区茶学专业教学茶场采制以下试验材料:
(1)以铁观音品种中小开面二、三叶嫩梢的第二叶为供试材料,用于CsNCED2全长克隆验证。
(2)采摘铁观音品种中小开面嫩梢的第二叶、根、茎、花和成熟果,用于研究NCED2在不同组织部位表达模式。
(3)以无性系2年生铁观音盆栽幼苗为材料,进行非生物胁迫处理[22-23]。干旱处理:小心取出整棵茶树,用自来水洗净根上泥土并防止根系受损,没入纯净水中约15 min,将茶树移入配制好的质量浓度为100 g·L-1PEG溶液中,分别在处理后的0、4、12 h取样;低温处理:使用人工气候箱进行4 ℃低温胁迫,取0、1、3、6、12、24、48、72 h处理样;外源ABA处理:用100 μmol·L-1ABA溶液喷洒茶树,进行ABA胁迫,取0、6、12、24、48、72 h处理样。
(4)以铁观音品种中小开面二、三叶嫩梢为原料,按照闽南乌龙茶加工工艺付制[24],在此过程中取鲜叶、晒青叶、一摇后、二摇后、三摇后和杀青前各工序的乌龙茶在制品第二叶。
(5)以福鼎大白茶一芽二叶嫩梢为原料,放置室内按白茶萎凋工艺付制。室温控制在22~25 ℃,相对湿度在70%~75%。取萎凋0、0.25、1、4、8、12、24、48 h白茶萎凋叶在制品。
上述各样品设置3次生物学重复,用锡箔纸包好立即投入液氮冷冻完全,再放置-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1总RNA提取和cDNA合成各供试材料用液氮研磨后取0.1~0.2 g,按照天根多糖多酚植物总RNA提取试剂盒RNAprep Pure Plant Kit(Polysaccharides & Polyphenolice-rich,离心柱型)说明书方法提取茶树总RNA。RAN完整性通过1%琼脂糖凝胶电泳检测,浓度和纯度使用NanoDrop2000超微量分光光度计测定。达到实验要求的总RNA移入-80 ℃冰箱保存备用。
按照TaKaRa的PrimeScriptTM1st strand cDNA Synthesis Kit试剂盒合成cDNA,用于后续的RT-PCR和qRT-PCR。
1.2.2CsNCED2基因全长cDNA克隆根据转录组数据[19]分析得到CsNCED2基因序列,Blastx比对结果显示具有完整开放阅读框。在该序列上下游的起始、终止密码子附近设计全长引物CsNCED2-f-F和CsNCED2-f-R进行RT-PCR扩增(表1)。50 μL RT-PCR扩增体系为:模板1 μL,TransStart KD Plus DNA 聚合酶1 μL,5×TransStart KD Plus 缓冲液10 μL,dNTPs 4 μL,引物1 μL,ddH2O补足至50 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,56 ℃退火30 s,68 ℃反应2 min,68 ℃延伸10 min,35个循环。PCR产物经1%琼脂糖凝胶电泳验证后割胶回收纯化,立即连接到pEASY-Blunt Zera Cloning载体,质粒转入Trans1-T1感受态细胞,挑选3个阳性克隆菌液送至广州擎科生物技术有限公司测序。
1.2.3CsNCED2基因生物信息学分析基因全长序列在NCBI网站进行ORF查找和同源性分析;序列经过ClustalW比对后利用MEGA7.0 软件采用邻近相连法构建系统发育进化树;使用DNAMAN软件进行多序列联配比对;利用在线分析工具http://expasy.org/tools中的ProtParam、TargetP、SingalP4.1 Server、ChloroP软件对编码氨基酸序列进行理化性质、亚细胞定位和信号肽的生物信息学分析;利用NetPhos 3.1 Server、TMHMM server2.0、FoldIndex软件进行磷酸化位点、跨膜结构、可折叠特性分析;使用GOR4、SWISS-MODEL软件模拟蛋白质二、三级结构并用Pymol软件进行编辑。
1.2.4CsNCED2基因表达模式分析根据CsNCED2全长cDNA序列设计荧光定量PCR特异性引物qCsNCED2-F和qCsNCED2-R(表1)。采用TransStart®Tip Green qRT-PCR superMix试剂盒,按照说明书进行实验操作,在Bio-Rad CFX96 Touch荧光定量PCR仪上检测CsNCED2基因表达,分析铁观音不同组织部位、白茶萎凋和乌龙茶做青过程,以及低温、干旱和外源ABA非生物胁迫条件下的相对表达模式。实验结果利用Excel 2016按照2-ΔΔCt方法进行计算。
2 结果与分析
2.1 CsNCED2基因克隆及序列分析
从茶树转录组获得的CsNCED2序列进行比对,结果显示有完整的ORF。在ORF两端设计引物扩增其全长获得大约1 900 bp目的条带(图1),测序拼接后得到完整cDNA。Blastn结果表明,与葡萄VvNCED2 (AAR11194.1)相似性最高,达到78%,因此命名为CsNCED2(NCBI登录号为MF765770)。该序列全长1 931 bp,包含42 bp 5′非编码区(5′-UTR),1 821 bp ORF以及68 bp 3′非编码区(3′-UTR),共编码606个氨基酸残基。
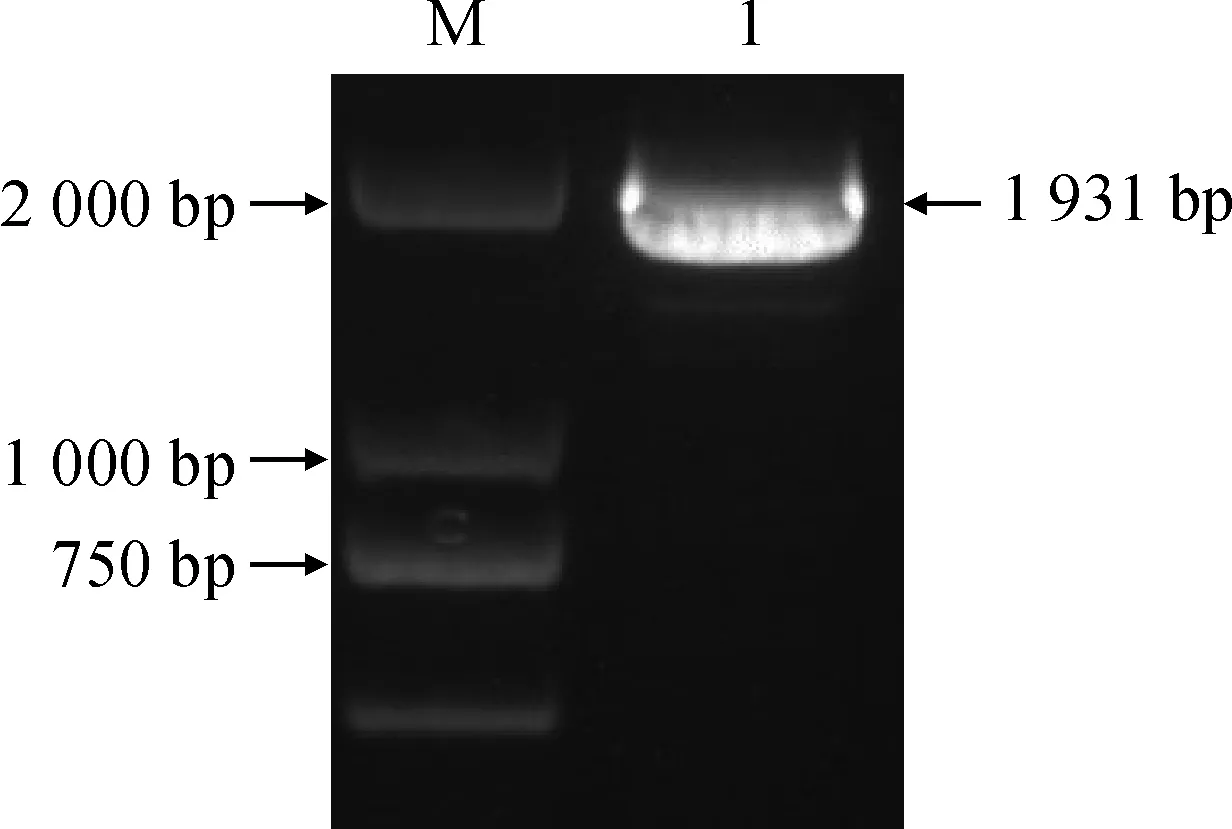
M.DL2000;1.CsNCED2基因PCR产物图1 CsNCED2基因全长扩增M.DL2000;1.PCR products of CsNCED2Fig.1 The full length amplification of CsNCED2

表1 引物序列

阴影为叶绿体转运肽;方框为起始密码子和终止密码子;下划线为NCED基因保守结构域FLNO2258图2 CsNCED2基因核酸序列及其编码氨基酸序列A putative chloroplast-targeting transit peptide is in shadow. The start and stop codons are framed. NCED gene specific hits FLNO2258 is underlinedFig.2 Nucleotide sequence and deduced amino acid sequence of CsNCED2 cDNA
2.2 CsNCED2蛋白理化性质和结构分析
对CsNCED2蛋白序列进行理化性质预测分析,结果表明,蛋白分子量为67 665.88 Da,共编码606个氨基酸。理论等电点为6.27,半衰期30 h,总平均亲水性为-0.332,不稳定系数为44.43,表明该蛋白为不稳定的亲水蛋白。
NetPhos 3.1 Server磷酸化位点分析推测CsNCED2多肽链上共有61个磷酸化位点。TMHMM server2.0预测显示不存在跨膜结构。TargetP结果表明位于叶绿体。SingalP4.1 Server预测CsNCED2蛋白序列不存在信号肽序列,属于非分泌性蛋白。ChloroP预测显示(图2)CsNCED2蛋白含有叶绿体转运肽,为第1~50个氨基酸残基。已有研究结果显示,NCED在叶绿体中催化紫黄质或新黄质等环氧类胡萝卜素形成黄质醛这一重要的ABA前体物质[10],进一步推测CsNCED2蛋白属于NCED家族。
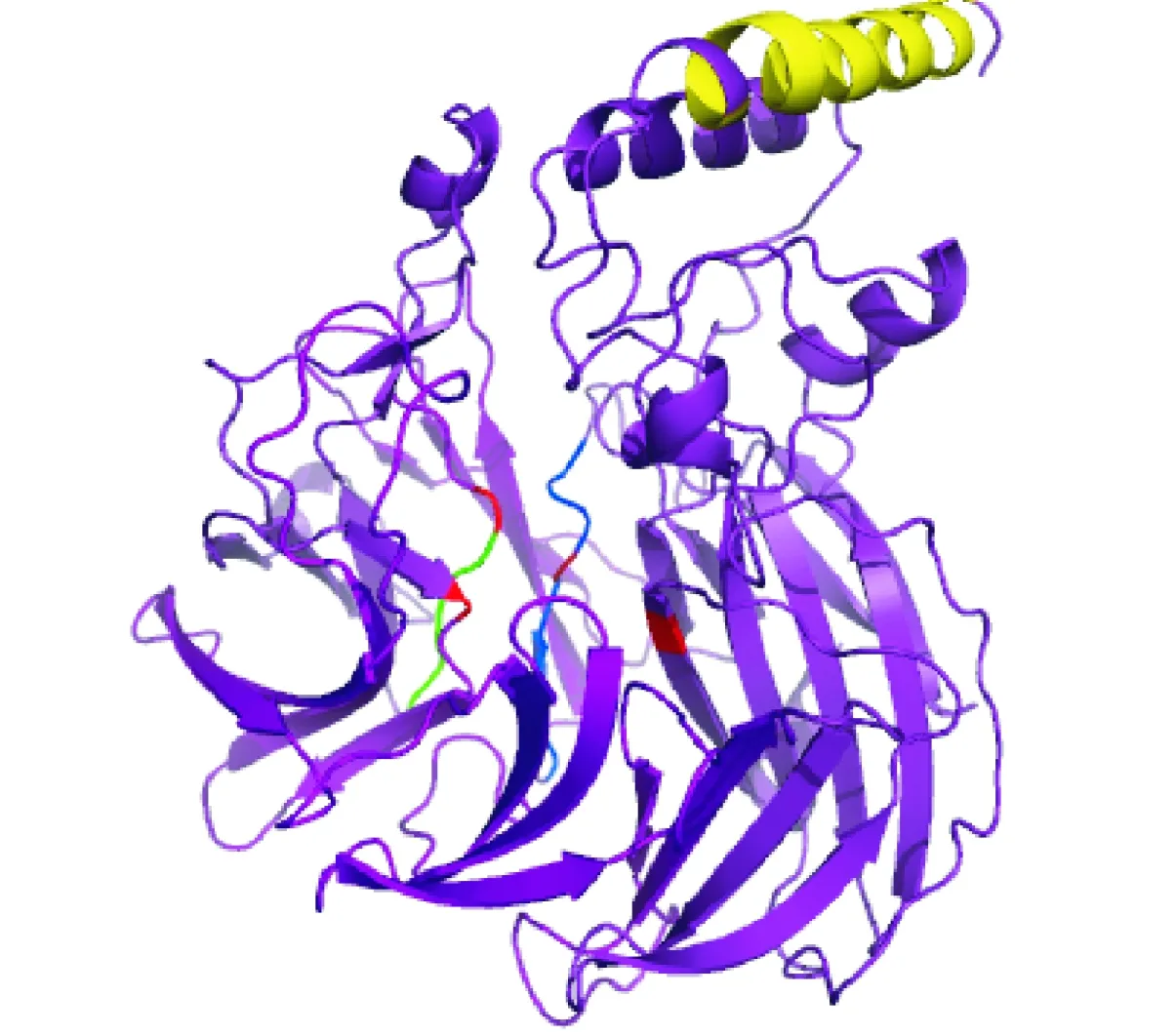
4个活性保守位点用红色表示,黄色表示具有亲水脂性的α螺旋区,蓝色为NCED蛋白特征保守结构域序列MIAHPKxDP,绿色为NCED蛋白特征保守结构域序列HDFAITE图3 CsNCED2蛋白三维结构Four conserved histidine residues required for activity with color of red. The putative amphipathic a-helix domain with color of yellow. The conserved domain of NCED protein MIAHPKxDP with color of blue. The conserved domain of NCED protein HDFAITE with color of greenFig.3 Three-dimensional structure analysis of CsNCED2 protein
FoldIndex软件可折叠特性预测结果显示有序氨基酸残基数量占序列总比例的77.22%,判断CsNCED2是一个有序蛋白。CsNCED2蛋白二级结构包括24.75%的α螺旋,57.76%的无规则卷曲和17.49%延伸链。CsNCED2蛋白三级结构与玉米VP14蛋白(3npe.1.A)相似性高达70.25%,并基于此建模。GMQE分值为0.76,说明该模型建立的可信度较高。通过Pymol软件编辑输出3D结构(图3)。
2.3 CsNCED2蛋白序列联配及系统发育树分析
进行Blast同源及保守结构域分析比对,结果发现,CsNCED2属于9-顺式-环氧类胡萝卜素双加氧酶家族,具有植物NCED家族保守结构域FLNO2258。CsNCED2与多个物种的NCED有较高的相似性,均在70%以上。其中与葡萄VvNCED2 (AAR11194.1)、可可TcNCED5(EOY27680.1)和柑橘CrNCED5 (ASK51187.1)相似性分别达到78%、77%和77%。

方框表示NCED家族特有保守结构域序列MIAHPKxDP和HDFAITE;*表示4个活性保守位点;1.茶树CsNCED2;2.葡萄VvNCED2;3.柑橘CrNCED5;4.可可TcNCED5;5.甜橙CsNCED2;6.柚子CmNCED2;7.砂梨PpNCED3图4 CsNCED2氨基酸序列与其他植物的多重序列比对The conserved domain of NCED protein MIAHPKxDP and HDFAITE are framed; * expression four conserved histidine residues required; 1.Camellia sinensis;2.Vitis vinifera;3.Citrus reticulata;4.Theobroma cacao;5.Citrus sinensis;6.Citrus maxima;7.Pyrus pyrifolia Fig.4 Multiple alignment of amino acid sequences of CsNCED2 and homologous genes in other plants
从NCBI数据库中下载相似度较高的已经报道的NCED蛋白序列,利用DNAMAN软件进行联配比对,结果显示(图4),90~606氨基酸残基与其他物种序列高度匹配。它们都具有亲水脂性的α螺旋区、NCED家族特有保守结构域序列MIAHPKxDP和HDFAITE以及4个活性保守位点,与之前报道的结果一致[28-29]。茶树CsNCED2与其他13种植物的系统发育树分析结果(图5)表明,CsNCED2与葡萄VvNCED2聚为一类,说明二者的亲缘关系最近。
2.4 CsNCED2荧光定量表达模式分析
2.4.1不同组织部位表达模式分析CsNCED2在铁观音茶树不同组织部位相对表达量显示(图6,A),该基因在根、茎、叶、花、果中均有表达,但是表达模式差异较大。在花中的表达量最高,而在根和果中表达量较低。
2.4.2在白茶和乌龙茶加工过程中表达模式分析检测CsNCED2在白茶、乌龙茶加工过程中的表达模式,结果显示,在白茶萎凋过程中(图6,B),从0~12 h表达量缓慢增加,在萎凋24 h时显著上调并且达到峰值,之后下降但表达水平依然显著高于0 h时的表达水平。在乌龙茶做青过程中(图6,C),从鲜叶至晒青结束,CsNCED2表达量显著增加了3倍,达到第一个峰值。在之后的摇青阶段下降至本底水平,直到杀青前被诱导而显著增加了3倍达到第二个峰值。
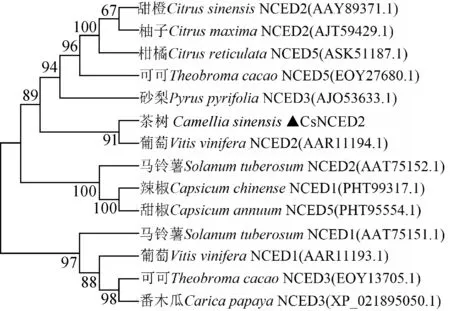
图5 CsNCED2蛋白系统发育树Fig.5 Phylogenetic tree of CsNCED2 protein
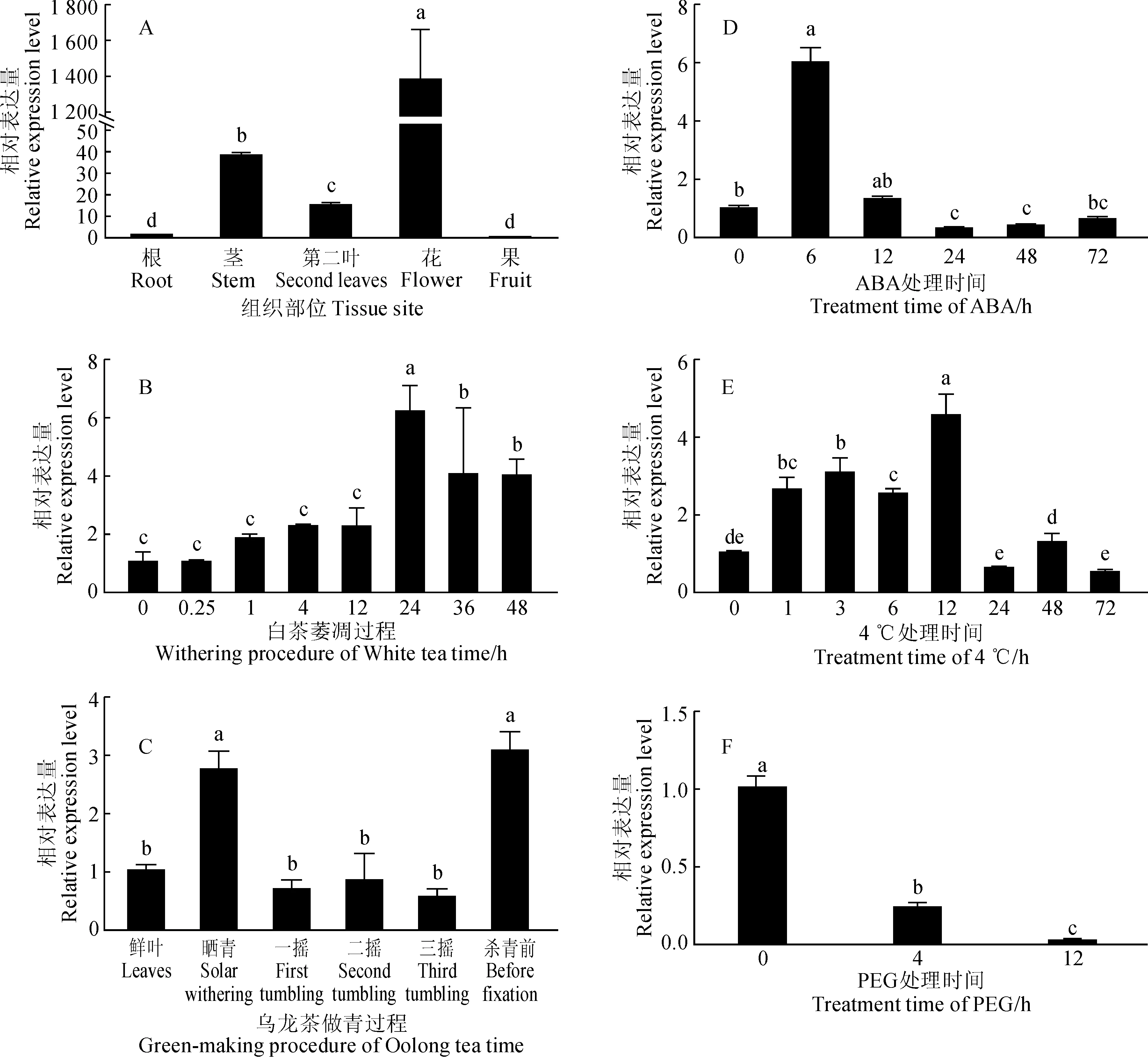
不同小写字母表示显著差异水平(P<0.05)图6 CsNCED2表达分析The different normal letters indicate significant difference at 0.05 levelsFig.6 Expression analysis of CsNCED2
2.4.3非生物胁迫下表达模式分析100 μmol·L-1外源ABA处理下(图6,D),CsNCED2在6 h的表达量较0 h显著上调了6倍,处理24 h后,其表达量显著下调。
4 ℃低温处理下(图6,E),0~12 h内快速上调,在1 h就达到显著水平,12 h时表达量最高。随着处理时间的延长,24和72 h时的表达水平显著降低。
从对干旱胁迫响应的表达模式可看出(图6,F),在100 g·L-1PEG处理过程中,随着干旱胁迫的加剧,CsNCED2的表达量持续显著下调。
3 讨 论
ABA参与到植物生长发育和逆境胁迫响应的重要调节过程中[30-31],NCED作为关键限速酶直接调控内源ABA含量[32]。本研究克隆得到一个茶树CsNCED2基因,具有NCED家族保守结构域FLNO2258以及MIAHPKxDP和HDFAITE特征序列,与前人研究结果一致[33]。已有研究表明NCED氨基酸中的组氨酸残基可以结合Fe2+使NCED蛋白发挥功能[34],并且存在叶绿体转运肽结构[35]。CsNCED2蛋白氨基酸存在4个组氨酸活性位点,另外亚细胞定位于叶绿体并具有N-端叶绿体靶向信号肽序列,这进一步证明CsNCED2具有在质体中裂解环氧类胡萝卜素生成ABA前体的生物活性。系统发育树显示与葡萄VvNCED2亲缘关系最近,氨基酸序列相似性达到78%。
CsNCED2在不同组织部位的表达存在显著差异。CsNCED2在茎、叶和花中的表达量显著高于根和成熟的果实,而在花中的表达又显著高于茎和叶。Tian等[35]通过半定量PCR(semiquantitative RT-PCR)检测枸杞LcNCED基因在根、茎、叶花中也存在相同的模式,随着果实成熟表达量逐渐下降,在成熟期的果实中表达量同样很低。Wang等[36]在黄瓜转录本中的研究表明NCED可能参与果实的成熟调控。
茶树叶片在加工过程中遭受到许多胁迫的影响,例如干旱、高温、光照和翻动等,而这些也正是茶叶品质形成的关键[37-38]。本试验结果显示,在白茶萎凋前期CsNCED2表达量增加缓慢,萎凋后期表达量维持在高水平。乌龙茶加工过程中CsNCED2在晒青和杀青前的室内摊放过程中上调表达。Cho等[21]发现NCED表达量和ABA含量都在乌龙茶晒青阶段迅速增加,并指出ABA合成基因不仅受到加工胁迫的诱导,而且内源ABA的增加将提高茶叶中挥发性化合物的含量。Baldermann等[39]同样认为茶叶对各种胁迫的防御反应可能导致加工过程中的香气形成。曹潘荣等[40-41]研究表明干旱、低温胁迫可以不同程度地增加茶树芳香物质组分。本试验中,经过了短时间日光晒青(30 min)后CsNCED2表达量同样显著提高。在非胁迫条件下光照不能增加内源ABA含量和NCED表达,反之在干旱或者低湿度胁迫下则均能提高[42-44]。因此推测茶叶加工所造成的胁迫诱导了CsNCED2上调表达,参与了ABA调控和胁迫响应,但与茶叶品质的关系还未明确。
植物将外界环境的胁迫压力转换为ABA这种化学信号,从而能够适应逆境状态[30]。例如Sussmilch等[45]发现膨压是调控AtNCED3表达的重要信号,增大细胞膨压后拟南芥AtNCED3可以快速响应,内源ABA也在几分钟内迅速积累。本研究发现CsNCED2对不同非生物胁迫的响应机制不同,在外源ABA和4 ℃低温处理下,CsNCED2表达量迅速提高,分别在6 h和12 h之后迅速降低。在PEG处理下,CsNCED2表达量随着胁迫时间延长而持续下降。Iida等[46]的研究表明穿叶眼子菜PpNCED3在各种逆境胁迫下表达水平不同,受低温和外源ABA诱导上调表达,而在PEG处理2 h后表达量即受抑制而下调。据报道,干旱胁迫使得茶树CsNCED1和CsNCED4转录水平上调[19],NCED可以通过调节气孔运动和增加抗氧化酶活性提高茶树[20]和柱花草[47]抗逆性。总的来说,CsNCED2对低温和ABA处理前期更加敏感,但表达受到干旱胁迫抑制。CsNCED2在茶树抵御非生物胁迫中发挥重要作用,介导了以ABA含量为基础的气孔开闭和胁迫氧化应激反应。
目前,茶树NCED家族基因还未完全清楚,已公布的也较局限于cDNA序列,基因组序列和启动子等非编码序列的报道还很少,具有调控作用的顺式作用元件和转录调控因子值得深入挖掘。ABA介导的气孔调控不仅涉及茶树非生物胁迫,而在抵御病原菌等生物胁迫中也有重要作用,因此可以进一步开展生物胁迫下NCED的响应模式分析。由胁迫带来的茶树品质改变,特别是与ABA含量和关键代谢基因NCED的关系还值得后续深入研究。本研究克隆了铁观音CsNCED2基因,进一步确定了CsNCED2在低温、外源ABA介导的胁迫响应中发挥重要作用,为后续在模式植物中实现异源表达和茶树ABA下游信号传导途径的研究提供理论依据。

